实验三、红外吸收光谱实验报告

一、实验目的
1、掌握红外光谱分析法的基本原理。
2、掌握智能傅立叶红外光谱仪的操作方法。
3、掌握用KBr压片法制备固体样品进行红外光谱测定的技术和方法。
4、了解基本且常用的KBr压片制样技术在红外光谱测定中的应用。
5、 通过谱图解析及标准谱图的检索,了解由红外光谱鉴定未知物的一般过程。
二、实验原理
红外光谱法又称“红外分光光度分析法”。简称“IR”,是分子吸收光谱的一种。它利用物质对红外光区的电磁辐射的选择性吸收来进行结构分析及对各种吸收红外光的化合物的定性和定量分析的一法。被测物质的分子在红外线照射下,只吸收与其分子振动、转动频率相一致的红外光谱。对红外光谱进行剖析,可对物质进行定性分析。化合物分子中存在着许多原子团,各原子团被激发后,都会产生特征振动,其振动频率也必然反映在红外吸收光谱上。据此可鉴定化合物中各种原子团,也可进行定量分析。
(1)红外光谱产生条件
1)辐射应具有能满足物质产生振动跃迁所需的能量:即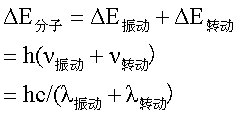
2)辐射与物之间有相互耦合作用,产生偶极矩的变化。(没有偶极矩变化的振动跃迁,无红外活性,没有偶极矩变化、但是有极化度变化的振动跃迁,有拉曼活性。)
(2)应用范围
红外光谱对样品的适用性相当广泛,固态、液态或气态样品都能用该方法进行分析,无机、有机、高分子化合物也都可检测。
1)红外光谱分析可用于研究分子的结构和化学键,也可以作为表征和鉴别化学物种的方法。
2)红外光谱具有高度特征性,可以采用与标准化合物的红外光谱对比的方法来做分析鉴定。
3)利用化学键的特征波数来鉴别化合物的类型,并可用于定量测定。
4)红外吸收峰的位置与强度反映了分子结构上的特点,可以用来鉴别未知物的结构组成或确定其化学基团;而吸收谱带的吸收强度与化学基团的含量有关,可用于进行定量分析和纯度鉴定。
(3)定性分析
传统的利用红外光谱法鉴定物质通常采用比较法,即与标准物质对照和查阅标准谱图的方法,但是该方法对于样品的要求较高并且依赖于谱图库的大小。如果在谱图库中无法检索到一致的谱图,则可以用人工解谱的方法进行分析,这就需要有大量的红外知识及经验积累。大多数化合物的红外谱图是复杂的,即便是有经验的专家,也不能保证从一张孤立的红外谱图上得到全部分子结构信息,如果需要确定分子结构信息,就要借助其他的分析测试手段,如核磁、质谱、紫外光谱等。尽管如此,红外谱图仍是提供官能团信息最方便快捷的方法。
(4)定量分析
定量分析依据是比尔定律:ecl=log(I0/I)或A=ecl。如果有标准样品,并且标准样品的吸收峰与其它成分的吸收峰重叠少时,可以采用标准曲线法以及解联立方程的办法进行单组分、多组分定量。对于两组分体系,可采用比例法。
三、实验仪器和试剂
(1)实验仪器:769YP-15A粉末压片机及配套压片模具、玛瑙研钵、VERTEX70傅立叶变换红外光谱仪。
(2)仪器构成:红外光谱仪是由光源、样品室、单色器以及检测器等部分组成。如下图所示:光源发出的光被分束器分为两束,一束经反射到达动镜,另一束经透射到达定镜。两束光分别经定镜和动镜反射再回到分束器。动镜以一恒定速度作直线运动,因而经分束器分束后的两束光形成光程差d,产生干涉。干涉光在分束器会合后通过样品池,然后被检测。傅立叶变换红外光谱仪的检测器有TGS,MCT等。
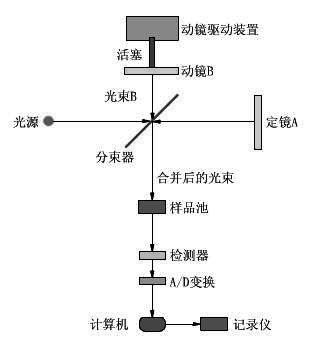
图1,红外光谱仪的组成
(3)实验试剂:苯甲酸样品(AR);KBr(光谱纯);无水丙酮;无水乙醇。
四、实验步骤
1、软件参数设置。
1)打开红外光谱仪电源开关,待仪器稳定30分钟以上,方可测定;
2)打开电脑,选择win98系统,打开opus7.0软件;在Collect菜单下的Experiment Set-up中设置实验参数;
3)实验参数设置:分辨率 4 cm-1,扫描次数16次,扫描范围 4000-400 cm-1。
2、样品制备:压片法。
1)用乙醇洗涤压片所用器具,然后在红外灯下烤干,以下各步骤都在红外灯下完成。
2)研磨被测物体和溴化钾的混合物,取月1.5mg样品,按1:100的比例加入溴化钾,研磨混合物成粉末状,越细越均匀越好。
3)取适量被测物质和溴化钾的混合物倒入模具中。
4)将压模器整体放入压机上,锁上油压开关,推动摇杆,将压力压到10MPa下保持3min,打开油压开关,取出压模器,小心取出样品(均匀透明即可),将压后的薄膜片放入磁性样品架。
3、进行背景测量。
4、进行样品测量。
5、保存数据。
6、重复1-5步骤进行测量(每次样品测量前都要进行背景测量),整理仪器,完成实验。
五、实验数据记录和处理
(1)固体苯酚的结构分析
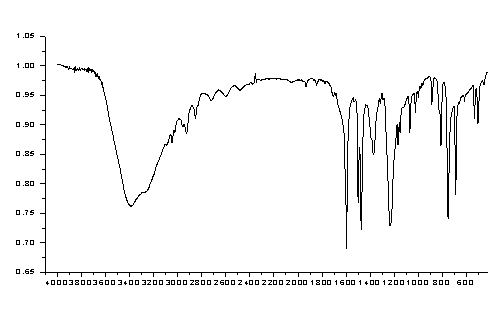
图2.固体苯酚的红外光谱图
图谱分析:
1)波数在3650cm-1-3200cm-1之间出现强宽峰,说明有酚羟基;
2)波数在1600cm-1、1510cm-1、1499cm-1处的强吸收谱带为苯环骨架的伸缩振动,是苯环的特征吸收谱带;
3)波数在1380cm-1处的中等强度吸收谱带为苯环C-H面内弯曲振动;
4)波数在1225cm-1处的强吸收谱带为酚类C-O伸缩振动;
5)波数在1930-1760cm-1处的多个弱吸收峰,及830cm-1、750cm-1、700cm-1处的三个中等强度吸收峰,是苯环单取代的特征吸收峰。
(2)固体苯甲酸的结构分析
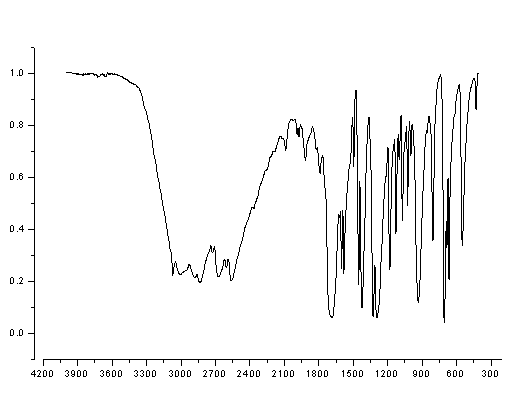
图3.固体苯甲酸的红外吸收光谱
图谱分析:
1)波数在3250-2500cm-1处有中等强度的吸收带,谱带宽,峰形不尖锐。由于羧酸在固体样品中通常以二聚体形式存在,所以存在分子间氢键,该区域内宽、散谱带二聚体羧基中O-H伸缩振动的特征谱带;
2)波数在1770cm-1处的强吸收峰为C=O伸缩振动吸收峰;
3)波数在1650-1510cm-1处的中等强度吸收峰为苯环骨架伸缩振动;
4)波数在1921cm-1、1796cm-1、910cm-1、720cm-1处的吸收峰为苯环单取代的特征吸收峰。
六、思考与讨论
1、比较苯甲酸和苯酚IR图谱的差异,并思考产生差异的原因。
答:
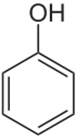
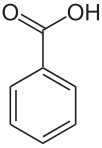
左图为苯酚, 右图为苯甲酸
苯酚和苯甲酸的结构式如上图所示。其结构很相似,都有一个苯环,都具有羟基。最大的不同是苯甲酸多了一个羰基。结构的不同导致了IR谱图的不同。
(1)最为明显的差异就是在苯甲酸的IR图谱中在1770cm-1处有一个强吸收峰,这是羰基的特征吸收峰;
(2)另外,从IR谱图中明显可以看出,在官能团区两种物质的宽吸收峰的形状不同,相比较而言,苯甲酸的羟基伸缩振动较苯酚处于更低波数,这是由于在苯甲酸中羟基与羰基相连;
(3)苯环取代基不同,对苯环的影响不同。羧基与苯环存在共轭效应,而羟基与苯环存在诱导效应和共轭效应,且诱导效应占主导地位,最终使得苯环骨架的伸缩振动不同,其中苯酚由于羟基的强吸电子作用使的1500cm-1处的吸收峰很弱。
2、用FT-IR仪测试样品的红外光谱时为什么要先测试背景?
答:FT-IR仪测试样品的红外光谱时要先测试背景是因为空气中含有较多量的CO2和H2O会影响测定结果的准确性,所以在测定样品之前需要先测定背景。
第二篇:物理化学实验报告-溶液中的吸附作用和表面张力的测定实验报告
实验十二 溶液中的吸附作用和表面张力的测定
摘要:本实验采用最大气泡压力法测定了液体表面张力,通过对不同浓度下正丙醇溶液的表面张力研究其和浓度之间的关系。初步探讨了表面张力的性质、表面能的意义以及表面张力和吸附作用的关系。
关键词:吸附作用、表面张力、最大气泡法
The measurement of the adsorption effect and surface tension
Abstract: In this experiment, according to Gibbs formula and Langmuir equal-temperature equation, we apply the biggest bladder pressure method to research the relationship between the amount of absorption and the consistency of a substance in the solution besides the surface tension. The phenomenon show that the consistency of a substance in the surface of the solution is different from that inside is called absorption.
Keyword:Surface tension, The biggest bubble pressure method, Absorption effect
1. 序言
物体表面的分子和内部的分子所处的境况不同,因此能量也不同,表面张力就是内部分子对表面分子的作用力,它是液体的重要属性之一,与所处的温度、压力、液体的组成共存的另一面的组成等因素都有关。对于溶液,由于溶质会影响表面张力,因此可以调节溶质在表面层的浓度来降低表面自由能。
根据能量最低原理,溶质能降低溶液的表面张力时,表面层中溶质的浓度应比溶液内部大,反之,溶质使溶液的表面张力升高时,它在表面层中的浓度比在内部的浓度低,这种表面浓度与溶液里面浓度不同的现象叫“吸附”。在指定温度和压力下,吸附与溶液的表面张力及溶液的浓度有关。
溶液的表面张力是溶液的一个重要物理参数。要计算溶液的表面自由能、最大吸附量等都必须精确测定其溶液的表面张力。测定它的方法较多,如毛细管上升法、滴重法、吊环法和最大气泡法,但最简单、实用、普遍的方法是最大气泡法。本实验正是采用该法测定液体不同浓度条件下的表面张力,探究表面张力、表面能与吸附作用的关系,并验证了表面化学的相关基础理论。
2. 实验部分
2.1 实验仪器与试剂
CS501型超级恒温水浴 1台 重庆试验设备厂
DMP-2B型数字式微压差测量仪 南京大学应用物理研究所
恒温套管,250ml分液漏斗,毛细管(半径为0.15—0.2mm);
100ml容量瓶(7只),2ml移液管(1支);
正丁醇溶液(分析纯)
2.2 实验步骤
1)按实验装置图装好仪器,打开恒温水浴,使其温度稳定于35℃。取一支浸泡在洗液中的毛细管依次用自来水、蒸馏水反复清洗若干次,同样把玻璃套管也清洗干净,加上蒸馏水,插上毛细管,用套管下端的开关调节液面恰好与毛细管端面相切,使样品在其中恒温10分钟。在分液漏斗中加入适量的自来水,注意切勿使体系漏气。然后调节分液漏斗下的活塞使水慢慢滴下,这时体系压力逐渐减小,直至气泡由毛细管口冒出,细心调节出泡速度,使之在5-10秒钟内出一个。注意气泡爆破前数字式微压差测量仪的读数,并用电脑采集数据得到最大的压差值,取连续6个数据取平均值;
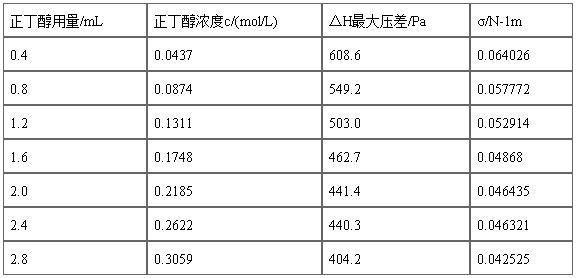
2)用2mL移液管分别移取0.40ml、0.80ml、1.20ml、1.60ml、2.00ml、2.40ml、2.80ml正丁醇到100ml容量瓶中,然后稀释到刻度。重复上述实验步骤,按照由稀至浓的顺序依次进行测量。
2.3 注意事项
1)测定用的毛细管一定要先洗干净,否则气泡可能不能连续稳定地通过,而使压力计的读数不稳定;
2)毛细管一定要垂直,管口要和液面刚好接触,,否则测得的数据将不只是液体表面的张力,还有插入部分液体的压力;
3)表面张力和温度有关,因此要等溶液恒温后再测量。
4)控制好出泡速度,读取压力计的压力差时,应取气泡单个逸出时的最大压力差。
3. 结果与讨论
3.1 实验结果
毛细管常数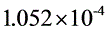
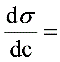 -0.12879-0.75444*c+10.22178*c^2-23.02024*c^3
-0.12879-0.75444*c+10.22178*c^2-23.02024*c^3
Г=4.222*10-6N/m
正丁醇分子的横截面积 S0=3.934×10-19 m2
查得文献中的直链醇类横截面积理论值为2.74×10-19~2.89×10-19m2 ,取二者平均值2.82×10-19 ,相对误差为:(3.934-2.82)/2.82=39.5%
σ~c图、Г~c图、c/Г~c图详见附件。
3.2 误差分析
本次试验测得的正丁醇分子的横截面积比理论值要大,但处于同一个数量级;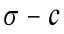 、Г-c、c/Г-c图中某些点与总体趋势不同,与理论曲线大体吻合。作为一种低成本的方法,最大气泡法有吸附难以达到平衡的缺点,精度不高是可以理解的。下面我对实验的误差因素进行全面的分析。
、Г-c、c/Г-c图中某些点与总体趋势不同,与理论曲线大体吻合。作为一种低成本的方法,最大气泡法有吸附难以达到平衡的缺点,精度不高是可以理解的。下面我对实验的误差因素进行全面的分析。
1 最大压差△P值的测量误差
1)在每次改变测量溶液浓度之后,应该用待测溶液反复清洗毛细管和恒温套管,在实际操作中残留是不可避免的,这样使测量溶液的表面张力与实际溶液的浓度不一致,导致实验误差;
2)实验要求毛细管底部与液面正好相切,并且毛细管完全的垂直,实际上这很难到达,而且实验指导上也没有明确的方法使我们做到这两点;
3)由于毛细管管径很小,当正丁醇浓度增大时,体系粘度变大,管壁上容易吸附正丁醇分子,使得气泡冒出很不规则,造成数据波动很大;
4)毛细管的粗细均匀程度及磨损程度都会对结果造成影响;
5)出泡速度会影响△P值的读数,而出泡速度并不能精确控制使得每次的速度相同,若气泡产生速率偏快,会使测定最大压力差值偏大,过慢则会偏小;
6)装置气密性不好,有些许漏气会使测定最大压力差值偏小;
7)其它系统误差,如恒温槽温度的小幅变动。
②数据处理
1) 我们在数据处理的过程中使用了浓度而不是活度。只有在稀溶液情况下,浓度才近似等于活度,而实验溶液的正丁醇浓度并不是很稀的,导致计算的正丁醇分子截面积偏差较大。这一点从Г-c图上明显可以看出,在浓度变大后曲线有明显的下降,与理论曲线存在较大的出入;
2)σ~c曲线拟合形式的不同会最终造成Γ~c图及 c/Г~c图与理论情况的偏差。
3.3 讨论与思考
(1)关于相关曲线的讨论
1)由σ~c图可知,正丁醇溶液的表面张力σ随着其浓度的增加而逐渐降低,为正吸附,故正丁醇是一种表面活性物质。当正丁醇的浓度增大到一定值时,溶液的表面张力σ的随浓度的变化较小,此时有可能已经形成了单分子层的饱和吸附层;
2)由Г-c图可知,当浓度较小时,随着浓度的升高,吸附量逐渐增加。
(2)实验改进
在实验中将带毛细管的木塞插入试管,若木塞没有塞正,可导致毛细管与液面不垂直;若加入试管中溶液的量控制得不准,可导致毛细管插入液面深浅不一,需要多次调节液面高度,操作起来烦琐,往往要反复几次才能完成。我们可以对实验装置进行如下改进,简化实验操作。
1)样品管的改动:我们将样品管设计成套管,套管上端为磨口,与带毛细管的磨口塞配套。用磨口塞固定毛细管的位置,这可以使毛细管保持与液面垂直,避免了用木塞固定毛细管的随意性。外管两侧上下支管与恒温槽相连,构成整个实验体系的恒温循环装置。内管装样品,内管侧面支管与压力计连接。套管下端管口接活塞,通过旋转活塞可非常方便、灵活地调节液面高度使之与毛细管相切,操作起来非常简便。
2)增加1个三通双支真空活塞:在压力计和滴液漏斗之间增加1个三通双支真空活塞,在调节毛细管端面与液面相切时,先将三通双支真空活塞转向一支通大气以防止体系产生负压,再转向另一支与体系相通进行测量。这样减少了传统装置操作时,在每次测量之前需反复提出毛细管以平衡体系与大气压差的麻烦,并可以在两次测量之间,快速使系统与大气之间的压力平衡,使读数误差减小。
(3)实验心得
本次实验我学到了关于溶液表面张力的相关知识,并了解了最大气泡法的相关操作。虽然实验操作步骤简单,但造成误差的因素较多,操作时要格外仔细。另外,调节气泡使其均匀冒出且速度适中是本实验的难点,我在第一组测量中遇到了较大的麻烦,经过助教老师的帮助,我也渐渐掌握了调气泡的要领,即先把气泡调出来,然后关闭活塞使其稳定,中途大概估计出泡时的压力,再缓缓打开活塞,一直微调到压力数在一定区间稳定波动。
参考文献
[1] 崔献英,柯燕雄,单绍纯.物理化学实验[M].中国科技大学出版社,2000: 29~32.
[2] 付献彩,沈文霞,姚天扬,侯文华.《物理化学》(第五版)下册[M].南京大学化学化工学院,高等教育出版社,2005.
[3] 曹红燕,李建平,董超,胡玮.最大气泡法测定溶液表面张力的实验探讨[J].实验技术与管理,23(8),2006:39—41.
[4] 任川宏,蒋珍菊,王玲,唐孝荣最大气泡法测定溶液表面张力非正常状况的分析与处理[J]. 高等教育研究,24(2),2007:63—64.
附件:实验数据处理
1. 数据记录
恒温槽温度:35.15
Table A1.原始数据记录
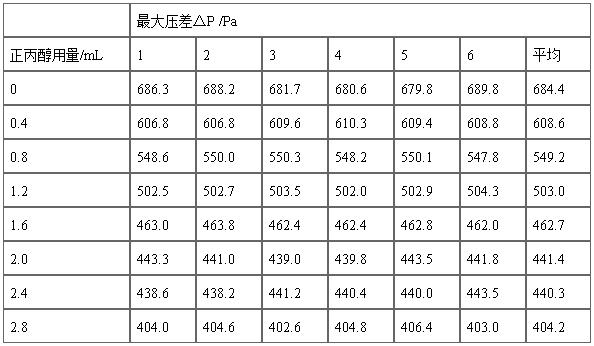
2. 数据处理
2.1 毛细管常数的测定
25摄氏度时水的表面张力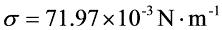
故毛细管常数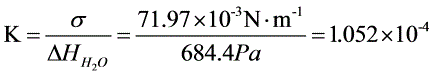
2.2 不同浓度正丁醇溶液表面张力的测定及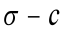 图的绘制
图的绘制
由公式:
C=ρV/MV0
σ= KΔP
ρ=0.810g/mL,M=74.12
将Table A1中的数据进行计算,结果如Table A2所示。
Table A2
根据Table A2中的数据进行4次拟合得到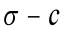 图
图
Fig A1.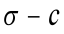 图
图
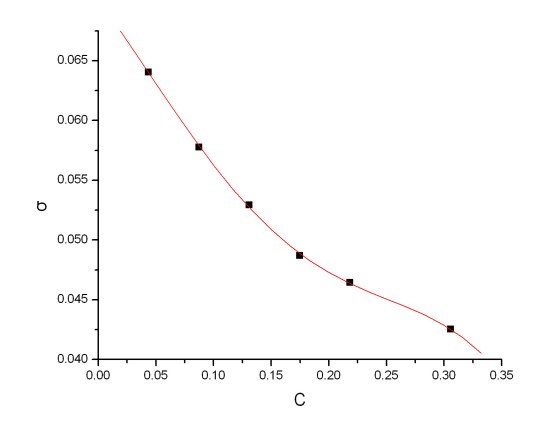
注:由于正丁醇用量为2.4mL时与其他数据偏差较大,故将其舍去。
Y = A + B1*X + B2*X^2 + B3*X^3 + B4*X^4
Parameter Value Error
------------------------------------------------------------
A 0.07009 0.00243
B1 -0.12879 0.08708
B2 -0.37722 0.98387
B3 3.40726 4.3326
B4 -5.75506 6.42606
------------------------------------------------------------
R-Square (COD) SD N P
------------------------------------------------------------
0.99966 3.22706E-4 6 0.02747
2.3 Г-c图和c/Г-c图的绘制
由上面拟合的结果可知:
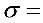 0.07009 -0.12879*c -0.37722*c^2 +3.40726*c^3-5.75506 *c^4
0.07009 -0.12879*c -0.37722*c^2 +3.40726*c^3-5.75506 *c^4
故 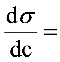 -0.12879-0.75444*c+10.22178*c^2-23.02024*c^3
-0.12879-0.75444*c+10.22178*c^2-23.02024*c^3
由Gibbs公式:
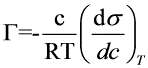
得:
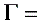 - (-0.12879*c -0.75444 c^2 +10.22178*c^3-23.02024*c^4)/RT
- (-0.12879*c -0.75444 c^2 +10.22178*c^3-23.02024*c^4)/RT
将不同溶液的浓度代入上式可得吸附量Г值及c/Г值,结果如下表所示。
Table A3
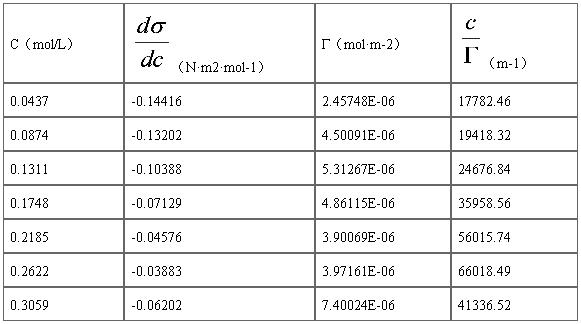
根据Table A3中的计算结果作Г-c图
Fig A2. Г-c图
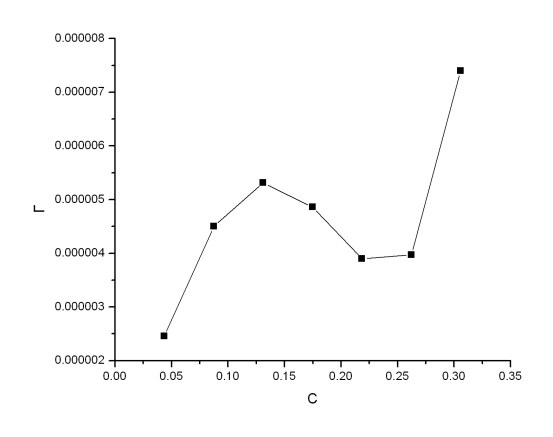
根据Table A3中的计算结果作c/Г-c图并进行线性拟合
Fig A3. c/Г-c图
注:因为最大浓度时偏差很大,故除去最大浓度点后进行线性拟合
Parameter Value Error
------------------------------------------------------------
A 419.65533 5880.5307
B 236844.80549 34553.33841
------------------------------------------------------------
R SD N P
------------------------------------------------------------
0.95997 6316.70325 6 0.00237
2.4 正丙醇的吸附Г∞值与S0值的计算
因为 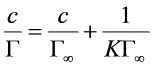
所以 Г=1/B=1/236844.8=4.222*10-6N/m
正丁醇分子的横截面积 S0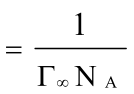 =
=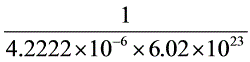 =3.934×10-19 m2
=3.934×10-19 m2
