第九章 化学动力学
核心内容:反应速率和反应机理
主要内容:各级反应速率方程,阿氏方程,有关计算
一、内容提要
1.反应速率定义和反应速率方程
(1)反应速率定义
化学反应: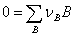 , 反应进度:
, 反应进度:
转化速率:单位时间化学反应的反应进度的变化: 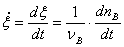
反应速率:单位时间单位体积内化学反应的反应进度的变化:
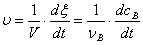 (恒容反应)
(恒容反应)
反应物的消耗速率或产物的生成速率: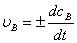
或: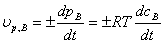 (
( ),
), 
(2)基元反应的速率方程
对于基元反应:aA+bB+… → 产物,有质量作用定律:
反应分子数:
(3)非基元反应的速率方程
对于化学反应:aA + bB + …→ lL + mM+ …
由实验数据归纳得出经验速率方程: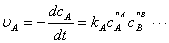
反应级数(总级数):n=nA+nB+…(分级数)
反应级数可以是整数或分数,也可以是正数、零、或负数。
(4)速率方程的积分形式
①零级反应:A→P
微分式 
积分式 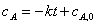
半衰期 t1/2 =
特征:a.  ~
~ 呈线性关系
呈线性关系
b. t1/2与初始浓度成正比
c. k的单位 mol·dm-3·s-1
②一级反应
微分式 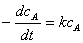
积分式  ,或
,或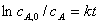 ,或
,或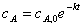
半衰期 t1/2 = ln2/k
特征:a. 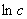 ~
~ 呈线性关系
呈线性关系
b. t1/2与初始浓度无关
c. k的单位s-1
③二级反应
微分式 
积分式 
半衰期 t1/2= 

特征:a. 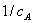 ~
~ 呈线性关系
呈线性关系
b. t1/2与初始浓度成反比
c. k的单位mol-1·dm3·s-1
④n级反应
微分式 
积分式 n¹1 时: ,(n=1时与一级反应的积分式相同)
,(n=1时与一级反应的积分式相同)
半衰期 t1/2= 
 ( n¹1),(n=1时与一级反应的t1/2相同)
( n¹1),(n=1时与一级反应的t1/2相同)
特征:a.  ~
~ 呈线性关系
呈线性关系
b. t1/2与 成反比
成反比
c. k的单位 (mol ?dm-3)1-n ?s-1
(5)反应级数的确定
①微分法:利用速率方程的微分式来求得反应级数的方法。
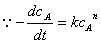 ,
,
以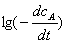 对
对 作图为一直线,直线斜率即为反应级数(多点法)。
作图为一直线,直线斜率即为反应级数(多点法)。
若获得cA,1, cA,2时的反应速率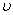 A,1和
A,1和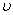 A,2,可求得反应级数(两点法)。
A,2,可求得反应级数(两点法)。
n=
②积分法:利用速率方程的积分式来求得反应级数的方法。
a.计算法:把c~t数据代入不同反应级数的动力学积分式中,求得不同时刻的k,如果按某个公式计算的k为一常数,可判断该级数为反应的级数。
b.作图法:分别作ln c ~ 图,以n(n≠1)为不同值时的
图,以n(n≠1)为不同值时的 ~
~ 图,寻找成直线的图,进而确定反应级数。
图,寻找成直线的图,进而确定反应级数。
c.半衰期法:
n级反应(n≠1) t1/2=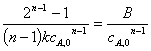
由两组实验数据,可求反应级数(两点法): n=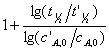
由多组实验数据,亦可求反应级数(多点法): 
以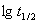 对
对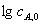 作图得一直线,由斜率可求得n。
作图得一直线,由斜率可求得n。
③ 由速率常数单位判断反应级数。
速率常数k的单位为(mol·dm-3)1-n·s-1,与反应级数有关,因此可根据题中所给k的单位,确定反应级数。
④ 孤立法:如果有两种或两种以上的物质参加反应,可以选择实验条件,除了一种组分外,保持其余组分大量过剩或浓度恒定来求得反应级数。
例如;u=k ,保持B,C大量过剩,求得nA; 保持A,C大量过剩,求得nB; 保持A,B大量过剩, 求得nC,最后得反应级数n = nA + nB + nC。
,保持B,C大量过剩,求得nA; 保持A,C大量过剩,求得nB; 保持A,B大量过剩, 求得nC,最后得反应级数n = nA + nB + nC。
2、温度对反应速率的影响
(1) 范特霍夫规则
 2~4
2~4
(2) 阿伦尼乌斯方程
指数式 k=Ae-Ea/RT
微分式 

积分式  , 或
, 或 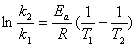
其中:
① Ea为活化能,即每摩尔活化分子的平均能量与每摩尔普通分子的平均能量的差值,定义式 ,② A为指前因子,单位与k相同,③ Ea与A均为常数。
,② A为指前因子,单位与k相同,③ Ea与A均为常数。
 (3)活化能与反应热的关系
(3)活化能与反应热的关系
对于反应
反应平衡常数  ,
, 
恒容反应 Qv=ΔU= Ea,1 - Ea,-1
恒压反应 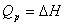 = Ea,1 - Ea,-1
= Ea,1 - Ea,-1
3、典型复合反应
复合反应是两个或两个以上基元反应的组合。
 (1)对行反应
(1)对行反应
一级对行反应 反应起始时cB,0=0
 ,积分可得:
,积分可得:
 ,
,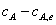 称为反应物A的距平衡浓度差
称为反应物A的距平衡浓度差
Kc=k1/k-1=
对行一级反应进行了距平衡浓度差的一半时所需的时间为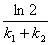
特征:经过足够长的时间,反应物、产物都趋向于各自的平衡浓度。
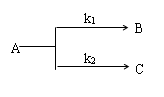 (2)平行反应
(2)平行反应
一级平行反应 ,反应开始时 cB,0= cC,0=0
 积分得:
积分得:


E(表观)=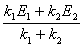
特征:在一定温度下,级数相同的反应,反应过程中产物浓度之比等于速率常数之比。
(3)连串反应
一级连串反应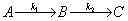 ,反应开始时cB,0= cC,0= 0
,反应开始时cB,0= cC,0= 0
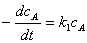 积分得:
积分得:
 积分得:
积分得:
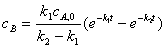

特征:中间产物B的浓度在反应过程中出现极大值。
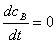 ,可求得中间产物B浓度达到极大值的时间和最大浓度:
,可求得中间产物B浓度达到极大值的时间和最大浓度:
 ,
,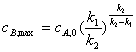
4、复杂反应速率的近似处理法
(1)选取控制步骤法
连串反应的总速率等于最慢一步的速率,最慢一步称为反应速率的控制步骤。
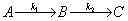
 ,反应总速率
,反应总速率 
(2)平衡近似法
在反应步骤中,前面存在一系列的快速平衡,后面有决定反应速率的控制步骤。
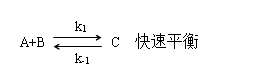
 慢步骤
慢步骤
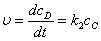 ,而
,而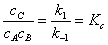
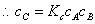 ,
, 
(3)稳态近似法
活泼中间物的生成与消耗速率相等,即活泼中间物处于稳态,其浓度不随时间变化。
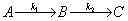 k2
k2 k1
k1
活泼中间物 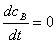 ,由此列方程,解出中间物浓度与反应物浓度的关系。
,由此列方程,解出中间物浓度与反应物浓度的关系。
(4)由反应机理确定反应速率方程
① 确定反应机理;
② 找出反应机理中的慢步骤;
③ 利用上面介绍的方法和质量作用定律,推导出中间产物浓度的表达式;
④ 推导出速率方程的表达式。
5.链反应
链反应是由大量反复循环的连串反应组成。
(1)链反应的基本步骤
①链的引发:产生自由原子或自由基。
②链的传递:自由基与一般分子发生反应,在生成产物的同时,能够再生自由原子或自由基。
③链的终止:自由基、自由原子复合为分子的反应。
(2)链反应的分类
单链反应:在链的传递过程中,消失一个自由基的同时产生出一个新的自由基。
支链反应:在链的传递过程中,消失一个自由基的同时,产生出两个或更多的自由基。
6、溶液中反应
(1) 溶剂对反应组分无明显的相互作用
① 笼效应
溶质分子被周围溶剂分子所包围,可以看作被关在周围分子构成的溶剂笼中,两个溶质分子扩散到同一个笼中成为相邻分子的过程为遭遇。
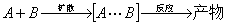
② 扩散控制的反应
菲克扩散第一定律:  ,其中D为扩散系数。
,其中D为扩散系数。
对球形粒子: 

L:阿伏加德罗常数, : 粘度,r:球形粒子的半径
: 粘度,r:球形粒子的半径
二级反应 可推出
可推出

其中rAB = rA + rB f:静电因子。
③ 活化控制的反应:类同气相反应。
(2)溶剂对反应速率的影响
溶剂的极性、溶剂化、粘度等对反应均有明显的作用。
(3)离子强度对反应速率的影响
溶液中加入电解质改变离子强度,进而影响反应速率。
8、催化反应
(1)催化剂的特征
① 催化剂参与催化反应,改变反应历程,催化剂的化学性质和数量不变。
② 催化剂只能缩短达到平衡的时间,而不改变平衡状态。
③ 催化剂不改变反应系统的始末态,不会改变反应热。
④ 催化剂具有选择性。
(2)单相催化反应
包括酸碱催化、络合催化、酶催化。
(3)气-固相催化反应动力学
对于表面反应控制的反应,总反应速率等于最慢的表面反应速率,可利用表面质量作用定律导出反应速率方程。
9、反应速率理论
(1) 气相反应的碰撞理论
气相双分子反应A + B P
P
理论要点:①两反应物分子要发生反应必须发生碰撞。
②不是任何两个反应物分子之间的碰撞都能发生反应,只有碰撞动能大于或等于某临界能,碰撞后才能发生反应。
③反应速率等于单位时间单位体积内发生的碰撞动能ε大于等于临界能εc的碰撞次数。
碰撞数 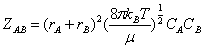

其中 折合质量 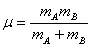 ,摩尔临界能 Ec=Lεc ,kB为玻尔兹曼常数,rA 、rB为分子A 、B的半径,CA、CB为单位体积中的A、B的分子数。
,摩尔临界能 Ec=Lεc ,kB为玻尔兹曼常数,rA 、rB为分子A 、B的半径,CA、CB为单位体积中的A、B的分子数。
(2)过渡状态理论
理论要点:①反应物分子在相互接触的过程中,先形成一个不稳定的高势能的活化络合物。
① 反应物与活化络合物始终处于热力学平衡,活化络合物的形成是快步骤,其分解为产物为慢步骤。
② 活化络合物以单位时间 次的频率分解为产物,此速率为该基元反应的速率。
次的频率分解为产物,此速率为该基元反应的速率。


n分子反应 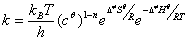 (以
(以 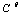 为标准态)
为标准态)
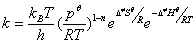 (气相反应,以
(气相反应,以 为标准态)
为标准态)
二、思考题
1、某反应为一级反应,能否确定该反应为单分子反应?
2、双分子反应的反应级数能确定吗?
3、零级反应、一级反应速率常数的物理意义是什么?
4、一级反应的反应物转化99%所需的时间与半衰期的比值是多少?反应完全的时间又是多少?
5、某化学计量方程式可能不是基元反应,如何判定?
6、反应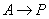
 ,求下列情况下的反应级数。
,求下列情况下的反应级数。
 。
。
7、微分法确定反应级数的依据是什么?
8、温度对反应速率影响较大,主要改变了什么?
9、反应(1)是一级反应,反应(2)是二级反应,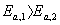 ,在25℃,
,在25℃,
 , u1 = u2 。
, u1 = u2 。
(1) 在25℃, ,哪个反应的
,哪个反应的 大?
大?
(2) 在25℃, ,哪个反应的u大?
,哪个反应的u大?
(3) 在30℃, ,哪个反应的u大?
,哪个反应的u大?
10连串反应 ,为使得B的产率提高,可采取的措施有哪些?
,为使得B的产率提高,可采取的措施有哪些?
11、采用什么措施可以改变平行反应的产物比?
12、325K时,反应
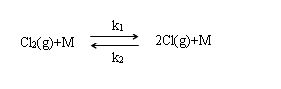
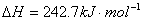 ,Ea,1=? , Ea,2=?
,Ea,1=? , Ea,2=?
 13、反应
13、反应
使用平衡近似法或稳态近似法的条件是什么?
14、H2 + O2系统存在三个爆炸极限的原因是什么?
15、298K时两反应的反应级数,活化能相同,k1=10k2,两反应活化熵差为多少?
16、什么叫笼效应?
17、举例说明溶剂对反应有明显的影响。
18、如何判断溶液中反应是扩散控制还是活化控制?
19、某反应的反应物的能量高于产物的能量,该反应是否还需要活化能。
20、温度对光化学反应影响如何?
21、光化平衡与热力学平衡有何异同?
22、催化剂的特征是什么?
23、如何判断多相反应的控制步骤?
24、酶催化具有高选择性的原因是什么?
25、酸、碱催化的主要特征是什么?
26、在光的作用下, ,生成1mol O3时,吸收3.011×1023个光子,问量子效率是多少?
,生成1mol O3时,吸收3.011×1023个光子,问量子效率是多少?
三、例题解析
1、某药物分解反应为一级反应,分解30%即为无效。今在50℃,60℃,70℃测得它每小时分解0.07%,0.16%,0.35%。
(1) 求出该药物分解反应的速率常数与温度的关系式。
(2) 若该药物在25℃下保存,有效期为多长?
(3) 若在0℃条件下保存,有效期为多长?
解题思路:本题应首先求出速率常数与温度的关系式k=f(t), (2)、(3)问利用k=f(t) 的表达式求出k,再应用积分式求时间t。建立关系式k=f(t)的关键是求出 中的常数A和Ea或
中的常数A和Ea或 中的m,b,这需要利用已知条件先求出三组k与T的值,解联立方程或作图,求出常数来。
中的m,b,这需要利用已知条件先求出三组k与T的值,解联立方程或作图,求出常数来。
解:(1)一级反应 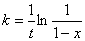
 k(50℃)
k(50℃)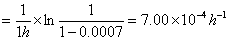
k(60℃)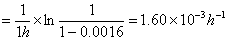
k(70℃)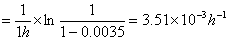
列表

以lnk/[k]对1/T作图,可画出一条直线,可求出 的m,b值,或利用 ①②组,②③组数据,代入
的m,b值,或利用 ①②组,②③组数据,代入 ,解联立方程,求算m,b值。最后可得到k与T的关系式。
,解联立方程,求算m,b值。最后可得到k与T的关系式。

(2)在室温下,药物的有效期可如下求得
ln k(25℃)/h-1=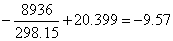
k(25℃)=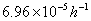
t(25℃)=
(4) 在较低温度下保存药品,其有效期会有所延长。
在0℃时,ln k(0℃)/h-1=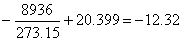
k(0℃)=
t(0℃)=
2、在一定温度下,有一个二级气相反应

(1) 假定反应起始时只有A(g),初始压力为p0 ,导出系统的总压与时间的关系式。
(2) 半衰期与初始压力的关系?
(3) 反应完全时,总压是初始压力的几分之几?
(4) 系统压力降为初始压力和最终压力的中间值时,需要多长时间?
(5) 利用实验数据,如何求得反应速率常数?
解题思路:本题主要目的是二级反应积分式的应用,首先应依据化学反应计量式,对反应物和产物进行分析,得出系统总压和反应物压力之间的关系,这是许多习题都具有的讨论内容,然后再进行其他推导。

 解:(1) 反应 2A(g) B(g)
解:(1) 反应 2A(g) B(g)
t=0 p0
t=t pA 
系统总压 

∵ 二级反应 

(2)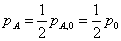

(3)反应完全时 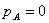

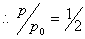
(4)当

达到此状态所需的时间与反应的半衰期相同。
⑸ 在不同反应时间,测得系统的总压,进行一系列的计算,求出不同反应时间的值 ,以
,以 对
对 作图,根据直线的斜率可求得反应的速率常数。
作图,根据直线的斜率可求得反应的速率常数。
4、H2O2在催化剂作用下水解为H2O和O2,
H2O2(l)→ H2O(l) + O2(g)
O2(g)
反应为一级反应,在恒温恒压下,用量气管测定不同反应时刻的O2的体积,试推导出反应速率常数k与O2体积的关系式。
解题思路:本题没有反应物的浓度,无法用 进行计算,所以我们应寻找O2体积与反应物浓度之间的线性关系,进而可以利用O2的体积进行计算。
进行计算,所以我们应寻找O2体积与反应物浓度之间的线性关系,进而可以利用O2的体积进行计算。
解 H2O2(l)→H2O(l) +  O2(g)
O2(g)
t=0 
t=t 
t=∞ 
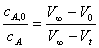
 一级反应
一级反应 
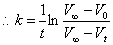
假若我们测得一系列不同反应时刻O2的体积,可对数据进行处理,
依据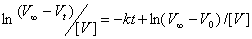
可作ln(V∞-Vt)/[V]- t图,得一直线,由直线斜率可求得反应速率常数。
5.反应 A + B → C 速率方程为


 ,实验数据如下:
,实验数据如下:

求反应级数和反应速率常数k。
解题思路:根据实验数据,实验C、D中的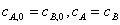 ,
,  ,应当能求算出 a+b 值;实验A、B中的
,应当能求算出 a+b 值;实验A、B中的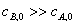 ,
, ,进而求算出α来,最后可得出反应级数和反应速率常数k。
,进而求算出α来,最后可得出反应级数和反应速率常数k。
解:反应A+B→C 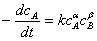
对实验C、D, ,A和B的化学计量数也为1,
,A和B的化学计量数也为1,
 ,
, 
分析实验数据
实验C:

t=t1/2=1000h
实验D:
 t′=t′1/2=500h
t′=t′1/2=500h
由此可见,半衰期与初始浓度成反比,这是二级反应的特征。
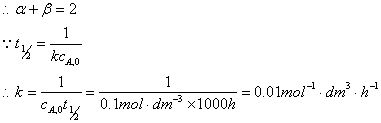
对实验A,B,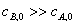 反应过程中
反应过程中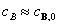
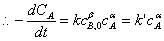
由于只有两个实验数据点,可采用尝试法进行计算,确定a。
假定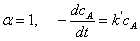

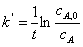
实验A 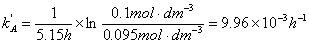
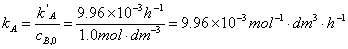
实验B 

由此可见 a =1,

反应为二级反应。
7、在40℃时,N2O5在CCl4溶剂中进行分解反应,反应级数为一级,初始反应速率u0=1.00×10-5mol·dm-3·s-1,一小时后反应速率u=3.26×10-6mol·dm-3·s-1试计算:
(1)反应在40℃时的速率常数。
(2)40℃时反应的半衰期。
(3)初始浓度c0为多少?
解题思路:本题的关键是求得反应速率常数,知道了反应速率常数,利用k=ln2/t1/2 , u0=kc0公式,可求得半衰期和初始浓度。但仅凭速率方程的微分形式求不出k来,若利用u0=kc0 , u=kc两式相比,再利用一级反应速率方程的积分形式进行计算,即可求出k来。
解:(1)一级反应
u=kc u0=kc0


(2) t1/2=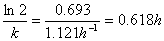
(3) 
8、在1100K时,氨在钨丝上发生分解反应,其数据如下:
 /Pa 35464 17225 7599
/Pa 35464 17225 7599
t1/2/min 7.6 3.7 1.7
(1) 试判断该分解反应为零级反应。
(2)计算反应速率常数。
(3)解释该反应速率与压力无关的原因。
解题思路:由提供的实验数据看,判断反应是否为零级反应可以用半衰期法。利用零级反应的速率方程的积分形式求速率常数,由于已知多组实验数据,可以用作图法;也可以用计算平均法。典型的零级反应是表面反应和光化学反应初级过程,供分析时参考。
解:(1) 分析三组数据


半衰期与初始压力成正比,符合零级反应的特征。所以该反应为零级反应。
(2)零级反应 pA = -kt + pA,0 t1/2=
 k=
k=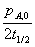 可算出不同初始压力下的速率常数:
可算出不同初始压力下的速率常数:
p0/Pa 35464 17225 7599
k/Pa·min-1 2333 2328 2235
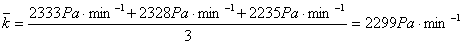
(3)氨在钨表面上发生强吸附,表面完全为氨所覆盖,

而表面反应为控制步骤
u = kS = kS
= kS
所以该反应为零级反应。
9、某反应速率方程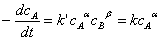 ,其中k=k'
,其中k=k'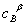 ,在298K,cA,0=0.1mol·dm-3时,t1/2=3.75min ; cA,0= 0.2mol·dm-3时 , t1/2=15.0min,已知该反应活化能为105.79kJ·mol-1 , 求308K, cA,0=0.2 mol·dm-3,反应进行到3.75min时,该反应的瞬时速率。
,在298K,cA,0=0.1mol·dm-3时,t1/2=3.75min ; cA,0= 0.2mol·dm-3时 , t1/2=15.0min,已知该反应活化能为105.79kJ·mol-1 , 求308K, cA,0=0.2 mol·dm-3,反应进行到3.75min时,该反应的瞬时速率。
解题思路:求算反应速率可以应用速率方程的微分形式,前提是要确定级数 ,速率常数k,由已知条件利用半衰期法求得
,速率常数k,由已知条件利用半衰期法求得 ,再利用阿伦尼尔乌斯方程的积分形式求得308K时的反应速率常数。
,再利用阿伦尼尔乌斯方程的积分形式求得308K时的反应速率常数。
解:
由两组数据得
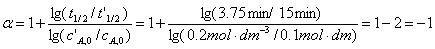
为了求得反应速率常数,先推导出积分形式

t1/2=
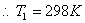 时
时

利用公式 ln
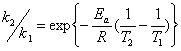
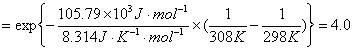
k2=4.0×k1=4.00×10-3
在308K时,反应进行了3.75min时
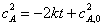
 ×3.75min+(0.2
×3.75min+(0.2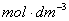 )2
)2
=0.01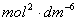

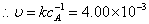
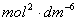 ?min-1/0.1
?min-1/0.1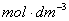
=4.00×10-2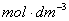 ·min-1
·min-1
13、某反应为一级反应,在167℃,230秒时有90%的反应物发生了反应,在127℃,230秒时有20%的反应物发生了反应,试计算:
(1)反应的活化能。
(2)在147℃时,反应的半衰期是多少?
解题思路:根据已知条件利用阿伦尼乌斯方程的积分形式可求得活化能,而两个温度下的速率常数可利用一级反应速率方程的积分形式来求得,求算出活化能后,就能容易地求算出147℃的速率常数,进而利用 求出半衰期来。
求出半衰期来。
解:(1)一级反应 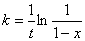
 k(167℃)
k(167℃)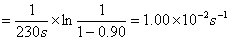
k(127℃)
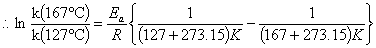


(2)在147℃时,其反应速率常数k(147℃)可用下式求出。

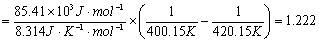

=3.29×10-3 s-1

 14、一级平行反应
14、一级平行反应
的动力学数据如下
反应 Ea / kJ·mol-1 A/s-1
① 108.8 1013
② 83.68 1013
(1) 提高温度,哪一个反应的反应速率增加较快?
(2) 能否通过提高反应温度,使k1大于k2?
(3) 如将温度由300K增高至1000K,产物中B和C的分布将如何变化?
解题思路:讨论温度对化学反应速率的影响是阿伦尼乌斯方程的基本功能,定性讨论时可用其微分形式,比较两平行反应的速率常数最好用其积分形式的指数表示式来讨论。平行反应的特征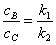 的前提条件是两平行反应的级数相同,而且反应开始时无产物。
的前提条件是两平行反应的级数相同,而且反应开始时无产物。
解:(1)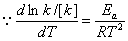



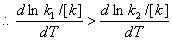
 提高温度,反应①的速率常数增加较快。
提高温度,反应①的速率常数增加较快。
(2)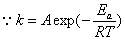
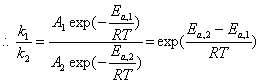
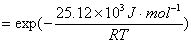 < 1
< 1
提高温度不可能使k1大于k2
(3)

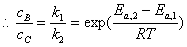


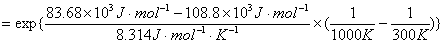
=1.15×103
25、某环氧烷受热分解,反应机理如下:
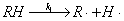


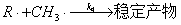
证明反应速率方程为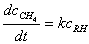 。
。
解题思路:由反应机理推导速率方程,首先用产物的生成速率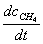 表示反应速率,由于中间产物是自由基,可用稳态法求出中间产物浓度,最后求得速率方程。
表示反应速率,由于中间产物是自由基,可用稳态法求出中间产物浓度,最后求得速率方程。
解:∵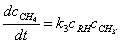 (1)
(1)
为求算中间产物CH3·的浓度 ,用稳态法
,用稳态法
 (2)
(2)
又引出中间产物R?的浓度cR?,再用稳态法
 (3)
(3)
(2)+(3)得 

∴ (4)
(4)
将(4)代入(2)中
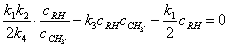
∴

最后可得 的一元二次方程,其解
的一元二次方程,其解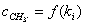
∴
28、反应C2H6+H2→2CH4的反应机理如下:
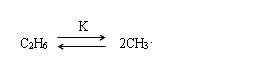
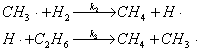
 试推导
试推导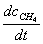 的表达式。
的表达式。
解题思路:由反应机理推导速率方程时,求中间产物的浓度并不是只用平衡近似或稳态近似法,可能二者兼用。本题就是利用平衡近似法,同时对H?进行稳态近似处理,来获取中间产物与反应物浓度间的关系,进而推导出速率方程。
解:∵ (1)
(1)

∴ 代到(1)式
代到(1)式
∴
依据化学平衡 
∴
∴
