第一节 化学实验基本方法 课程讲义
一、化学实验安全 1.树立安全意识,初步形成良好实验习惯 2.能识别一些化学品的安全标识
实验安全常识:1.遵守实验室规则是实验安全的前提; 2.了解安全措施是实验安全的保证; 3.掌握正确的操作方法是实验安全的根本; 4.重视并逐步熟悉污染物和废弃物的处理方法。
掌握方法和操作技能的要求:1、保证实验安全、人身安全、财产安全 2、保证实验顺利进行,完成实验任务(要按时、按质)
(一)遵守实验室规则 1.进入实验室前应预习实验,明确实验目的原理和方法,严禁不预习进入实验室 2.进实验室后,应先检查实验用品是否齐全 3.实验过程中,应严格遵守各种实验操作规程,严禁随便进行无关实验,不得大声喧哗 4.实验完毕后,应将仪器洗净,整理清洁试验台 5.有意外事故,应及时向老师报告
使用药品做到“三不”:不用手接触药品;不把鼻孔凑到容器口去闻药品气味;不尝药品味道 用剩药品做到“三不”:不放回原瓶;不随意丢弃;不拿出实验室,(放到废物缸里)
(二)了解安全措施
1.事故预防:放爆炸:点燃可燃性气体或用可燃性气体进行加热反应前,要检验气体的纯度。 防暴沸:配制硫酸的水溶液时,要将密度大的浓硫酸倒入水中;
加热液体混合物时要加沸石或碎瓷片。防失火:实验室中的可燃物质要远离火源,检查灭火设备是否齐全 防中毒:制取有毒气体(Cl2、CO、SO2、H2S、NO等)时,要在通
风橱内进行,并采取相应的措施处理(灼烧、吸收、收集等)。 防倒吸:用加热法制取气体并用排水法收集时,注意熄灯顺序;吸收溶解度较大的气体(HCl、NH3)时,加装安全瓶或漏斗
2.危险化学品标志识别:爆炸品(橙红-黑)正在爆炸炸弹 黑火药 易燃气体(红-黑/白)火焰 氢气,甲烷,一氧化碳 有毒气体(白-黑)骷髅头 一氧化碳,氯气 易燃液体(红-黑/白)火焰 有机溶剂 易燃固体(红白间条-黑)火焰 碳、磷 腐蚀品(白黑-黑白)试管滴落 强酸强碱 氧化剂(黄-黑)圆圈火焰 高锰酸钾、过氧化物·有毒品(白-黑)骷髅头 氰化物、砷化物、重金属盐·自燃物品(白红-黑)火焰 白磷
…… …… 余下全文

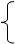 质子(Z个)
质子(Z个)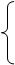 原子核 注意:
原子核 注意: 1.原子数
A X 原子序数=核电荷数=质子数=原子的核外电子
1.原子数
A X 原子序数=核电荷数=质子数=原子的核外电子
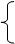 _______(Z个)
_______(Z个)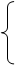 原子核 注意:
原子核 注意: 1.原子(
A X ) 原子序数=_______=质子数=_______
1.原子(
A X ) 原子序数=_______=质子数=_______

 短周期(第1、2、3周期)
短周期(第1、2、3周期)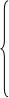 周期:7个(共七个横行)
周期:7个(共七个横行) 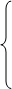 主族7个:ⅠA-ⅦA
主族7个:ⅠA-ⅦA
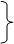 族:
16
个(共
18
个纵行)
副族7个:IB-
ⅦB
族:
16
个(共
18
个纵行)
副族7个:IB-
ⅦB
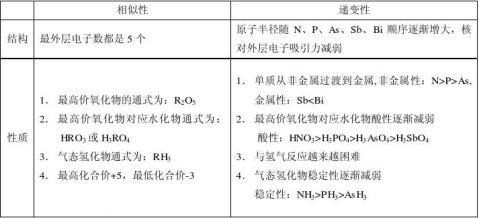
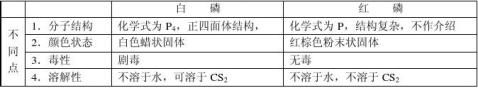
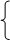 1、原子结构 相似性:最外层电子数相同,都为1个
1、原子结构 相似性:最外层电子数相同,都为1个 (1)相似性:
(1)相似性: 4Li + O2 Li2O 2Na + O2 Na2O2
4Li + O2 Li2O 2Na + O2 Na2O2 