第三章金属及其化合物
一、金属的物理通性:常温下,金属一般为银白色晶体(汞常温下为液体),具有良好的导电性、导热性、延展性。
二、金属的化学性质:
多数金属的化学性质比较活泼,具有较强的还原性,在自然界多数以化合态形式存在。

三、金属化合物的性质:
1、氧化物

2、氢氧化物

3、盐
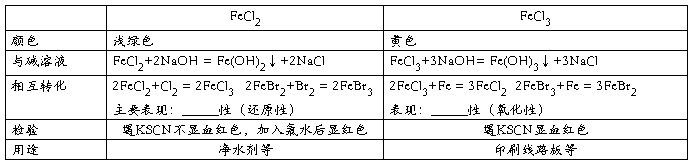
四、金属及其化合物之间的相互转化
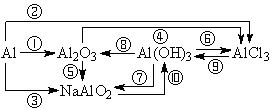 1、铝及其重要化合物之间的转化关系,写出相应的化学反应方程式。⑩NaAlO2+HCl+H2O=Al(OH)3↓+NaCl
1、铝及其重要化合物之间的转化关系,写出相应的化学反应方程式。⑩NaAlO2+HCl+H2O=Al(OH)3↓+NaCl
2、铁及其重要化合物之间的转化关系,写出相应的化学反应方程式。
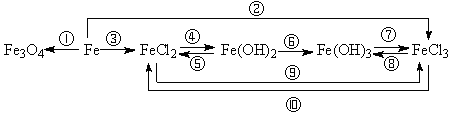
附:1、焰色反应:用于在火焰上呈现特殊颜色的金属或它们的化合物的检验。

注:观察钾焰色反应时,应透过蓝色钴玻璃,以便滤去杂质钠的黄光。
3、氧化铝、氢氧化铝
(1)Al2O3俗名矾土,是一种难熔又不溶于水的白色粉末。它的熔点、沸点都高于2000度。(2)氢氧化铝是典型的两性氢氧化物,它既能溶于强酸生成铝盐溶液,又能溶于强碱生成偏铝酸盐溶液。氢氧化铝可用来制备铝盐,作吸附剂等的原料。氢氧化铝凝胶有中和胃酸和保护溃疡面的作用,可用于治疗胃和十二指肠溃疡、胃酸过多等。
…… …… 余下全文