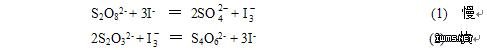化学反应速率与活化能的测定
(实验报告及数据处理)
实验目的
1.了解浓度、温度及催化剂对化学反应速率的影响。
2.测定(NH4)2S2O8与KI反应的速率、反应级数、速率系数和反应的活化能。
实验原理
(NH4)2S2O8和KI在水溶液中发生如下反应:
S2O82-(aq)+ 3I-(aq) = 2SO42- (aq)+ I3-(aq) (1)
这个反应的平均反应速率为
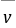 = -
= - 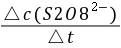 =
= 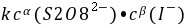 式中:
式中: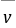 ── 反应的平均反应速率;
── 反应的平均反应速率;
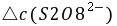 ──
── 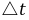 时间内
时间内 的浓度变化;
的浓度变化;
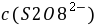 ,
,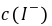 ──
──  ,
,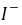 的起始浓度;
的起始浓度;
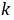 ── 该反应的速率系数;
── 该反应的速率系数;
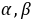 ──反应物
──反应物 ,
,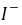 的反应级数,
的反应级数,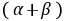 为该反应的总级数。
为该反应的总级数。
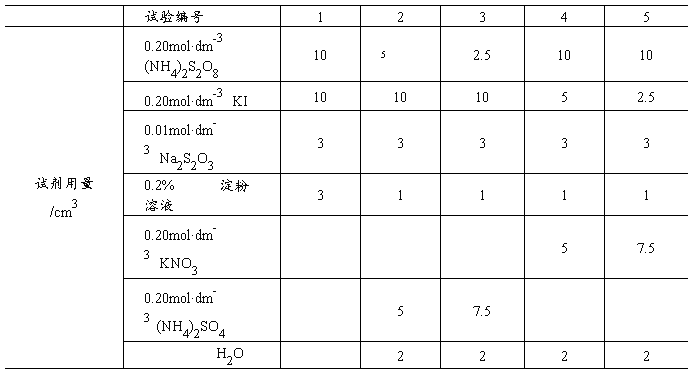
为了测出在一定时间(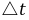 )内S2O82-的浓度变化,在混合(NH4)2S2O8和KI溶液的同时,加入一定体积的已知浓度的Na2S2O3溶液和淀粉,这样在反应(1)进行的同时,还有以下反应发生:
)内S2O82-的浓度变化,在混合(NH4)2S2O8和KI溶液的同时,加入一定体积的已知浓度的Na2S2O3溶液和淀粉,这样在反应(1)进行的同时,还有以下反应发生:
2S2O32- (aq) + I3-(aq) ══ S4O62-(aq) + 3I-(aq) (2)
由于反应(2)的速率比反应(1)的大得多,由反应(1)生成的I3-会立即与S2O32-反应生成无色的S4O62-和I-。这就是说,在反应开始的一段时间内,溶液呈无色,但当Na2S2O3一旦耗尽,由反应(1)生成的微量I3-就会立即与淀粉作用,使溶液呈蓝色。
由反应(1)和(2)的关系可以看出,每消耗1mol S2O82- 就要消耗2 mol 的S2O32-,即
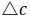 (S2O82-)=
(S2O82-)= 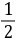
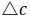 (S2O32-)
(S2O32-)
由于在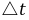 时间内,S2O32-已全部耗尽,所以
时间内,S2O32-已全部耗尽,所以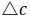 (S2O32-)实际上就是反应开始时Na2S2O3的浓度,即
(S2O32-)实际上就是反应开始时Na2S2O3的浓度,即
-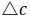 (S2O32-)=
(S2O32-)= 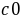 (S2O32-)
(S2O32-)
这里的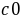 (S2O32-)为Na2S2O3的起始浓度。在本实验中,由于每份混合液中Na2S2O3的起始浓度都相同,因而
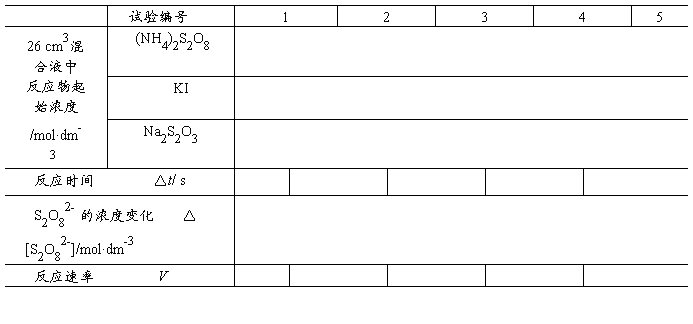
(S2O32-)为Na2S2O3的起始浓度。在本实验中,由于每份混合液中Na2S2O3的起始浓度都相同,因而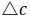 (S2O32-)也是相同的,这样,只要记下从反应开始到出现蓝色所需要的时间(
(S2O32-)也是相同的,这样,只要记下从反应开始到出现蓝色所需要的时间(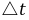 ),就可以算出一定温度下该反应的平均反应速率:
),就可以算出一定温度下该反应的平均反应速率:
…… …… 余下全文

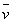 = -
= - 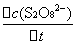 =
= 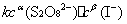
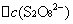 ──
── 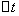 时间内
时间内 的浓度变化;
的浓度变化;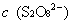 ,
,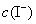 ──
── 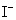 的起始浓度;
的起始浓度;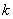 ── 该反应的速率系数;
── 该反应的速率系数;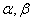 ──反应物
──反应物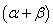 为该反应的总级数。
为该反应的总级数。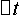 )内S2O82-的浓度变化,在混合(NH4)2S2O8和KI溶液的同时,加入一定体积的已知浓度的Na2S2O3溶液和淀粉,这样在反应(1)进行的同时,还有以下反应发生:
)内S2O82-的浓度变化,在混合(NH4)2S2O8和KI溶液的同时,加入一定体积的已知浓度的Na2S2O3溶液和淀粉,这样在反应(1)进行的同时,还有以下反应发生:

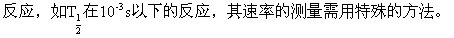
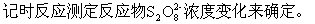
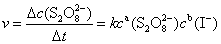

 、
、 是起始浓度,则r表示初速率(v0)。在实验中只能测定出在一段时间内反应的平均速率。
是起始浓度,则r表示初速率(v0)。在实验中只能测定出在一段时间内反应的平均速率。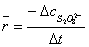
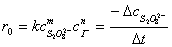
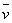 = -
= - 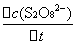 =
= 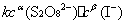
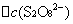 ──
── 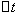 时间内
时间内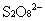 的浓度变化;
的浓度变化;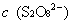 ,
,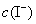 ──
── 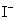 的起始浓度;
的起始浓度;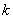 ── 该反应的速率系数;
── 该反应的速率系数;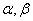 ──反应物
──反应物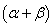 为该反应的总级数。
为该反应的总级数。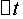 )内S2O82-的浓度变化,在混合(NH4)2S2O8和KI溶液的同时,加入一定体积的已知浓度的Na2S2O3溶液和淀粉,这样在反应(1)进行的同时,还有以下反应发生:
)内S2O82-的浓度变化,在混合(NH4)2S2O8和KI溶液的同时,加入一定体积的已知浓度的Na2S2O3溶液和淀粉,这样在反应(1)进行的同时,还有以下反应发生: