篇二 :实验一 蛋白质浓度的测定实验报告
蛋白质浓度的测定
一.实验原理
考马斯亮蓝能与蛋白质的疏水微区相结合,这种结合具有高敏感性。考马斯亮蓝G250的磷酸溶液呈棕红色,最大吸收峰在465nm。当他与蛋白质结合形成复合物时呈蓝色,其最大吸收峰改变为595nm。考马斯亮蓝G250—蛋白质复合物的高消光效应导致了蛋白质定量测定的高敏感性。
在一定范围内,考马斯亮蓝G250—蛋白质复合物呈色后,在595nm下,吸光度与蛋白质含量呈线性关系。故可用于蛋白质浓度的测定。
二.实验设备与试剂
设备:普通离心机,721型分光光度计
试剂:标准蛋白液(100ug/ml)
三.实验材料
新鲜绿豆芽
四.实验内容
1. 标准曲线的制备
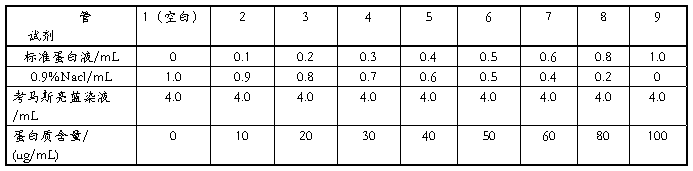
取9支干净的试管,按表进行编号并加入试剂。
2. 样品蛋白的测定
(1) 样品蛋白液制备
准确称取2g新鲜绿豆芽胚轴的部分,研磨成匀浆,离心分离(4000r/min,10min)。取上清液用0.9%nacl定容到10ml。
(2) 含量测定
另取两只干净的试管,加入样品液0.1ml,0.9mlnacl和考马斯亮蓝染液4.0ml,混匀。室温静置3min,与波长595nm处比色,读取吸光度。
…… …… 余下全文
篇三 :蛋白质测定实验报告
蛋白质测定方法
——化学报告
蛋白质的检测

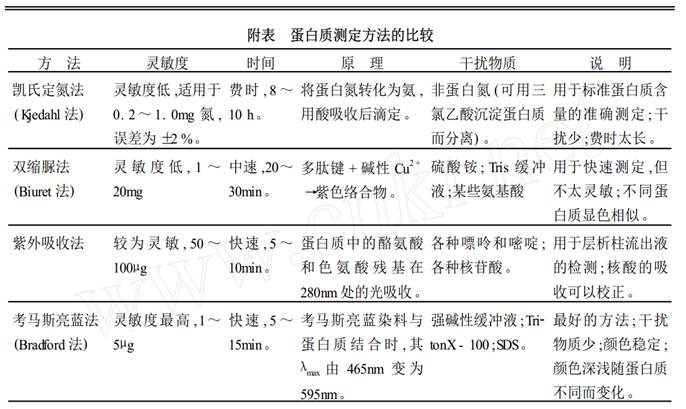
由上表可大致了解五种检测蛋白质的方法,下面以实验的形式进行详细阐述:
1 材料与方法
1.1 仪器材料
(1)仪器:凯氏定氮仪、紫外分光光度计、可见光分光光度计、工作离心机、布氏漏斗、抽滤泵。
(2)试剂及原材料:牛奶、酸奶、豆浆、0.12mol/LpH=4. 7醋酸- 醋酸钠缓冲液、乙醇-乙醚等体积混合液、浓H2SO4 、40%氢氧化钠、30%过氧化氢、2%硼酸溶液、0. 050molPL标准盐酸溶液、硫酸钾- 硫酸铜接触剂、混合指示剂、标准蛋白溶液、双缩脲试剂、考马斯亮蓝G- 250试剂。
1.2 实验方法
(1)凯氏定氮法测定蛋白质含量
将待测样品与浓硫酸共热,含氮有机物即分解产生氨(消化) ,氨又与硫酸作用,变成硫酸铵。为了加速消化,可以加入CuSO4 作催化剂和加入K2SO4 以提高溶液的沸点,而加入30%过氧化氢有利于消化溶液的澄清。消化好的样品在凯氏定氮仪内经强碱碱化使之分解放出氨,借蒸汽将氨蒸至定量硼酸溶液中,然后用标准盐酸溶液进行滴定,记录,计算出样品含氮量。每个样品做三次重复测定,取平均值。
(2)紫外吸收法测定蛋白质含量
蛋白质分子中,酪氨酸、苯丙氨酸和色氨酸残基的苯环含有共轭双键,使蛋白质具有吸收紫外光的性质,吸收峰在280nm处,其吸光度(即光密度值)与蛋白质含量成正比。此外,蛋白质溶液在238nm的光吸收值与肽键含量成正比。利用一定波长下,蛋白质溶液的光吸收值与蛋白质浓度的正比关系,可以进行蛋白质含量的测定。
紫外吸收法简便、灵敏、快速,不消耗样品,测定后仍能回收使用。低浓度的盐,例如,
…… …… 余下全文
篇四 :蛋白质测定实验报告


生物化学实验报告
姓 名:
学 号:
专业年级:
组 别:
生物化学与分子生物学实验教学中心

格式要求:正文请统一用:小四号,宋体,1.5倍行距;数字、英文用Times New Roman;标题用:四号,黑体,加粗。需强调的地方请用蓝颜色标出。不得出现多行、多页空白现象。
一、实验目的
1、掌握Folin-酚试剂法测定蛋白质含量的原理及其实验操作技术。
2、掌握制作标准曲线的要领和通过标准曲线求样品溶液中待测定物质含量的方法。
二、实验原理
三、材料与方法:以流程图示意
四、结果与讨论:①结果:实验数据、现象、图谱;②讨论:以结果为基础的逻辑推论,并得出结论。
…… …… 余下全文
篇五 :紫外分光光度法测定蛋白质含量实验报告
紫外分光光度法测定蛋白质含量
一、实验目的
1. 学习紫外光度法测定蛋白质含量的原理;
2. 掌握紫外分光光度法测蛋白质含量的实验技术。
二、实验原理
1.测蛋白质含量的方法主要有:①测参数法:折射率、相对密度、紫外吸收等;②基于化学反应:定氮法、双缩脲法、Folin―酚试剂法等。本实验采用紫外分光光度法。
2.蛋白质中的酪氨酸和色氨酸残基的苯环中含有共轭双键,因此,蛋白质具有吸收紫外光的性质,其最大吸收峰位于280nm附近(不同蛋白质略有不同)。在最大吸收波长处,吸光度与蛋白质溶液的浓度服从朗伯―比尔定律。
利用紫外吸收法测蛋白质含量的准确度较差,原因有二:①对于测定那些与标准蛋白质中酪氨酸和色氨酸含量差异较大的蛋白质,有一定误差,故该法适于测定与标准蛋白质氨基酸组成相似的蛋白质;②样品中含有的嘌呤、嘧啶等吸收紫外光的物质,会出现较大干扰。
三、仪器与试剂
TU―1901紫外可见分光光度计、标准蛋白质溶液3.00mg·mL-1、0.9%NaCl溶液、试样蛋白质溶液。
10mL比色管、1cm石英比色皿、吸量管。
四、实验步骤
1.绘制吸收曲线
用吸量管吸取2mL3.00mg·mL-1标准蛋白质溶液于10mL比色管中,用0.9%NaCl溶液稀释至刻度,摇匀。用1cm石英比色皿,以0.9%NaCl溶液作参比溶液,在190~400nm间每隔5nm测一次吸光度Abs,记录数据并作图。
2.绘制标准曲线
用吸量管分别吸取1.0、1.5、2.0、2.5、3.0mL3.00mg·mL-1标准蛋白质溶液于10mL比色管中,用0.9%NaCl溶液稀释至刻度,摇匀。用1cm石英比色皿,以0.9%NaCl溶液作参比溶液,在波长280nm处分别测其吸光度,记录数据并作图。
…… …… 余下全文
篇六 :实验报告 蛋白质分子的测定
实验一 蛋白质分子的测定─凝胶层析法
一、 实验原理
凝胶层析法(即凝胶过滤法,gel filtration)是利用凝胶把分子大小不同的物质分离开的一种方法。将凝胶颗粒在适宜溶剂中浸泡,使充分吸液膨胀,然后装入层析柱中,加入欲分离的混合物,再以同一溶剂洗脱,在洗脱过程中大分子不能进入凝胶内部而沿凝胶颗粒间的空隙最先流出柱外,小分子可以进入凝胶内部,流苏缓慢,一直最后流出柱外,从而使样品中分子大小不同的物质得以分离。
凝胶是由胶体溶液凝结而成的固体物质,不论是天然凝胶还是人工合成凝胶,其内部都具有很微细的多空网状结构。凝胶层析法常用的天然凝胶是琼脂糖凝胶(Sepharose),人工合成的凝胶是聚丙烯酰胺凝胶(Bio-gel-P)和葡聚糖凝胶(Sephadex G)。其中葡聚糖凝胶是具有不同孔隙度的立体网状结构的凝胶,不溶于水。
将凝胶装柱后,柱床体积称为“总体积”,以Vt表示。Vt由Vo,Vi与Vg三部分组成,即Vt=Vi+Vg+Vo。Vo为“孔隙体积”、“外水体积”,即存在于柱床内凝胶颗粒外面空隙之间的水相体积;Vi为内体积,即凝胶颗粒内部所含水相的体积;Vg为凝胶本身体积;Ve为洗脱体积,即自加入样品时算起到组分最大浓度(峰)出现时所流出的体积,Ve与Vo及Vi之间的关系为:Ve=Vo+KdVi,;Kd为样品组分在二相间的分配系数,Kd=(Ve-Vo)/Vi,有效分配系数为Kav,Kav=(Ve-Vo)/(Vt-Vo)。
在一般情况下,凝胶对组分没有吸附作用时,当流动相流过Vt体积后,所有的组分都应该被洗出来,这一点为凝胶层析的特点,与一般层析方法不同。
Ve与分子量的关系:对同一类型的化合物,洗脱特性与组分的分子量有关,流过凝胶柱时,按分子量大小顺序流出,分子量大的走在前面。Ve与分子量的关系为:Ve=K1-K2logM,K1与K2为常数,M为分子量,通常用Kav代替Ve,建立标准蛋白质分子式量LgM与Kav的标准曲线,称为“选择曲线”。在允许的工作范围内,曲线越陡,则分级越好,而工作坊为越窄。凝佼层析主要决定于溶质分子的大小,每一类型的化合物,如球蛋白类,右旋糖酐类等都有它自己的特殊的选择曲线,可用以测定未知物的Mr,测定时以使用曲线的直线部分为宜。
…… …… 余下全文
篇七 :分光法测蛋白质实验报告
紫外分光光度法测定蛋白质含量
一、实验目的
1.学习紫外分光光度法测定蛋白质含量的原理。
2.掌握紫外分光光度法测定蛋白质含量的实验技术。
3.掌握TU-1901紫外-可见分光光度计的使用方法并了解此仪器的主要构造。
二、实验原理
1.紫外-可见分光光度法,是以溶液中物质的分子或离子对紫外和可见光谱区辐射能的选择性吸收为基础而建立起来的一类分析方法。紫外光:10-400 nm
可见光:400-780 nm(可被人们的眼睛所感觉)
特点:带光谱、分子光谱
应用:定性分析-最大吸收波长;
定量分析-朗伯-比尔定律(标准曲线法和标准加入法)
a.定性分析原理:
吸收曲线:吸收峰的数目、位置、相对强度以及吸收峰的形状.
b.定量分析原理:
根据朗伯-比耳定律:A=εbc,当入射光波长λ及光程b一定时,在一定浓度范围内,有色物质的吸光度A与该物质的浓度c成正比。
定量分析常用的方法是标准曲线法即只要绘出以吸光度A为纵坐标,浓度c为横坐标的标准曲线,测出试液的吸光度,就可以由标准曲线查得对应的浓度值,即未知样的含量。
c.仪器组成部件:
各种类型的紫外-可见分光光度计,如下图所示,从总体上来说是由五个部分组成,即光源、单色器、吸收池、检测器和信号显示记录装置。
2.本实验采用紫外分光光度法测定蛋白质含量的实验原理:
(1)蛋白质可作定量分析的原因:蛋白质中酪氨酸和色氨酸残基的苯环含有共轭双键,所以蛋白质溶液在275--280nm具有一个吸收紫外吸收高峰。在一定浓度范围内,蛋白质溶液在最大吸收波长处的吸光度与其浓度成正比,服从朗伯-比耳定律,因此可作定量分析。该法测定蛋白质的浓度范围为0.1—1.0mg/mL。
(2)此种方法测量的准确度差一点的原因:由于不同蛋白质中酪氨酸和色氨酸的含量不同,所处的微环境也不同,所以不同蛋白质溶液在280nm的光吸收职也不同。据初步统计,浓度为1.0 mg/mL的1800种蛋白质及蛋白质亚基在280nm的吸光度在0.3—3.0之间,平均值为1.25+/-0.51。所以此种方法测量的准确度差一点。
…… …… 余下全文
篇八 :生化综合实验报告--测定蛋白质含量的三种方法及其比较

本科学生综合性实验报告
学号 姓名
学院 专业、班级
实验课程名称测定蛋白质含量的三种方法及其比较
教师及职称
开课学期 至学年 学期
填报时间 年 月 日
云南师范大学教务处编印
一.实验设计方案
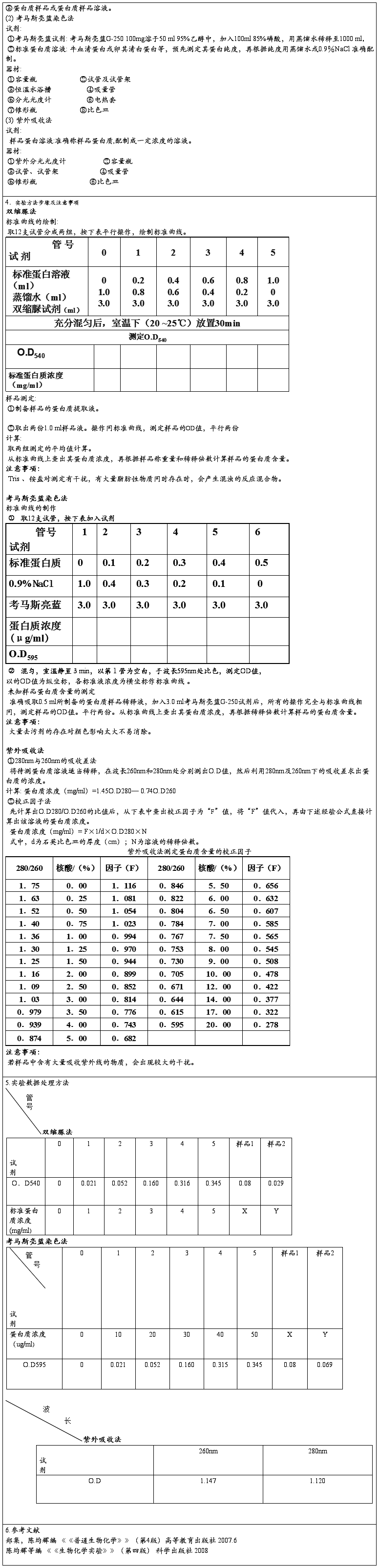
二.实验报告

…… …… 余下全文

推荐阅读
猜你喜欢
