分析化学主要计算公式总结
第二章 误差和分析数据处理
(1)误差
绝对误差δ=x-μ 相对误差=δ/μ*100%
(2)绝对平均偏差:
△=(│△1│+│△2│+……+│△n│)/n (△为平均绝对误差;△1、△2、……△n为各次测量的平均绝对误差)。
(3)标准偏差

相对标准偏差(RSD)或称变异系数(CV) RSD=S/X*100%
(4)平均值的置信区间:
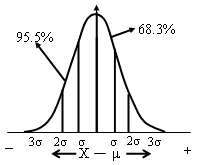
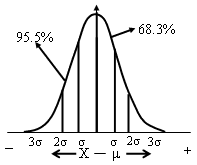
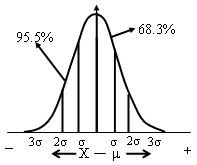
*真值落在μ±1σ区间的几率即置信度为68.3%
*置信度——可靠程度
*一定置信度下的置信区间——μ±1σ
对于有限次数测定真值μ与平均值x之间有如下关系:
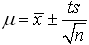
s:为标准偏差
n:为测定次数
t:为选定的某一置信度下的几率系数(统计因子)
(5)单个样本的t检验
目的:比较样本均数 所代表的未知总体均数μ和已知总体均数μ0。
计算公式:
t统计量: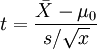
自由度:v=n - 1
适用条件:
(1) 已知一个总体均数;
(2) 可得到一个样本均数及该样本标准误;
(3) 样本来自正态或近似正态总体。
例1 难产儿出生体重n=35, 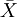 =3.42, S =0.40,
=3.42, S =0.40,
一般婴儿出生体重μ0=3.30(大规模调查获得),问相同否?
解:1.建立假设、确定检验水准α
H0:μ = μ0 (无效假设,null hypothesis)
H1: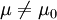 (备择假设,alternative hypothesis,)
(备择假设,alternative hypothesis,)
双侧检验,检验水准:α=0.05
2.计算检验统计量
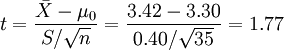 ,v=n-1=35-1=34
,v=n-1=35-1=34
3.查相应界值表,确定P值,下结论
查附表1,t0.05 / 2.34 = 2.032,t < t0.05 / 2.34,P >0.05,按α=0.05水准,不拒绝H0,两者的差别无统计学意义
…… …… 余下全文

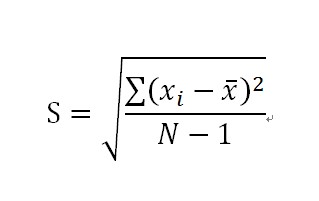
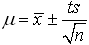
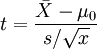
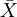 =3.42, S =0.40,
=3.42, S =0.40, 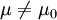 (备择假设,alternative hypothesis,)
(备择假设,alternative hypothesis,) 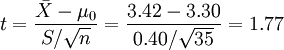 ,v=n-1=35-1=34
,v=n-1=35-1=34 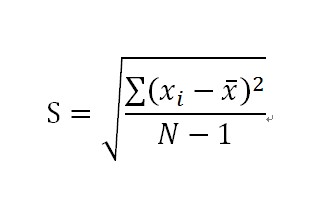
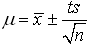
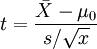
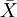 =3.42, S =0.40,
=3.42, S =0.40, 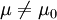 (备择假设,alternative hypothesis,)
(备择假设,alternative hypothesis,)  ,v=n-1=35-1=34
,v=n-1=35-1=34 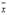 和样本标准差S来估计测量数据的分散程度,即需要对有限测量数据进行统计处理,再用统计量去推断总体。由于
和样本标准差S来估计测量数据的分散程度,即需要对有限测量数据进行统计处理,再用统计量去推断总体。由于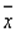
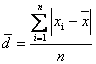
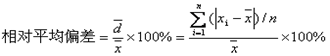
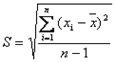 或
或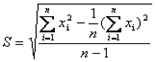


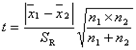
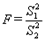 (S1>S2)
(S1>S2)
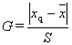
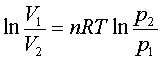
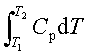
 ;
;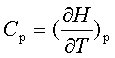

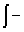 pedV
pedV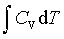 ; ΔH=
; ΔH=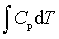
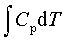 ; ΔU=
; ΔU=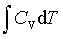
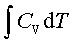 ;ΔH=
;ΔH=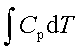
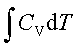 ;ΔH=
;ΔH=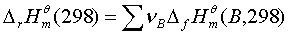
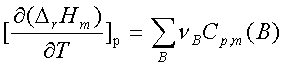 。
。