初三化学知识点总结
第一单元:走进化学世界
化学是一门研究物质的组成、结构、性质及其变化规律的科学。
一、药品的取用原则
1、使用药品要做到“三不”:不能用手直接接触药品,不能把鼻孔凑到容器口去闻药品的气味,不得尝任何药品的味道。
2、取用药品注意节约:取用药品应严格按实验室规定的用量,如果没有说明用量,一般取最少量,即液体取1-2mL,固体只要盖满试管底部。
3、用剩的药品要做到“三不”:即不能放回原瓶,不要随意丢弃,不能拿出实验室,要放到指定的容器里。
4、实验时若眼睛里溅进了药液,要立即用水冲洗。
二、固体药品的取用
1、块状或密度较大的固体颗粒一般用镊子夹取,
2、粉末状或小颗粒状的药品用钥匙(或纸槽)。
3、使用过的镊子或钥匙应立即用干净的纸擦干净。
三、液体药品(存放在细口瓶)的取用
1、少量液体药品的取用——用胶头滴管吸有药液的滴管应悬空垂直在仪器的正上方,将药液滴入接受药液的仪器中,不要让吸有药液的滴管接触仪器壁;不要将滴管平放在实验台或其他地方,以免沾污滴管;不能用未清洗的滴管再吸别的试剂(滴瓶上的滴管不能交叉使用,也不需冲洗)
2、从细口瓶里取用试液时,应把瓶塞拿下,倒放在桌上;倾倒液体时,应使标签向着手心,瓶口紧靠试管口或仪器口,防止残留在瓶口的药液流下来腐蚀标签。
3、量筒的使用
A、取用一定体积的液体药品可用量筒量取。
读数时量筒必须放平稳,视线与量筒内液体凹液面的最低处保持水平。俯视读数偏高,仰视读数偏底。
B、量取液体体积操作:先向量筒里倾倒液体至接近所需刻度后用滴管滴加到刻度线。
注意:量筒是一种量器,只能用来量取液体,不能长期存放药品,也不能作为反应的容器。不能用来量过冷或过热的液体,不宜加热。
C、读数时,若仰视,读数比实际体积低;若俯视,读数比实际体积高。
…… …… 余下全文

 化学史--原子分子论-近代化学基础—道尔顿和阿伏加德罗
化学史--原子分子论-近代化学基础—道尔顿和阿伏加德罗 组成:N2:78%、O2:21%
组成:N2:78%、O2:21% (空气中:水蒸气、二氧化碳等气体的测定)
(空气中:水蒸气、二氧化碳等气体的测定)

 4P+5O
2 ==== 2P
2O
5
4P+5O
2 ==== 2P
2O
5

 性质:C+O
2===== CO
2
性质:C+O
2===== CO
2
 S+O
2==== SO
2
S+O
2==== SO
2
 第二单元: 3Fe+2O
2===== Fe
3O
4
第二单元: 3Fe+2O
2===== Fe
3O
4
 4P+5O
2===== 2P
2O
5
4P+5O
2===== 2P
2O
5

 2Mg+3O
2===== 2MgO
2Mg+3O
2===== 2MgO



 制法:2H
2O
2=====2H
2O+O
2↑
制法:2H
2O
2=====2H
2O+O
2↑


 2、相对原子质量:
2、相对原子质量: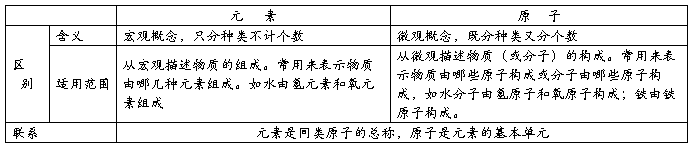
 (二)物质的分类 金属单质
(二)物质的分类 金属单质
 物 混合物 单质 非金属单质 酸性氧化物
物 混合物 单质 非金属单质 酸性氧化物