直流循环伏安法
一、实验目的
1.掌握用循环伏安法判断电极过程的可逆性。
2.学会使用电化学工作站测定循环伏安曲线。
3.学会测量峰电流和峰电位。
二、实验原理
循环伏安法是在工作电极上施加一个线性变化的循环电压来记录电流随电位的变化曲线,施加的电压为等边三角波或等边阶梯波,电位可向阳极方向扫描,也可向阴极方向扫描。 它能在很宽的电位范围内迅速观察研究对象的氧化还原行为。
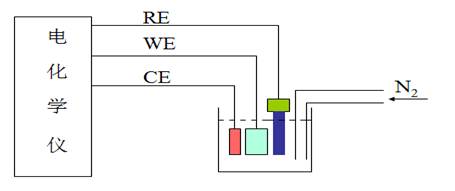
图为电化学实验装置图
RE﹑WE﹑CE分别为参比电极、工作电极和对电极
采用三电极体系,分别为参比电极、工作电极和对电极。仪器输出的电信号加到工作电极和对电极上,被研究的物质在工作电极上发生电化学反应。辅助电极与工作电极连成通路, 反应的电流通过工作电极和对电极。参比电极用于稳定工作电极的电位并确定电流-电势曲线中的峰电位、半波电位等。
若溶液中存在氧化态O,电极上将发生还原反应: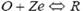
反向回扫时,电极上生成的还原态R将发生氧化反应: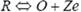
峰电流表示为:
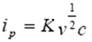
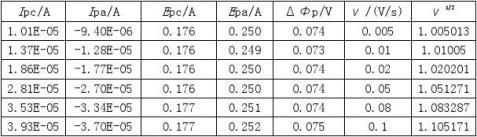
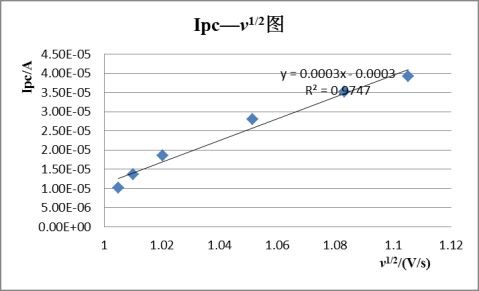
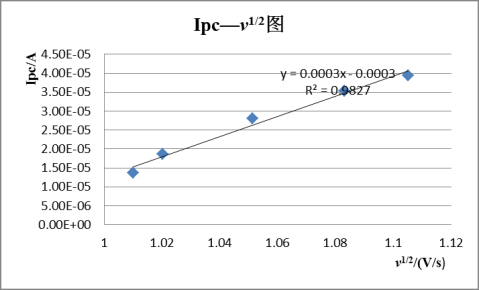
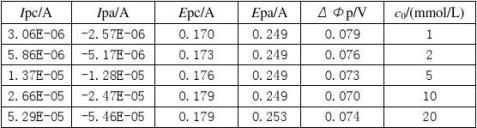
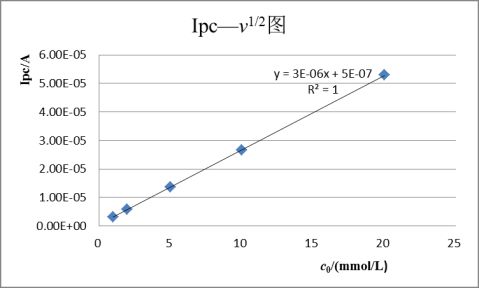
其峰电流与被测物质的浓度c、扫描速度v等因素有关。
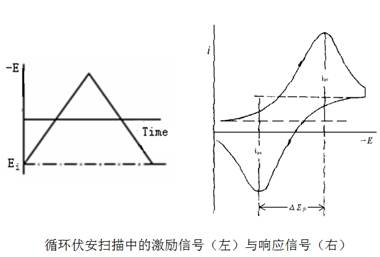
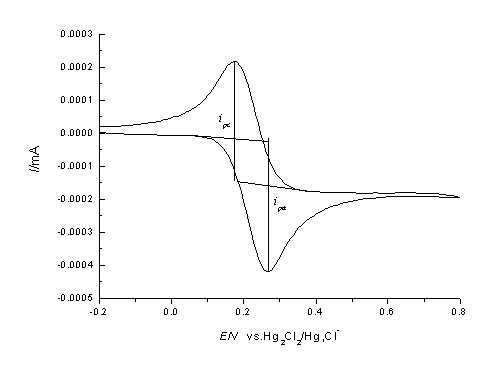
从循环伏安图可以确定氧化峰电流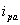 和还原峰峰电流
和还原峰峰电流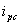 ,氧化峰电位φpa和还原峰电位φpc的值。
,氧化峰电位φpa和还原峰电位φpc的值。
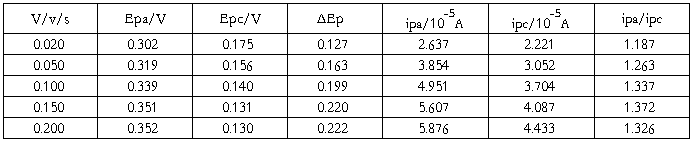
对于可逆体系,氧化峰峰电流与还原峰峰电流比: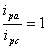
氧化峰峰电位与还原峰峰电位差: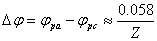 (V)
(V)
条件电位: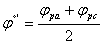 由此可判断电极过程的可逆性。
由此可判断电极过程的可逆性。
三、仪器与试剂
仪器:CHI电化学工作站440;玻碳工作电极,铂丝对电极和饱和甘汞电极。
试剂:
四、实验步骤
1.玻碳电极(金圆盘电极或铂圆盘电极)的预处理
…… …… 余下全文


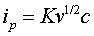 即峰电流与被测物质浓度,扫描速率等有关。
即峰电流与被测物质浓度,扫描速率等有关。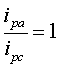
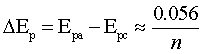
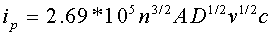
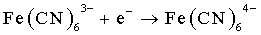
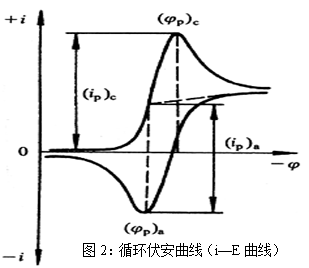 循环伏安法是在固定面积的工作电极和参比电极之间加上对称的三角波扫描电压(如图1),记录工作电极上得到的电流与施加电位的关系曲线(如图2),即循环伏安图。从伏安图的波形、氧化还原峰电流的数值及其比值、峰电位等可以判断电极反应机理。
循环伏安法是在固定面积的工作电极和参比电极之间加上对称的三角波扫描电压(如图1),记录工作电极上得到的电流与施加电位的关系曲线(如图2),即循环伏安图。从伏安图的波形、氧化还原峰电流的数值及其比值、峰电位等可以判断电极反应机理。 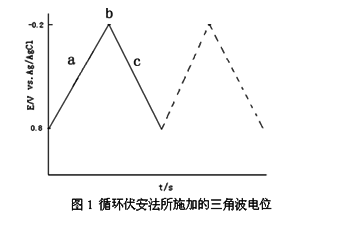




 [(NH3)5Co :Cl-Cr(H2O)5 ] [Co(H2O)6]2++ [Cr(H2O)5Cl]2+ + 5NH4+
[(NH3)5Co :Cl-Cr(H2O)5 ] [Co(H2O)6]2++ [Cr(H2O)5Cl]2+ + 5NH4+ (2)[Fe(CN)6]4- + [IrCl6]2- [Fe(CN)6]3- + [IrCl6]3-
(2)[Fe(CN)6]4- + [IrCl6]2- [Fe(CN)6]3- + [IrCl6]3-