
前 言
主要给出下列信息:
1、 说明与对应的国家标准、行业标准或国际标准的一致性程度;
2、 说明本标准与其它标准或前版标准的关系(如有);
3、 必要时,说明本标准中的附录的性质。
4、 无上级标准的:目前该产品尚无国家标准、行业标准,为规范产品的技术特性,确保产品的安全有效,特制订本注册产品标准,做为生产质量控制的依据。
例:医用电气设备
根据《医疗器械监督管理条例》、《医疗器械标准管理办法》特制订本注册产品标准作为该产品生产、检验、销售的质量依据。
本标准性能指标根据XXXX制订。
本标准电气安全性能全面贯彻GB 9706.1-1995《医用电气设备 第一部分:安全通用要求》的规定,并将其内容列为附录A的形式。
本标准编写格式遵循了《医疗器械标准编写规范》和GB/T 1.1-2000《标准化工作导则 第1部分:标准的结构和编写规则》。
本标准的附录A是规范性附录。
本注册标准由XXXXXXX公司提出并负责起草。
本注册标准主要起草人:XXX。
本注册标准首次发布于200X年XX月。
标准名称
1 范围
本注册标准规定了XXXX(产品名称)的产品分类与标记、要求,试验方法,检验规则,标志、包装、运输、贮存。
本注册标准适用于XXXX(产品名称)(以下简称XX)。该产品 (简单的临床机理及预期目的) 。
(下面以医用电气设备为例子)
2 规范性引用文件
下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准。
引用标准顺序:国家标准、行业标准、国际标准。标准的排列原则:按标准编号由小到大排列。
例:GB/T191-2000 包装储运图示标志
GB9706.1-1995 医用电气设备 第一部分:安全通用要求
GB9969.1 工业产品使用说明书总则
GB/T14710-93 医用电气设备环境要求及试验方法
YY0466-2003 医疗器械用于医疗器械标签、标记和提供信息的符号
医疗器械说明书、标签和包装标识管理规定
3 分类与标记
推荐:分类可按下列原则划分:
a) 产品基本参数(几何尺寸)
b) 产品结构
c) 产品用途
d) 产品功能
3.1 安全分类
按医用电气设备防护分类属:X类X型X设备。
3.2 组成
产品由XXXX组成。
3.3 型号与标记
3.3.1 标记方法
3.3.2 型号
产品按XXXX分为X种型号。(型号差异可列表说明)
3.4 基本参数(与说明书一致)
3.5 平均无故障工作时间
4要求
应提供安全性能及有效性能要求。其编写应考虑要求的合理性、有效性、安全性、适用性、导领性、完整性和协调性。(应充分考虑产品的使用要求和基本性能以及健康、安全、生理、环境保护因素)
1、 安全性能要求
应注意选择适用下列标准:
GB 9706 医用电气设备安全通用要求系列标准;
GB/T 16886 医疗器械生物学评价系列标准;
YY/T 0127 口腔材料生物评价系列标准;
GB 18278~GB 18280 医疗器械灭菌系列标准;
及其它安全要求。
2、 有效性能要求
应包括重要性能、一般性能指标及外观要求。有国家标准、行业标准的产品,其性能应符合上述标准的要求。没有国家标准、行业标准的产品,其性能应由产品制造商根据产品预期应用情况确定,并保持性能要求与说明书中明示的技术指标一致。
(至少应有以下的要求)
4.1 正常工作条件
a)环境温度:
b)相对湿度:
c)大气压力:
d)使用电源电压:
(至少应有以上条件)
4.2 外观与结构
4.3 使用性能
4.4 环境试验要求
产品应符合GB/T 14710中气候环境试验I组(或II组),机械环境试验I组(或II组)的要求。产品的运输试验、电源电压适应能力试验应分别符合GB/T 14710-93中第3章、第4章的要求。
4.5 电气安全要求
应符合附录A的要求。
5 试验方法
试验方法应与要求相对应。试验方法一般应采用已颁布的标准试验方法。如果没有现行的试验方法可采用时,规定的试验方法应具有可操作性和可再现性。试验中使用的测试仪器、设备、工具及标准样品等一般应有规定的精度等级。
在表述试验方法章节前,应有下列引导语(仅限于机电类产品):
推荐:
预处理:试验前,XXXX(产品名称)应在试验场所不通电停放不少于24小时,在正式系列试验前应先按使用说明书运转该产品。
5.1 试验条件(如有)
5.2 外观与结构试验
以目力观察和手感检查,结果应符合4.2的要求。
5.3 使用性能试验
5.4 环境试验要求(此表仅供参考,应结合产品特点重新设置)
按GB/T 14710规定的方法顺序及表1的要求进行试验。
表 1

6 检验规则
应给出下列信息:
1、 产品出厂检验要求;检验内容包括项目、数量、判定规则;
(出厂检验是对正式生产的产品在交货时进行的最终检验,项目一般为非破坏性的、试验时间较短的的试验)
2、 型式试验周期检查要求;检验内容包括条件、项目、数量、判定规则
(型式试验是对产品各项质量指标的全面检验,项目包括要求中的全部内容)
推荐:(有源医疗器械除外)
6.1 XXXX(产品名称)应由生产企业质量检验部门逐台检验合格后方可提交验收。
6.2 检验分出厂检验和型式试验(周期检查)。
6.3 出厂检验
6.3.1 出厂检验应逐台进行。(小仪器可采用百分比抽样)
6.3.2 出厂检验的项目为
6.3.3 所检项目均应合格。
6.4 型式试验(周期检查)
6.4.1在下列情况之一时,应进行型式试验(周期检查)
a) 新产品投产前;
b) 间隔一年以上再投产时;
c) 设计、结构或工艺有较大变动可能影响性能时;
d) 正常生产中每年不少于一次;
e) 国家质量监督机构提出进行周期检查要求时。
6.4.2型式试验(周期检查)从出厂合格品中随机抽取2台(大型仪器可抽1台)。
6.4.3型式试验(周期检查)应包括本标准要求中的所有检查项目。
6.4.4所检项目均应合格。
7标志、包装(使用说明书)、运输、储存
7.1标志
7.1.1产品上应有下列标志
a) 制造厂单位名称、产品名称、规格型号;
b) 生产日期;
c) 产品编号;
d) 注册产品标准号;
e) 产品注册号。
7.1.2产品单包装上应至少提供下列信息:
a) 制造厂名称和商标;
b) 厂址;
c) 产品名称、型式、规格;
d) 数量;
e) 注册产品标准号、产品注册号;
f) 出厂日期;
g) 产品编号或生产批号。
h) “易碎、小心轻放”、“向上”、“保持干燥”等字样或标志。标志应符合GB/T 191-2000和YY 0466的规定。
箱上的字样和标志应能保证不因历时较久而模糊不清。
7.2产品包装应有检验合格证、使用说明书
7.2.1检验合格证应至少提供下列信息:
a) 制造厂名称;
b) 产品名称和型号;
c) 检验日期;
d) 检验员代号。
7.2.2使用说明书的编写应符合GB9969.1和《医疗器械说明书、标签和包装标识管理规定》及本标准附录A.2.11的规定。
7.3 运输
推荐:XXXX(产品名称)允许使用一般交通运输工具,但须防止运输过程中的剧烈冲击、震动及雨雪淋溅。运输要求按订货合同规定。
7.4 贮存
推荐:包装后的XXXX(产品名称)应贮存在环境温度X℃-X℃,相对湿度不大于80%、无腐蚀性气体、通风良好的室内。
有源产品应至少贯彻GB 9706.1或其它安全标准以附录A的形式体现出来,现以GB 9706.1为例以示说明
附录 A
(规范性附录)
安全要求和试验方法及检验规则
A.1 产品特征
a)所属的安全类别:I类或II类或内部电源;
b)所属的防护类型:B型或BF型或CF型;
c)电源种类:多相或单项,网电源供电或内部电源供电或特定电源供电;
d)输入功率: ;
e)是否具有应用部分;
f)是否具有信号输入或信号输出部分 ;
g)是否属普通型设备或浸液分类 。
注:110项条款应逐一列出,如适用部分写明要求与试验方法,不适用部分请注明“不适用”
A.2 要求和试验方法
A.2.1 外部标记
A.2.1.1 要求:产品只要应有下列“永久贴牢”和“清楚易认”的标记
a)制造单位名称:XXXX
b)产品名称及型号:XXXX
c)产品制造序号;
d)电源电压:XXXX
e)电源频率:XXXX
f)输入功率:XXXX
g)安全分类:XXXX
A.2.1.2 试验方法:按GB9706.1-1995中6.1规定的试验方法。
A.2.2 内部标记
A.2.2.1 要求:只有使用工具才能触及到的熔断器,必须在熔断器附近标上其型号和额定值
A.2.2.2 试验方法:通过检查予以验证。
.
A.2.109 过电流和过电压保护
A.2.110 油箱
注:检验项目的确定是根据GB 9706.1-1995标准实施及监督检查工作计划(附件1)(国药器监字〔1997〕第275号),表A.1检验项目的内容如不适用可以删去。
A.3 检验规则
A.3.1 检验分类与检验项目
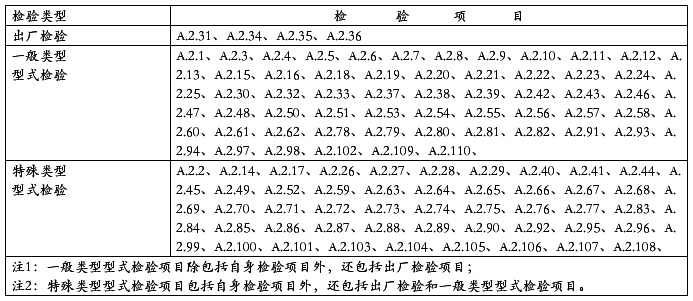
产品的安全性能检验分出厂检验和型式检验。型式检验又分为一般类型型式检验和特殊类型型式检验。
出厂检验是产品出厂前的检验。
一般类型型式检验是产品进行产品注册检验、周期检验、许可证换发检验时的检验。
特殊类型型式检验是产品进行产品安全认证检验时的检验。
各检验类型的检验项目按表A.1的规定。
A.3.2 判定规则
A.3.2.1 出厂检验:所检项目均应合格。
A.3.2.2安全认证检验:抽样数量为一台。在检验的项目中,如有不符合本标准要求的项目时,允许对不合格项进行修复,修复后根据验收方或“第三方”与生产方共同商定的复验项目进行检验,如仍有一项不符合本标准要求时,判为不合格产品。
A.3.3 周期检验、注册检验和许可证检验:抽样数量为一台。在检验的项目中,如有不符合本标准要求的项目时,抽取双倍数量的产品,对不合格项目进行检验,如有二台中仍有一项不符合本标准要求时,判为不合格。
表 A.1
――――――――
第二篇:医疗器械注册产品标准编写规范[1]
关于发布医疗器械注册产品标准编写规范的通知
国药监械[2002]407号
20xx年11月07日 发布
有关单位:
根据《医疗器械标准管理办法》的规定,我局组织制定了《医疗器械注册产品标准编 写规范》,现印发至你单位,请参照执行。
附件:医疗器械注册产品标准编写规范
国家药品监督管理局
二○○二年十一月七日
附件
医疗器械注册产品标准编写规范
1 范围
本规范规定了医疗器械注册产品标准编写规范。
2 规范性引用文件
下列文件中的条款通过本规范的引用而成为本规范的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本规范,然而,鼓励根据本规范达成协议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本规范。
医疗器械监督管理条例
医疗器械注册管理办法
医疗器械标准管理办法
GB/T 1.1-2000 标准化工作导则 第1部分:标准的结构和编写规则
3 要求
注册产品标准一般应包括下列基本内容:
3.1 注册产品标准名称
注册产品标准名称应与注册产品名称一致,并应避免采用商品名确定注册产品名称。
3.2 前言
注册产品标准应有前言,主要给出下列信息:
3.2.1说明与对应的国家标准、行业标准或国际标准的一致性程度;
3.2.2说明本标准与其它标准或前版标准的关系(如有);
3.2.3必要时,说明本标准中的附录的性质
3.3 范围
明确陈述本标准规范的对象和所涉及的各个方面,指明适用的界限。
3.4 规范性引用文件
应包括引导语和规范性引用文件的一览表。一览表中引用文件的排列顺序为:国家标准、行业标准、国际标准及规范性文件等。
3.5 分类和分类标记
为符合标准要求的产品(系列)建立一个分类、型号、产品代码或产品标记,可以包括规格、尺寸、基本参数等。
3.6 安全性及有效性要求
安全性及有效性要求的编写应考虑要求的合理性、有效性、安全性、适用性、导领性、
完整性和协调性。
3.6.1 安全性能要求
应注意选择适用下列标准:
GB 9706医用电气设备通用安全要求系列标准;
GB/T 16886医疗器械生物学评价系列标准;
YY/T口腔材料生物学评价系列标准;
及其它安全要求。
3.6.2 有效性能要求
应包括重要性能和一般性能指标。有国家标准、行业标准的产品,其性能应符合上述标准的要求。没有国家标准、行业标准的产品,其性能应由产品制造商根据产品预期应用情况确定,并保持性能要求与说明书中明示的技术指标一致。
3.7 试验方法
试验方法应与要求相对应。试验方法一般应采用已颁布的标准试验方法。如果没有现行的试验方法可采用时,规定的试验方法应具有可操作性和可再现性。试验中使用的测试仪器、设备、工具及标准样品等一般应有规定的精度等级。
3.8 检验规则(如有)
3.9 标志、标签(如有)
应根据产品特点、使用要求、相关标准及法律法规等的要求规定标志、标签。
3.10 包装、运输、储存(如有)
应根据产品的特点及相关标准规定产品的包装要求、运输储存要求。随机文件是产品的一部分,应对随机文件作出规定。
3.11 附录(如有)
应在标准附录中列出标准正文附
