绿色化学与化工导论学习心得
学完这门课程后我知道,“绿色化学”这一名称最早出现在美国环保局的官方文件中用以突出化学对环境的友好。后经各方面的努力,使得“绿色化学”这个名称广为传播。 “绿色化学”是当今社会提出的一个新概念,它涉及影响到社会的方方面面,无论是工业、农业、新能源,还是我们的生活、环境,绿色化学都占据着举足轻重的地位。
绿色化学又称环境无害化学、环境友好化学、清洁化学。绿色化学是设计研究没有或只有尽可能少的环境负作用,并在技术上、经济上可行的化学品和化学过程。包括原料和试剂在反应中的充分利用(原子经济性),它是实现化学污染防治的基本方法和科学手段,是一门从源头上阻止污染的化学,绿色化学适用各种化学领域。是用化学的技术和方法去减少或消灭那些对人类健康、社区安全、生态环境有害的原料、催化剂、溶剂、试剂和产物、副产物等的使用和产生。它是实现污染预防的基本的和重要的科学手段,包括许多化学领域,如合成、催化、工艺、分离和分析监测等。
绿色化学作为一门前端且实用的科学,它的主要特点有:1.充分利用资源和能源,采用无毒、无害的原料;2.在无毒、无害的条件下进行反应,以减少废物向环境排放;3.提高原子的利用率,力图使所有作为原料的原子都被产品所消纳,实现“零排放”;4.生产出有利于环境保护、社区安全和人体健康的环境友好的产品。
绿色化学是一种理念,它说明了化学对对环境的负面作用是可以
避免的。绿色化学的理想在于不再使用有毒、有害的物质,不再产生废物,不再处理废物。它是一门从源头上阻止污染的化学。这种预防化学污染的新理念和新实践正日益被人们认识、接受和重视。绿色化学的最大特点在于它是在始端就采用实现污染预防的科学手段,因而过程和终端均为零排放或零污染。它研究污染的根源--污染的本质在哪里,它不是去对终端或过程污染进行控制或进行处理。绿色化学关注在现今科技手段和条件下能降低对人类健康和环境有负面影响的各个方面和各种类型的化学过程。绿色化学主张在通过化学转换获取新物质的过程中充分利用每个原子,具有"原子经济性",因此它既能够充分利用资源,又能够实现防止污染。很明显,绿色化学要求负作用尽可能小,它是一种理念,是人们应该倾力追求的目标。在这一次到宇腾的见习可以说是第一次对这个绿色化学理念有了一个具体的概念,整个生产中原料的选择是尽可能的丰富和多样并且没有直接的污染和最后产品的多样化。同时也感受到从课本上的知识到工业化的生产的距离还有很遥远,但是也可以体会到当我们从事生产时就要把这种理论变为实际的力量的强大,把绿色化学这个理念同生产完美的结合在一起。宇腾公司在生产过程中经过多步操作采用不同的工艺得到不同的产品,从而实现了原料的最大利用,在得到主产品铅的同时也得到了金、银等贵重金属和工业硫酸。在这个过程中没有废气、废液的排放,经过处理后又可以重复利用,在冶炼的过程中仅有的一点矿渣也可以用来烧砖。这个一系列的工艺生产可以说基本上实现了绿色化学这个概念。从能源的利用上宇腾公司可以说也是不错的,他们
利用煅烧炉反应后的余热给办公室供应暖气还给需要加热的原料预热,在能源上得到了充分的利用。最给力的应该是在技术上的创新了,利用的是富氧底吹技术煅烧原料,可以说是一举两得事,一来使得原料反应更完全回收率得到了提高,二来不仅提高了反应炉温度的稳定而且又节约了燃料。该公司利用这几项优势整合到一起基本上就实现了绿色化学生产了,这种方法应该是值得我国新兴的化工生产借鉴的。但是对于已经建好的工厂又可用什么方法实现绿色化生产呢?在这次的参观过程中也感受到要在工业生产中要真正实现绿色化学就必须要把公司所生产的主打产品的工艺过程中所出现的其他产物了解清楚并且要知道所都得到浓度和质量能不能进一步进行工业生产。而且相应的公司就要引进其他生产线生产,从而实现绿色化并且为公司赢得附加的利润。这也和我们绿色化学的理念是一致的。但问题是我国现在已经建立了很多单一生产线的化工厂,他们在生产过程中有毒的中间产物要处理就避免不了对环境造成的污染很大,那我们的绿色化学也可以从改变化学反应的机理出发使反应的历程改变使得不希望的副反应不发生和使得我们不要的物质都留到了矿渣当中。而不是单一的把几个工厂搬到一起来。我们要真正实现绿色化学这个概念就应该从最基本的原理出发去改变反应机理,实现原料的最大利用。从而可以最大限度的改变我国这么大的环境压力,还给人们一个碧海然天的地球。绿色化学作为一门前端且实用的科学,它的主要特点有:
1.充分利用资源和能源,采用无毒、无害的原料;2.在无毒、无害的条件下进行反应,以减少废物向环境排放;3.提高原子的利用率,力
图使所有作为原料的原子都被产品所消纳,实现“零排放”;4.生产出有利于环境保护、社区安全和人体健康的环境友好的产品。要人们树立起绿色化学的概念,应该从孩子做起,要让他们知道是化学改变了我们的世界也是它污染了我们这个原本干净的世界同时也可以运用化学使他复原就像“可逆反应”一样,我们都知道地球是圆的,那么也就有理由去相信化学反应也就像一个圆一样其实是没有起点和终点之分的,也就没有污染这个问题。只是我们现在还没有找到那个入口的钥匙而已。孩子对新事物的想象是神奇的,他们看事物的角度会多种多样,现在教育最关键的问题应该是从小培养具有环境保护意识的人,学生最早系统地学习化学知识是在中等基础教育阶段,这就需要将绿色化学思想贯穿于中学化学教育的全过程中。使绿色化学成为中学化学教育的一个重要的组成部分,这是中学化学教育的崭新课题。要把绿色化学的理念贯穿到整个化学教育之中,首先,绿色化学有利于保护人类赖以生存的环境、实现人类社会的可持续发展。其次,化学教育必须体现绿色化学的新内容,要在课程教材中体现绿色化学的理念,使绿色化学的思想和内容贯穿于从基础教育到高等教育的始终。 要始终贯彻绿色化学的思想;要让学生了解绿色化学,树立起绿色意识,培养学生从事绿色化学研究与开发的能力。从绿色化学的角度来看,化学中许多物质的制取反应、化学工艺等等都是值得讨论和重新考虑的。这给改革课堂教学、培养学生的创新精神和创新能力提供了良好的契机。绿色化学不但有重大的社会、环境和经济效益,而且说明化学的负面作用是可以避免的,显现了人的能动性。绿色化学
体现了化学科学、技术与社会的相互联系和相互作用,是化学科学高度发展以及社会对化学科学发展的作用的产物,对化学本身而言是一个新阶段的到来。作为新世纪的一代,不但要有能力去发展新的、对环境更友好的化学,以防止化学污染;而且要让年轻的一代了解绿色化学、接受绿色化学、为绿色化学作出应有的贡献,所以我们教育年轻一代时不要用过多的条条框框去限制他们的思维,我们要保留他们从小对科学的向往和心中的神奇的梦想。因为我们知道可以毫不夸张的说要真正意义上实现绿色化学的概念,那么我们现有的化学反应基本要被推翻。那么就需要不同的思想,不同的方法来实现这个改变。
“绿色化学”是当今社会提出的一个新概念。在“绿色化学工艺”中,理想状态是反应物中原子全部转化为欲制得的产物,即原子利用率为100%(原子经济性)。原子的利用率越高,意味着生产过程中废物的排放量越少,对环境的影响也越小。“绿色化学”是指从技术、经济上设计出可行的化学反应,尽可能减少对环境的负作用。20世纪90年代初,国际上提出了“预防污染”这一新概念。绿色化学是“预防污染”的根本手段,它的目标是研究和寻找能充分利用的无毒害原材料,最大限度地节约能源,在化工生产各环节都实现净化和无污染的反应途径。绿色化学是“预防污染”的根本手段,而对污染物的处理,最根本的方法就是杜绝污染源。关于化工厂的选址,应充分考虑环境问题,要符合“省资源、节能源,省污染,减成本”的绿色化学要求。
第二篇:20xx~20xx学年度高三化学新学期一轮化学反应速率化学平衡练习
2015~2016学年度高三化学一轮复习化学反应速率 化学平衡练习一
化学反应速率 化学平衡 基础回扣
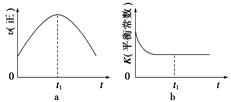
1.某温度时,在2 L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示。

(1)由图中的数据分析,该反应的化学方程式为
________________________________________________________________________。
(2)反应开始至2 min,Z的平均反应速率为__________________________。
(3)反应开始至2 min,用X、Y表示平均反应速率分别为________、________。
(4)5 min后 Z的生成速率与5 min末Z的分解速率______(填“变大”、“变小”、“相等”或“无法判断”)。
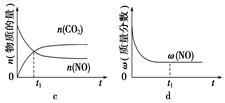
2.一定条件下反应C(s)+CO2(g)  2CO(g) ΔH>0,在体积不变的密闭容器中达到平衡,按要求回答下列问题:
2CO(g) ΔH>0,在体积不变的密闭容器中达到平衡,按要求回答下列问题:
(1)平衡常数表达式是______________。
(2)若升高温度,反应速率________(填“增大”、“减小”或“不变”,下同),平衡常数K________,平衡向________方向移动。
(3)再通入一定量的CO2气体,反应速率________,平衡常数K________,平衡向________方向移动,CO2的转化率________。
(4)再充入一定量的N2,反应速率________,平衡常数K________,平衡________移动。
3.正误判断,正确的打“√”,错误的打“×”
(1)在其他条件不变时,使用催化剂,正反应速率和逆反应速率同等倍数加快,平衡不移动( )
(2)当某反应达到限度时,反应物和生成物的浓度一定相等( )
(3)在一定条件下,向密闭容器中充入1 mol N2和3 mol H2充分反应,达到平衡时N2、H2、NH3三者共存( )
(4)当一个可逆反应达到平衡状态时,正向反应速率和逆向反应速率相等且都等于0( )
(5)在相同温度下,在相同容积的密闭容器中分别充入1 mol N2、3 mol H2和2 mol NH3,当反应达到平衡时,两平衡状态中NH3的体积分数相同( )
(6)化学平衡移动,化学平衡常数不一定改变( )
(7)加入少量CH3COONa晶体可以减小Zn与稀硫酸反应的速率,但不影响产生H2的总量( )
(8)化学平衡向右移动,一定是正反应速率增大或逆反应速率减小( )
(9)任何可逆反应达到平衡后,改变温度,平衡一定发生移动( )
(10)化学反应速率发生变化,化学平衡一定发生移动( )
(11)对于反应Zn+H2SO4===ZnSO4+H2↑,增加Zn的质量(不考虑表面积变化),生成H2的速率加快( )
(12)对于2SO2+O22SO3的可逆反应,改变条件使平衡向右移动,SO2的转化率可能增大,也可能减小( )
(13)在温度不变的条件下,改变条件使2SO2+O2 2SO3的平衡向右移动,平衡常数不变( )
2SO3的平衡向右移动,平衡常数不变( )
一、题型1 化学反应速率及影响因素
2.(2014·新课标全国卷Ⅰ,9)已知分解1 mol H2O2放出热量98 kJ,在含少量I-的溶液中,H2O2分解的机理为H2O2+I-—→H2O+IO- 慢 H2O2+IO-—→H2O+O2+I-快
下列有关该反应的说法正确的是( )
A.反应速率与I-浓度有关 B.IO-也是该反应的催化剂
C.反应活化能等于98 kJ·mol-1 D.v(H2O2)=v(H2O)=v(O2)
3.[2014·广东理综,33(1)]某小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响。限选试剂与仪器:30%H2O2、0.1 mol·L-1Fe2(SO4)3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器。
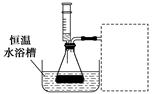
①写出本实验H2O2分解反应方程式并标明电子转移的方向和数目:________________________________________________________________________。
②设计实验方案:在不同H2O2浓度下,测定________________(要求所测得的数据能直接体现反应速率大小)。
③设计实验装置,完成上图的装置示意图。
④参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母表示)。

1.下列关于化学反应速率的说法中,正确的是( )
A.化学反应速率是指某一时刻某种反应物的瞬时反应速率
B.化学反应速率为0.8 mol·L-1·s-1是指反应1 s时某物质的浓度为0.8 mol·L-1
C.根据化学反应速率的大小可推知化学反应的快慢
D.对于一个化学反应来说,其反应速率越大,反应现象就越明显
2.在恒温、恒容的密闭容器中进行反应2H2O22H2O+O2↑。若H2O2溶液的浓度由2.0 mol·L-1降到1.0 mol·L-1需10 s,那么H2O2浓度由1.0 mol·L-1降到0.5 mol·L-1所需的反应时间为( )
A.5 s B.大于5 s C.小于5 s D.无法判断
3.对于可逆反应mA(g)+nB(g)pC(g)+qD(g),若其他条件都不变,只是在反应前是否加入催化剂,可得到如下两种v-t图像:
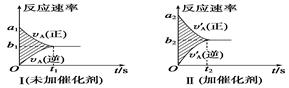
下列判断正确的是( )
A.a1>a2 B.t1<t2
C.两图中阴影部分面积相等 D.图Ⅱ中阴影部分面积更大
4.影响化学反应速率因素很多,课外兴趣小组用实验方法探究影响化学反应速率的因素。
实验一:利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol·L-1、2 mol·L-1、18.4 mol·L-1),设计实验方案,研究影响反应速率的因素。
(1)甲同学的实验报告如表所示:

该同学的实验目的是__________________,要想得出正确的实验结论,还需要控制的实验条件是________________________________________________________________________。
(2)乙同学为了能精确地研究浓度对反应速率的影响,在相同温度下利用如图所示装置进行定量实验。完成该实验应选用的实验药品是________,应该测定的实验数据是_______。

实验二:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,开始一段时间内反应速率较小,溶液褪色不明显,但反应一段时间后,溶液突然褪色,反应速率明显增大。
(3)针对上述实验现象,某同学认为该反应放热,导致溶液的温度升高,从而使反应速率增大。从影响化学反应速率的因素看,你认为还可能是________的影响。
(4)若要用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,还可以在反应开始时加入________(填字母)。
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水
二、题型2 化学平衡状态及平衡和移动方向的判断
1.(2012·上海,33)用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g)+2N2(g)+6H2(g)Si3N4(s)+12HCl(g) ΔH=-Q(Q>0)
一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是_______(。
a.3v逆(N2)=v正(H2) b.v正(HCl)=4v正(SiCl4)
c.混合气体密度保持不变 d.c(N2)∶c(H2)∶c(HCl)=1∶3∶6
2.(2014·海南,12改编)将BaO2放入密闭的真空容器中,反应2BaO2(s)2BaO(s)+O2(g)达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是( )
A.平衡常数减小 B.BaO量不变 C.氧气压强增大 D.BaO2量增加
3.(2014·重庆理综,7)在恒容密闭容器中通入X并发生反应:2X(g)  Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示。下列叙述正确的是( )
Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示。下列叙述正确的是( )
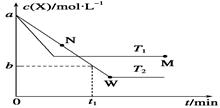
A.该反应进行到M点放出的热量大于进行到W点放出的热量
B.T2下,在0~t1时间内,v(Y)= mol·L-1·min-1
C.M点的正反应速率v正大于N点的逆反应速率v逆
D.M点时再加入一定量X,平衡后X的转化率减小
(一)平衡状态的建立
1.下列说法可以证明H2(g)+I2(g)  2HI(g)已达平衡状态的是( )
2HI(g)已达平衡状态的是( )
①单位时间内生成n mol H2的同时,生成n mol HI ②一个H—H 键断裂的同时有两个H—I键断裂 ③百分含量w(HI)=w(I2) ④反应速率v(H2)=v(I2)=1/2v(HI) ⑤c(HI)∶c(H2)∶c(I2)=2∶1∶1 ⑥温度和体积一定时,某一生成物浓度不再变化 ⑦温度和体积一定时,容器内压强不再变化 ⑧条件一定,混合气体的平均相对分子质量不再变化 ⑨温度和体积一定时,混合气体颜色不再变化 ⑩温度和压强一定时,混合气体的密度不再变化
A.①②③④ B.②⑥⑨ C.②⑥⑨⑩ D.③⑤⑥⑦⑧
2.将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)  2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是( )
2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是( )
A.2v(NH3)=v(CO2) B.密闭容器中c(NH3)∶c(CO2)=2∶1
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
(二)平衡移动方向和结果的判定
3.在某恒温、恒容的密闭容器内发生反应:2NO2(g)  2NO(g)+O2(g) ΔH>0,开始时充入2 mol NO2并达到平衡,下列说法正确的是( )
2NO(g)+O2(g) ΔH>0,开始时充入2 mol NO2并达到平衡,下列说法正确的是( )
A.再充入2 mol NO2,平衡正向移动,O2的体积分数增大
B.升高温度,O2的体积分数减小
C.增大压强,化学平衡逆向移动,NO2的体积分数增大
D.再充入1 mol O2,NO2的体积分数增大
4.下列说法正确的是( )
A.工业生产硫酸中采用高温可提高二氧化硫的转化率
B.合成氨工业中,适当高的温度既可以提高反应速率,又可以使催化剂的活性最大
C.用氢氧化钠溶液吸收二氧化碳气体,升高温度可使吸收速率加快
D.酯化反应是一个可逆的吸热反应,故温度越高越有利于生成酯
5.将等物质的量的X、Y气体充入某密闭容器中,一定条件下,发生如下反应并达到平衡:X(g)+3Y(g)  2Z(g) ΔH<0。改变某个条件并维持新条件直至达到新的平衡,下表中关于新平衡与原平衡的比较正确的是( )
2Z(g) ΔH<0。改变某个条件并维持新条件直至达到新的平衡,下表中关于新平衡与原平衡的比较正确的是( )

昌平一中2014~2015学年度高三化学三轮复习练习二
化学反应速率 化学平衡
三、题型3 用平衡常数和转化率定量研究化学反应的限度
1已知t ℃时,反应FeO(s)+CO(g)  Fe(s)+CO2(g)的平衡常数K=0.25。
Fe(s)+CO2(g)的平衡常数K=0.25。
①t ℃时,反应达到平衡时n(CO)∶n(CO2)=______。
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入x mol CO,t ℃时反应达到平衡。此时FeO(s)转化率为50%,则x=________。
2.(2014·海南,14)硝基苯甲酸乙酯在OH-存在下发生水解反应:
O2NC6H4COOC2H5+OH-O2NC6H4COO-+C2H5OH
两种反应物的初始浓度均为0.050 mol·L-1,15 ℃时测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。回答下列问题:

(1)列式计算该反应在120~180 s与180~240 s区间的平均反应速率____________、____________;比较两者大小可得出的结论是____________________。
(2)列式计算15 ℃时该反应的平衡常数____________。
(3)为提高O2NC6H4COOC2H5 的平衡转化率,除可适当控制反应温度外,还可采取的措施有____________________________________(要求写出两条)。
3.研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)  NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)
NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)
2NO(g)+Cl2(g)  2ClNO(g) K2 ΔH2<0(Ⅱ)
2ClNO(g) K2 ΔH2<0(Ⅱ)
(1)4NO2(g)+2NaCl(s)  2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=________________(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=________________(用K1、K2表示)。
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10 min 时反应(Ⅱ)达到平衡。测得10 min内v(ClNO)=7.5×10-3 mol·L-1·min-1,则平衡后n(Cl2)=______ mol,NO的转化率α1=______。其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2____α1(填“>”“<”或“=”),平衡常数K2________(填“增大”“减小”或“不变”)。若要使K2减小,可采取的措施是
_________________________ _____。
(一)平衡常数及转化率含义的理解
1.对于可逆反应,下列说法正确的是( )
A.化学平衡常数只与温度有关
B.升高温度,化学平衡常数一定增大
C.正反应的化学平衡常数与逆反应的化学平衡常数一定不相等
D.增大反应物浓度,化学平衡常数可能增大
2.已知可逆反应:2N2H4(g)+2NO2(g)  3N2(g)+4H2O(g) ΔH>0。下列正确的是( )
3N2(g)+4H2O(g) ΔH>0。下列正确的是( )
A.加压有利于化学平衡向正反应方向移动
B.该反应的化学平衡常数表达式为K=
C.升高温度可缩短反应达平衡的时间但不能提高平衡转化率
D.使用催化剂可缩短反应达平衡的时间但不能提高平衡转化率
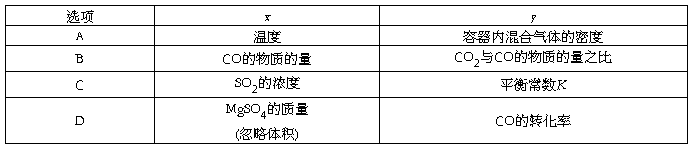
3.一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:
MgSO4(s)+CO(g)  MgO(s)+CO2(g)+SO2(g)ΔH>0
MgO(s)+CO2(g)+SO2(g)ΔH>0
该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )

4.相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)  2NH3(g) ΔH=-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如下表所示:
2NH3(g) ΔH=-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如下表所示:
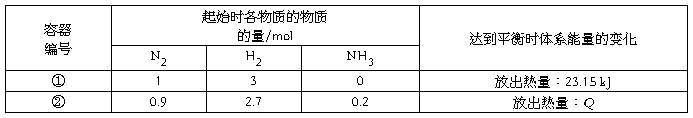
下列叙述错误的是( )
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为1/7
C.容器②中达到平衡时放出的热量Q=23.15 kJ
D.若容器①的体积为0.5 L,则平衡时放出的热量小于23.15 kJ
5.容积均为1 L的甲、乙两个恒容容器中,分别充入2 mol A、2 mol B和1 mol A、1 mol B,相同条件下,发生下列反应:A(g)+B(g) xC(g) ΔH<0。测得两容器中c(A) 随时间t的变化如图所示,下列说法不正确的是( )
xC(g) ΔH<0。测得两容器中c(A) 随时间t的变化如图所示,下列说法不正确的是( )
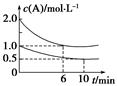
A.x=1 B.此条件下,该反应的平衡常数K=4
C.给乙容器升温可缩短反应达平衡的时间但不能提高平衡转化率
D.甲和乙中B的平衡转化率相等
6.CH4和H2O(g)在催化剂表面发生反应CH4+H2O CO+3H2,该反应在不同温度下的化学平衡常数如下表:
CO+3H2,该反应在不同温度下的化学平衡常数如下表:

(1)该反应是________(选填“吸热”或“放热”)反应。
(2)T ℃时,向1 L密闭容器中投入1 mol CH4和1 mol H2O(g),平衡时c(CH4)=0.5 mol·L-1,该温度下反应CH4+H2O CO+3H2的平衡常数K=__________。
CO+3H2的平衡常数K=__________。
(3)T ℃时,向1 L密闭容器中投入2 mol CH4、1 mol H2O(g)、1 mol CO、2 mol H2,则反应的正反应速率________(填“<”、“>”或“=”)逆反应速率。
四、题型4 以图像为载体的化学反应速率和平衡的综合考查
2.(2014·新课标全国卷Ⅱ,26)在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。

回答下列问题:
(1)反应的ΔH______0(填“大于”或“小于”);100 ℃时,体系中各物质浓度随时间变化如上图所示。在0~60 s时段,反应速率v(N2O4)为__________________ mol·L-1·s-1;反应的平衡常数K1为________________。
(2)100 ℃时达平衡后,改变反应温度为T,c(N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。
①T________100 ℃(填“大于”或“小于”),判断理由是____________________________。
②列式计算温度T时反应的平衡常数K2__________________________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向________(填“正反应”或“逆反应”)方向移动,判断理由是________________________________________________。
3.[2014·北京理综,26(2)]对于反应2NO(g)+O2(g)  2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线(如图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线(如图)。
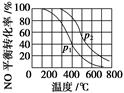
①比较p1、p2的大小关系:________。
②随温度升高,该反应平衡常数变化的趋势是_____________________________________。
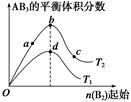
1.某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g)  2AB3(g)化学平衡状态的影响,得到如右图所示的曲线(图中T表示温度,n表 示物质的量)。下列判断正确的是( )
2AB3(g)化学平衡状态的影响,得到如右图所示的曲线(图中T表示温度,n表 示物质的量)。下列判断正确的是( )
A.在T2和n(A2)不变时达到平衡,AB3的物质的量大小为c>b>a
B.若T2>T1,则正反应一定是放热反应
C.达到平衡时,A2的转化率大小为b>a>c
D.若T2>T1,达到平衡时b、d点的反应速率为vd>vb
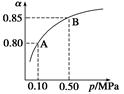 2.对于反应2SO2+O2
2.对于反应2SO2+O2 2SO3
2SO3
(1)某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如右图所示。平衡状态由A变到B时,平衡常数K(A)________K(B)(填“>”、“<”或“=”)。
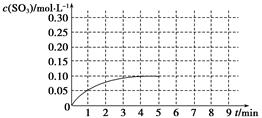
(2)将一定量的SO2(g)和O2(g)放入某固定体积的密闭容器中,在一定条件下,c(SO3)的变化如下图所示。若在第5分钟将容器的体积缩小一半后,在第8分钟达到新的平衡(此时SO3的浓度为0.25 mol·L-1)。请在下图中画出此变化过程中SO3浓度的变化曲线。
3.20##年初,雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
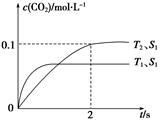
汽车尾气净化的主要原理为2NO(g)+2CO(g)2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
据此判断:
(1)该反应的ΔH______0(填“>”或“<”)。
(2)在T2温度下,0~2 s内的平均反应速率v(N2)=_______________________________。
(3)当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
(4)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是______(填代号)。