第六章相平衡中、英文习题与参考答案
1、 在推导相律时,C个组分是否在每一相中都必须存在?
答:在推导相律时,随然假设C个组分在每一相中都存在,但实际某一相中的组分数即使小于C,限制条件同样随之减少,相律不受影响。
2、 指出下列各系统的独立组分数和自由度数:
(1) (1) NH4Cl(s)部分分解为NH3(g)和HCl(g),并达到分解平衡;
(2) (2) CaCO3(s)达到分解平衡;
(3) (3) C(s)和CO(g)、CO2(g)、O2(g)在700℃时达到平衡。
[(1)、2,2。(2)、2,1。(3)、2,1。]
(4) 3、试用相相律分析,用碳还原金属氧化物MeO的反应体系中能否用控制温度来控制Me的蒸气压?
(5) 解:系统中反应:
(6) C(s)+MeO(s)=CO(g)+Me(g)
(7) 2CO(g)=CO2(g)+C(s)
(8) 压力平衡:
(9) 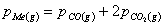
(10) 系统中C=5-2-1=2
(11) P=3
F=C-P+2
=3-3-2=1
由于自由度为1,平衡时T、p及各物质浓度等条件中只有一个是独立变化的,所以指定温度时,压力随之而改变,可以用控制温度来控制Me的蒸汽压。
4、如何用相律说明两组分气液平衡相图中恒沸点混合物是混合物而不是化合物。
答:二组分气液平衡相图系统恒沸混合物特点是,气相与其平衡的液相组成如何相同,R‘=1。
由相律可知:
F=C+P+2
=(2-0-2)-2+2
=1
压力确定时,该平衡系统中温度、气、液相组成也恒定,若压力改变时,平衡系统中温度、气、液相组成也相应改变。所以恒沸点组成随压力改变而改变。因此,恒沸混合物是混合物而不是化合物。
5、在100 kPa下,A、B二组分系统的沸点-组成图
如右图:
(1) (1) 图中E点对应的温度TE称为什麽温度,此
点对应的气相和液相的组成有何关系?
(2) (2) 曲线1和曲线4各称为什麽线?
(3) (3) 总组成在0~xB,E范围内,B组分在气相中的含量与在平衡液相中的含量有和何关系?
答:(1)图中E点对应的温度TE称最低恒沸点,此
点对应的气相和液相的组成相等。
(1) (1) 曲线1和曲线4各称气相线和液相线。
(2) (2) 总组成在0~xB,E范围内,B组分在气相中的含量大于平衡液相中的含量。
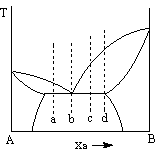
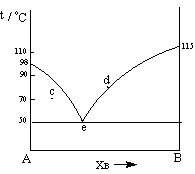
6、 某A、B二组分系统在压力pÆ下的气-液平衡相图
如右图。讨论组成为a、b、c、d各点的物系加热
时状态的变化。
答:a点处于A、B部分互溶的两液相层l1、l2,当加热到最低
共沸点时TE时出现三相平衡即l1、l2和气相g,继续加热
进入气液两相区,最后进入一相气相区。
b点处于A、B部分互溶的两液相层l1、l2,当加热到最低
共沸点时TE时出现三相平衡即l1、l2和气相g,继续加热到T1进入液相区。
c点同a点相似。
d点处于A、B部分互溶的两液相层l1、l2,当加热到最低
共沸点时TE时l1消失,同时气相出现,进入气液两相区。继续加热到T2进入液相区。
 7、 某二元凝聚物系相图如右图所示。
7、 某二元凝聚物系相图如右图所示。
(1)(1) 请指出相图中各区域的相数和相态;
(2)(2) 指出三相线;
(3)(3) 分别从a、b、c、d、e、f点绘制步冷曲线;
(4)(4) 指出系统沿每条步冷曲线的相态变化。
(略)
 8、 A-B合金相图如右图。图中PE、QE可分别称做
8、 A-B合金相图如右图。图中PE、QE可分别称做
A与B凝固点下降曲线,该曲线能否用凝固点下
降公式计算求得?为什麽?
答:该曲线不能用凝固点下
降公式计算求得。不是稀溶液。
9、已知铋的熔点为544。5K,镉的熔点为594K,铋与镉的低共熔温度为Tf=408K,铋的摩尔溶化热为10。88kJ?mol-1, 镉的摩尔溶化热为6。07 kJ?mol-1,设溶液是理解的。试计算低共熔混合物的组成。
解:由凝固点降低公式:
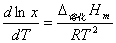
将如上公式应用于铋,设共熔混合物中铋的含量以摩尔分数表示为x。假设Δ溶化Hm与温度无关。当x=1时为纯铋。
由积分公式得:
x=0.44
10、苯和萘的熔点分别为5。5℃和79。9℃,摩尔溶化热分别为9。837 kJ?mol-1和19。08 kJ?mol-1,苯和萘可形成低共熔混合物的固相完全互溶系统,求出该体系的低共熔点的组成和温度。并绘出草图相图。
解:设苯和萘的组成分别为x1和x2,苯和萘的溶化热与温度无关。由凝固点下降公式:
苯:
 --------------------------(1)
--------------------------(1)
萘:
 ------------------------(2)
------------------------(2)
由(1)(2)联立得解低共熔点组成和温度:
x=0.865
T=-3℃
11、A液体的正常沸点为338K,其气化热为34。727kJ?mol-1.A液体和B液体可形成理想液态混合物。今将1mol的A与9mol的B混合形成理想液态混合物,其沸点为320K。试计算:
(1) (1) 将组成xA=0.4的这种混合形成理想液态混合物置于带活塞的汽缸内,开始时活塞与汽缸接触,若在320K下渐渐降低活塞的压力,当液体内出现第一个气泡时,气相组成yA=?气相总压p总=?
(2) (2) 若将活塞上的压力继续减压,溶液在恒温320K下继续气化,当最后只剩下一滴液体时,这一滴液体组成气相组成yA=?气相总压p总=?
解:(1)
设气化热为一常数。
由克劳修斯―克拉贝龙方程计算320K时A的饱和蒸汽压:
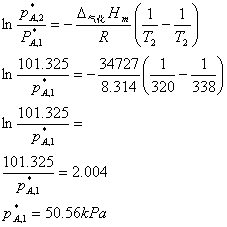
320K时,p总=101。325kPa
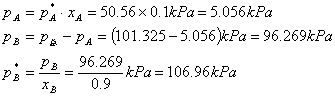
当xB=0。4时:
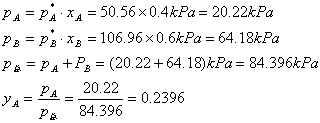
(2)当剩下最后一滴液体时,气相组成yA=0.4, yB=0.4
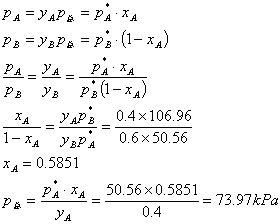
 12、右图为二组分完全不互溶的气-液平衡相图。 P=p0
12、右图为二组分完全不互溶的气-液平衡相图。 P=p0
(1)(1) 写出c、d、e三点的共存的相数和相态;
(2)(2) 求温度为70℃时A的饱和蒸气压;
(3)(3) 求A的蒸发热DvapHmÆ(假设与T无关);
(4)(4) 求温度为50℃时B的饱和蒸气压;
(5)(5) 求B的蒸发热DvapHmÆ(假设与T无关)。
如上计算用公式表示。
解:(1)

(2)p总=pA*+pB= pA*+ yBp总
pA*= p总(1-yB)
(3)70℃时:pA*
98℃时:p0。
由克―克方程可计算A的蒸发热DvapHmÆ。
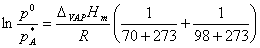
(4)50℃时AB均饱和:p0=pA*+pB*
pB*=yB(e)p0
(5)同理:由50℃时:pB*=yB(e)p0
115℃时:p0.
由由克―克方程可计算B的蒸发热DvapHmÆ。
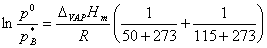
13.水和乙酸乙酯可部分互溶, 在37.55 ℃互相平衡的两液相中,水层相酯的浓度X酯=0.0146,另一相酯的浓度为X酯’=0.8390。已知该温度下纯水与酯的蒸汽压分别为P*水=6.40kPa, P*酯=15.47kPa,设拉乌尔定律对每相溶剂均适用,并且对水层相酯(X酯=0.0146)中的酯服从亨利定律,蒸汽可视为理想气体。
(1)(1) 计算与两液相平衡的汽相组成。
(2)(2) 今有水于乙酸乙酯的气液混合物共200mol,其中水与酯各100mol ,在37.55 ℃时达到平衡,已知气相量为40mol,试计算每个液相的物质的量(mol)。
(3)(3) 上述第2题所述系统保持37.55 ℃时,继续蒸发,(不取走蒸汽),哪一液相先消失,此气相量与液相量各为多少?
(4)(4) 求水层相酯(X酯=0.0146)的亨利常数。
解:(1) P总=PH2O*xH2O+P指*x酯’=6.40(1-0.0146)+15.46×0.8390
=19.286 kPa
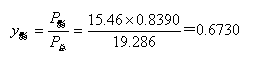
汽相组成
(2) 对酯进行物料恒算
100mol=40×0.673+n水相×0.0146+(160-n水相)×0.8390
得 n水相=74.187 mol
n酯相=160-74.187=85.812 mol
(3) 酯相先消失
由杠杆规则,n水相’(0.5-0.0146)=(200- n水相’)(0.673-0.5)
得 n水相’=52.55 mol
n气相=200-52.55=147.45 mol
(4) P指=kx酯, 已知 P酯=15.47×0.839=0.0146 k
∴ k=889 KPa
14.已知下列反应:
FeO(s)+CO(g)= Fe(s)+ CO2(g) ①
Fe3O4(s)+CO(g)= 3FeO(s)+ CO2(g) ②
的标准平衡常数分别为 ,它们与温度的关系如下:
,它们与温度的关系如下:

设反应的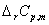 均为零。试求:
均为零。试求:
(1) (1)反应①和反应②的标准摩尔反应焓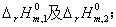
(2) (2)在什么温度下,Fe(s)、FeO(s)、Fe3O4(s)、CO2(g) 、CO(g)全可共存于平衡系
统中;
(3) (3)上述两反应达平衡后,若温度再上升时,系统中哪些物质可能消失?
解:(1)由题意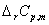 =0,可知:均与温度无关,可视为常数。
=0,可知:均与温度无关,可视为常数。
对同一反应,不同温度下的平衡常数可计算出标准摩尔反应焓:
对反应①: 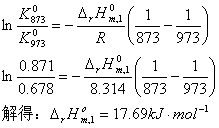
对反应②: 
(2)设两反应平衡共存时温度为T,且温度为T时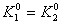 。
。
由 得;
得;
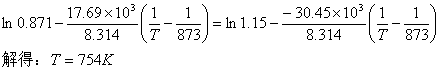
(4) (4)反应①为吸热反应,反应②为放热反应。上述两反应达平衡后,若温度再上升时,系统中FeO(s)可能消失。
第二篇:物理化学核心教程(第二版)思考题习题答案—第8章 电化学
第八章 电化学
一.基本要求
1.理解电化学中的一些基本概念,如原电池和电解池的异同点,电极的阴、阳、正、负的定义,离子导体的特点和Faraday 定律等。
2.掌握电导率、摩尔电导率的定义、计算、与浓度的关系及其主要应用等。了解强电解质稀溶液中,离子平均活度因子、离子平均活度和平均质量摩尔浓度的定义,掌握离子强度的概念和离子平均活度因子的理论计算。
3.了解可逆电极的类型和正确书写电池的书面表达式,会熟练地写出电极反应、电池反应,会计算电极电势和电池的电动势。
4.掌握电动势测定的一些重要应用,如:计算热力学函数的变化值,计算电池反应的标准平衡常数,求难溶盐的活度积和水解离平衡常数,求电解质的离子平均活度因子和测定溶液的pH等。
5.了解电解过程中的极化作用和电极上发生反应的先后次序,具备一些金属腐蚀和防腐的基本知识,了解化学电源的基本类型和发展趋势。
二.把握学习要点的建议
在学习电化学时,既要用到热力学原理,又要用到动力学原理,这里偏重热力学原理在电化学中的应用,而动力学原理的应用讲得较少,仅在电极的极化和超电势方面用到一点。
电解质溶液与非电解质溶液不同,电解质溶液中有离子存在,而正、负离子总是同时存在,使溶液保持电中性,所以要引入离子的平均活度、平均活度因子和平均质量摩尔浓度等概念。影响离子平均活度因子的因素有浓度和离子电荷等因素,而且离子电荷的影响更大,所以要引进离子强度的概念和Debye-Hückel极限定律。
电解质离子在传递性质中最基本的是离子的电迁移率,它决定了离子的迁移数和离子的摩尔电导率等。在理解电解质离子的迁移速率、电迁移率、迁移数、电导率、摩尔电导率等概念的基础上,需要了解电导测定的应用,要充分掌握电化学实用性的一面。
电化学在先行课中有的部分已学过,但要在电池的书面表示法、电极反应和电池反应的写法、电极电势的符号和电动势的计算方面进行规范,要全面采用国标所规定的符号,以便统一。会熟练地书写电极反应和电池反应是学好电化学的基础,以后在用Nernst方程计算电极电势和电池的电动势时才不会出错,才有可能利用正确的电动势的数值来计算其他物理量的变化值,如:计算热力学函数的变化值,电池反应的标准平衡常数,难溶盐的活度积,水的解离平衡常数和电解质的离子平均活度因子等。
学习电化学一方面要掌握电化学的基本原理,但更重要的是关注它的应用。对于可逆电池的实验可测量有:可逆电池的电动势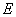 、标准可逆电动势
、标准可逆电动势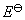 和电动势的温度系数
和电动势的温度系数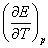 ,利用这些实验的测定值,可以用来:
,利用这些实验的测定值,可以用来:
(1) 计算热力学函数的变化量,如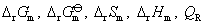 等。
等。
(2) 计算电池反应的标准平衡常数,难溶盐的活度积 和水的解离常数
和水的解离常数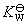 等。
等。
(3) 根据电动势数值的正、负,来判断化学反应自发进行的方向。
(4) 计算离子的平均活度因子 。
。
(5) 计算未知溶液的pH值。
(6) 进行电势滴定
(7) 绘制电势-pH图,并用于金属的防腐及湿法冶金等。
在这些应用中,难免要用到如何将一个化学反应设计成相应电池的问题,所以要了解如何将一些简单的化学反应设计成相应可逆电池的方法。
现在使用的标准电极电势表基本上都是氢标还原电极电势,所以关于氧化电极电势可以不作要求,免得在初学时发生混淆。
学习电解和极化的知识,主要是了解电化学的基本原理在电镀、电解、防腐和化学电源等工业上的应用,充分利用网络资源,都了解一些最新的绿色环保的新型化学电源,如氢-氧燃料电池和锂离子电池等。了解电解合成、电化学防腐等应用实例,拓宽知识面,提高学习兴趣,充分了解物理化学学科的实用性的一面。
三.思考题参考答案
1.什么是正极?什么是负极?两者有什么不同?什么是阴极?什么是阳极?两者有什么不同?
答:比较电池中两个电极的电极电势,电势高的电极称为正极,电势低的电极称为负极。电流总是从电势高的正极流向电势低的负极,电子的流向与电流的流向刚好相反,是从负极流向正极。
根据电极上进行的具体反应,发生还原作用的电极称为阴极,发生氧化作用的电极称为阳极。在原电池中,阳极因电势低,所以是负极。阴极因电势高,所以是正极;在电解池中,阳极就是正极,阴极就是负极。
2.电解质溶液的电导率随着电解质浓度的增加有什么变化?
答:要分强电解质和弱电解质两种情况来讨论。电解质溶液的电导率是指单位长度和单位截面积的离子导体所具有的电导。对于强电解质,如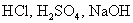 等,溶液浓度越大,参与导电的离子越多,则其电导率会随着浓度的增加而升高。但是,当浓度增加到一定程度后,由于电解质的解离度下降,再加上正、负离子之间的相互作用力增大,离子的迁移速率降低,所以电导率在达到一个最大值后,会随着浓度的升高反而下降。对于中性盐,如KCl等,由于受饱和溶解度的限制,在到达饱和浓度之前,电导率随着浓度的增加而升高。
等,溶液浓度越大,参与导电的离子越多,则其电导率会随着浓度的增加而升高。但是,当浓度增加到一定程度后,由于电解质的解离度下降,再加上正、负离子之间的相互作用力增大,离子的迁移速率降低,所以电导率在达到一个最大值后,会随着浓度的升高反而下降。对于中性盐,如KCl等,由于受饱和溶解度的限制,在到达饱和浓度之前,电导率随着浓度的增加而升高。
对于弱电解质溶液,因为在一定温度下,弱电解质的解离平衡常数有定值,所以在电解质的浓度增加的情况下,其离子的浓度还是基本不变,所以弱电解质溶液的电导率随浓度的变化不显著,一直处于比较低的状态。
3.电解质溶液的摩尔电导率随着电解质浓度的增加有什么变化?
答:要分强电解质和弱电解质两种情况来讨论。电解质溶液的摩尔电导率是指,将含有1 mol电解质的溶液,置于相距为单位距离的两个电极之间所具有的电导。由于溶液中导电物质的量已给定,都为1mol,所以,对于强电解质,当浓度降低时,正负离子之间的相互作用减弱,正、负离子的迁移速率加快,溶液的摩尔电导率会随之而升高。但不同的电解质,摩尔电导率随着浓度的降低而升高的程度也大不相同。当浓度降到足够低时,摩尔电导率与浓度之间呈线性关系,可用公式表示为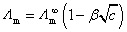 。所以强电解质的无限稀释的摩尔电导率可以用外推到
。所以强电解质的无限稀释的摩尔电导率可以用外推到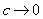 得到。
得到。
对于弱电解质溶液,因为在一定温度下,弱电解质的解离平衡常数有定值,在电解质的浓度下降的情况下,其离子的浓度基本不变,所以弱电解质溶液的摩尔电导率在一般浓度下,随浓度的变化不显著,一直处于比较低的状态。直到溶液的浓度很稀薄时,由于正负离子之间的相互作用减弱,摩尔电导率随着浓度的降低开始升高,但不成线性关系,当溶液很稀很稀时,摩尔电导率随着浓度的降低迅速升高,到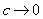 时,弱电解质溶液的离子无限稀释的摩尔电导率与强电解质的一样。所以弱电解质的无限稀释的摩尔电导率可以用离子的无限稀释的摩尔电导率的加和得到,即
时,弱电解质溶液的离子无限稀释的摩尔电导率与强电解质的一样。所以弱电解质的无限稀释的摩尔电导率可以用离子的无限稀释的摩尔电导率的加和得到,即 。
。
4.在温度、浓度和电场梯度都相同的情况下,氯化氢、氯化钾、氯化钠三种溶液中,氯离子的运动速度是否相同?氯离子的迁移数是否相同?
答:因为温度、浓度和电场梯度都相同,所以三种溶液中氯离子的运动速度是基本相同的,但氯离子的迁移数不可能相同。迁移数是指离子迁移电量的分数,因为氢离子、钾离子、钠离子的运动速度不同,迁移电量的能力不同,所以相应的氯离子的迁移数也就不同。
5.为什么氢离子和氢氧根离子的电迁移率和摩尔电导率的数值比同类离子要大得多?
答: 因为氢离子和氢氧根离子传导电流的方式与其它离子不同,它们是依靠氢键来传递的,所以特别快。它们传导电流时,不是靠离子本身的迁移,而是依靠氢键和水分子的翻转来传导电荷的。如果在非水溶液中,氢离子和氢氧根离子就没有这个优势。
6.强电解质如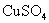 ,
,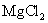 等,在其溶液的浓度不是太大的情况下,电解质的摩尔电导率与它的离子摩尔电导率之间是什么关系?
等,在其溶液的浓度不是太大的情况下,电解质的摩尔电导率与它的离子摩尔电导率之间是什么关系?
答:在溶液不太浓时,可以近似认为强电解质是完全解离的,其摩尔电导率就等于离子摩尔电导率的加和。但对于组成离子的电价数大于1,特别是在正、负离子的电价不对称时,在选取基本单元时要注意使粒子的荷电量相同,若粒子的荷电量不同时,要在前面乘以因子,使等式双方相等。现用以下例子来表明它们之间的关系:
对于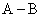 型的对称电解质,它们之间的关系比较简单,如
型的对称电解质,它们之间的关系比较简单,如
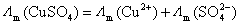
或 
对于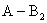 型的不对称电解质,由于正负离子的电价数不同,要注意选取荷电量相同的粒子作为基本单元,若荷电量不同,要在前面乘以因子,如
型的不对称电解质,由于正负离子的电价数不同,要注意选取荷电量相同的粒子作为基本单元,若荷电量不同,要在前面乘以因子,如
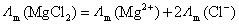
或 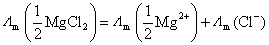
7.在电解质溶液中,如果有i 种离子存在,则溶液的总电导应该用如下的哪个计算式计算?

答:应该用(1)式计算。因为溶液的总电导等于各个离子电导的加和,即
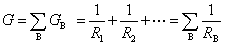
在溶液中,离子是以并联形式存在的,而不是以串联形式存在的,总的电阻不可能等于所有离子电阻的加和。
8.标准电极电势是否就等于电极与周围活度为1的电解质溶液之间的电势差?
答:不是。由于电极表面性质比较复杂,电极与周围电解质溶液之间的真实电势差是无法测量的。现在把处于标准状态下的电极(即待测电极)与标准氢电极组成电池,将待测电极作还原极(即正极),并规定标准氢电极的电极电势为零,这样测出的电池电动势就作为待测电极的电极电势,称为标准氢标还原电极电势,简称为标准电极电势,用符号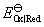 表示。
表示。
9.为什么标准电极电势的值有正有负?
答:因为规定了用还原电极电势,待测电极与氢电极组成电池时,待测电极放在阴极的位置,令它发生还原反应。但是比氢活泼的金属与氢电极组成电池时,实际的电池反应是金属氧化,氢离子还原,也就是说电池的书面表示式是非自发电池,电池反应是非自发反应,电动势小于零,所以电极电势为负值。如果是不如氢活泼的金属,则与氢电极组成的电池是自发电池,电极电势为正值。
10.某电池反应可以写成如下两种形式,则所计算出的电动势E,标准摩尔Gibbs自由能变化值和标准平衡常数的数值是否相同?
(1) 
(2) 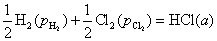
答:电动势E是电池的性质,不管电池反应中电子的计量系数是多少,电动势E总是相同的。如果从计算电池电动势的Nernst方程看,
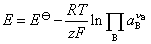
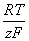 项分母中的
项分母中的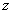 与
与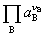 项中的指数
项中的指数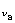 之间,有固定的比例关系,所以电动势E有定值,即
之间,有固定的比例关系,所以电动势E有定值,即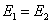 。
。
但是摩尔Gibbs自由能的变化值和标准平衡常数值却不同, 中的下标“m”是指反应进度为1 mol时的Gibbs自由能变化值,若化学方程式中的计量系数成倍数的关系,则当反应进度都等于1 mol时,
中的下标“m”是指反应进度为1 mol时的Gibbs自由能变化值,若化学方程式中的计量系数成倍数的关系,则当反应进度都等于1 mol时, 的值也成倍数的关系,即
的值也成倍数的关系,即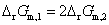 。如果电池都处于标准状态,则标准摩尔Gibbs自由能变化值的关系也是
。如果电池都处于标准状态,则标准摩尔Gibbs自由能变化值的关系也是 。
。
标准平衡常数与标准Gibbs自由能的变化值之间的关系为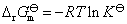 ,
,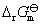 的数值成倍数的关系,则
的数值成倍数的关系,则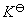 的数值就成指数的关系,即
的数值就成指数的关系,即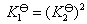 。
。
11.如果规定标准氢电极的电极电势为1 V,则各可逆电极的标准氢标还原电极电势的值有什么变化?电池的电动势有什么变化?
答:由于单个电极的电极电势无法测量,人们不得不采用相对的电极电势。目前国际上绝大多数采用的是氢标还原电极电势,即规定标准氢电极的电极电势为0 V,将待测电极作阴极(还原极),这样组成的电池的电动势就作为待测电极的标准还原电极电势 ,即
,即
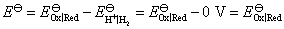
如果规定标准氢电极的电极电势为1 V,组成电池的电动势应是个定值,即实验测定的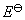 不变,那
不变,那
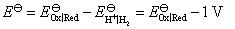
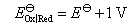
即各电极的标准还原电极电势值也都增加1 V。
电池的电动势是两个电极的电极电势之差,所有的电极电势都增加1 V,电动势的值不会改变,这就是为什么要取共同标准的原因。
12.如何用电化学的方法,测定 的标准摩尔生成Gibbs自由能
的标准摩尔生成Gibbs自由能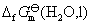 ?
?
答: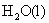 的生成反应为
的生成反应为
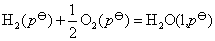
要设计一个电池,使电池反应与之相同。方程式中,显然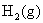 是被氧化的,将氢电极放在电池的左边作阳极,
是被氧化的,将氢电极放在电池的左边作阳极,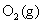 是被还原的,将氧电极放在电池右边作阴极,这是一个氢-氧燃料电池。由于氢-氧燃料电池的电动势与电解质溶液的pH没有关系,所以两个电极中间的介质在pH等于
是被还原的,将氧电极放在电池右边作阴极,这是一个氢-氧燃料电池。由于氢-氧燃料电池的电动势与电解质溶液的pH没有关系,所以两个电极中间的介质在pH等于 之间都可以,只要保持
之间都可以,只要保持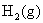 和
和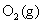 的压力都是标准压力即可。所以设计的电池为
的压力都是标准压力即可。所以设计的电池为

这个电池的反应就是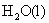 的生成反应,测定电池的标准可逆电动势
的生成反应,测定电池的标准可逆电动势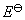 (或从标准电极电势表,查阅电极的标准电极电势,进行计算得到),就可以计算
(或从标准电极电势表,查阅电极的标准电极电势,进行计算得到),就可以计算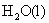 的标准摩尔生成Gibbs自由能
的标准摩尔生成Gibbs自由能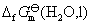
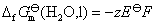
13.设计合适的电池,计算 的溶度(活度)积常数
的溶度(活度)积常数 。
。
答: 的解离反应为
的解离反应为
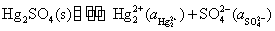
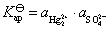
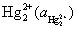 是从第一类电极中来的,是由
是从第一类电极中来的,是由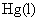 氧化而来的,所以用
氧化而来的,所以用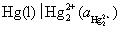 电极作阳极,再用一个难溶盐电极
电极作阳极,再用一个难溶盐电极 作阴极,因为
作阴极,因为 在还原时会放出
在还原时会放出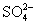 。
。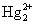 和
和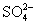 不能共存在一个容器内,中间要用盐桥隔开,所以设计的电池为
不能共存在一个容器内,中间要用盐桥隔开,所以设计的电池为
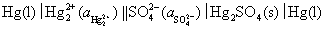
该电池的净反应与 的解离反应一致(读者可以自己检验一下)。
的解离反应一致(读者可以自己检验一下)。
从标准电极电势表,查得两个电极的电极电势,得到电池的标准电动势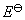 ,或用实验测定该电池处于标准态时的标准电动势
,或用实验测定该电池处于标准态时的标准电动势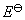 ,就可以计算难溶盐的活度积常数
,就可以计算难溶盐的活度积常数
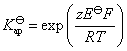
14.为什么实际分解电压总要比理论分解电压高?
答:实际分解电压要克服三种阻力:
(1)原电池的可逆电动势,这数值通常称为理论分解电压,其绝对值用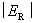 表示;
表示;
(2)由于两个电极上发生极化而产生的超电势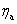 和
和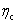 ,通常称为不可逆电动势;
,通常称为不可逆电动势;
(3)克服电池内阻必须消耗的电位降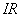 。所以实际分解电压为
。所以实际分解电压为
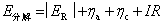
这样,实际分解电压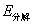 一定大于理论分解电压
一定大于理论分解电压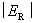 。
。
15.在电解池和原电池中,极化曲线有何异同点?
答:它们的相同点是:无论是在原电池还是在电解池中,随着电流密度的增加,阳极的实际析出电势不断变大,阳极的极化曲线总是向电势增大的方向移动;阴极的实际析出电势不断变小,阴极的极化曲线总是向电势减小的方向移动。
所不同的是,在电解池中,由于超电势的存在使实际分解电压变大,随着电流密度的增加,实际消耗的电能也不断增多。而在原电池中,由于超电势的存在,使电池的不可逆电动势小于可逆电动势,随着电流密度的增加,电池的不可逆电动势不断下降,对环境作电功的能力也下降。
16.将一根均匀的铁棒,部分插入水中,部分露在空气中。经若干时间后,哪一部分腐蚀最严重?为什么?
答:在靠近水面的部分腐蚀最严重。因为在水下部分的铁棒,虽然有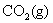 和
和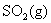 等酸性氧化物溶于水中,使水略带酸性,但H+ 离子的浓度还是很低的,发生析氢腐蚀的趋势不大;铁棒露在空气中的部分,虽然与氧气接触,但无电解质溶液,构成微电池的机会较小;而在靠近水面的部分,既有氧气,又有微酸性的电解质溶液,所以很容易构成微电池,发生耗氧腐蚀,这样形成的原电池的电动势比在水中的析氢腐蚀的电动势大,因而这部分腐蚀最严重。
等酸性氧化物溶于水中,使水略带酸性,但H+ 离子的浓度还是很低的,发生析氢腐蚀的趋势不大;铁棒露在空气中的部分,虽然与氧气接触,但无电解质溶液,构成微电池的机会较小;而在靠近水面的部分,既有氧气,又有微酸性的电解质溶液,所以很容易构成微电池,发生耗氧腐蚀,这样形成的原电池的电动势比在水中的析氢腐蚀的电动势大,因而这部分腐蚀最严重。
17.以金属铂为电极,电解Na2SO4水溶液。在两极附近的溶液中,各滴加数滴石蕊试液,观察在电解过程中,两极区溶液颜色有何变化?为什么?
答:这实际是一个电解水的过程,硫酸钠仅仅起了导电的作用。电解时,在阳极上放出氧气,阳极附近氢离子的浓度变大,使石蕊试液呈红色;在阴极上析出氢气,阴极附近氢氧根离子的浓度变大,使石蕊试液呈蓝色。
18.为了防止铁生锈,分别电镀上一层锌和一层锡,两者防腐的效果是否一样?
答:在镀层没有被破坏之前,两种防腐的效果是一样的,镀层都起了将铁与环境中的酸性气体和水隔离的目的,防止微电池的形成,防止了铁被电化腐蚀。但是镀层一旦有破损,则两者的防腐效果就大不相同。
镀锡铁俗称马口铁,锡不如铁活泼。若将锡与铁组成原电池,则锡作阴极,称为阴极保护层,而铁作阳极,这样铁被腐蚀得更快。
镀锌铁俗称白铁,锌比铁活泼,组成原电池时,锌作阳极,称为阳极保护层,锌被氧化,而铁作阴极,仍不会被腐蚀。
19.在氯碱工业中,电解NaCl的浓溶液,以获得氢气、氯气和氢氧化钠等化工原料。为什么电解时要用石墨作阳极?
答:若不考虑超电势的影响,在电解NaCl的水溶液时,根据电极电势的大小,在阳极上首先析出的是氧气,而不是氯气。由于氯气的工业价值比氧气高,所以利用氧气在石墨上析出时有很大的超电势,而氯气在石墨上析出的超电势很小,所以用石墨作阳极,在阳极上首先析出的是氯气,而不是氧气,可以利用氯气作为化工原料。
20.氢-氧燃料电池在酸、碱性不同的介质中,它们的电池反应是否不同?在气体压力相同时,电池的电动势是否相同?
答:氢、氧燃料电池的电解质溶液可以是酸性,也可以是碱性,pH在1~14的范围内,它们的电极反应虽不相同,但电池的净反应相同。在气体压力都等于标准压力时,其标准电动势都等于是1.229 V。具体反应式和计算式如下:
(1) 假定是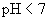 的酸性溶液
的酸性溶液
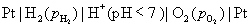
负极,氧化 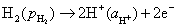
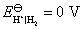
正极,还原 
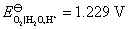
电池净反应 (1) 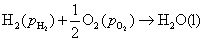
当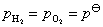 时,
时,
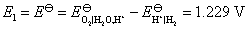
(2) 假定是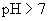 的碱性溶液
的碱性溶液
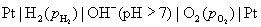
负极,氧化 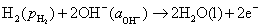

正极,还原 
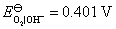
电池净反应 (2) 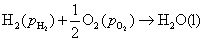
当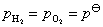 时,
时,
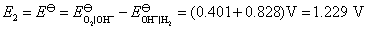
四.概念题参考答案
1.按物质导电方式的不同而提出的离子型导体,下述对它特点的描述,哪一点是不正确的? ( )
(A) 其电阻随温度的升高而增大 (B)其电阻随温度的升高而减小
(C)其导电的原因是离子的存在 (D) 当电流通过时在电极上有化学反应发生
答:(A)。对于离型子导体,在温度升高时,离子的水合程度下降,溶液的黏度下降,电阻是变小的。
2.使2000 A的电流通过一个铜电解器,在1 h 内,能得到铜的质量是 ( )
(A) 10 g (B) 100 g
(C) 500 g (D) 2 369 g
答:(D)。用Faraday 定律计算可得
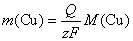
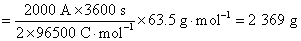
3.在298 K时,当 H2SO4溶液的浓度从 0.01 mol·kg-1 增加到 0.1 mol·kg-1时,其电导率k 和摩尔电导率Lm的变化分别为 ( )
(A) k减小 , Lm增加 (B) k增加 , Lm增加
(C) k减小 , Lm减小 (D) k增加 , Lm减小
答:(D)。强电解质溶液的电导率,随溶液浓度的增加而增加,因为电导率只规定了电解质溶液的体积,是单位立方体,浓度大了,导电离子多了,电导率当然要增加。但是摩尔电导率只规定了电解质的量是1 mol,电极间的距离是单位距离,但没有固定溶液的体积,所以随溶液浓度的增加,溶液体积变小,离子间相互作用增加,因而摩尔电导率减小。
4.用同一电导池,分别测定浓度为 (1) 0.01 mol·kg-1和 (2) 0.1 mol·kg-1的两个电解质溶液,其电阻分别为 1000 W 和 500 W,则 (1) 与 (2) 的摩尔电导率之比为
( )
(A) 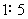 (B)
(B) 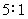
(C) 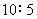 (D)
(D) 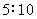
答: (B)。根据摩尔电导率的定义, ,
,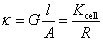 ,
,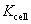 称为电导池常数,同一电导池的电导池常数相同。所以电导率之比就等于电阻的反比,代入摩尔电导率的定义式,得
称为电导池常数,同一电导池的电导池常数相同。所以电导率之比就等于电阻的反比,代入摩尔电导率的定义式,得

5.有下面四种电解质溶液,浓度均为0.01 mol·dm-3,现已按它们的摩尔电导率Lm的值,由大到小排了次序。请判定下面正确的是 ( )
(A) NaCl > KCl > KOH > HCl (B) HCl > KOH > KCl > NaCl
(C) HCl > NaCl > KCl > KOH (D) HCl > KOH > NaCl > KCl
答:(B) 。这4种都是1-1价的强电解质,当溶液的浓度相同时,氢离子摩尔电导率最大,其次是氢氧根离子,因为氢离子和氢氧根离子是通过氢键导电的。钾离子的离子半径虽然要比钠离子的大,但是钾离子的水合程度小,所以钾离子的摩尔电导率还是比钠离子的大。
6.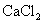 的摩尔电导率与其离子的摩尔电导率之间的关系是 ( )
的摩尔电导率与其离子的摩尔电导率之间的关系是 ( )
(A) 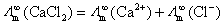
(B) 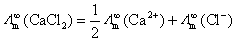
(C) 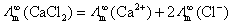 (D)
(D)
答: (C)。电解质的摩尔电导率与离子摩尔电导率之间关系的通式是
在表示多价电解质的摩尔电导率时,为了防止混淆,最好在摩尔电导率的后面加个括号,写明所取的基本质点,防止误解。如 ,两者显然是倍数的关系。
,两者显然是倍数的关系。
7.有4个浓度都是 0.01 mol·kg-1 的电解质溶液,其中离子平均活度因子最大
的是 ( )
(A) KCl (B) CaCl2
(C) Na2SO4 (D) AlCl3
答:(A) 。按Debye-Hückel极限定律,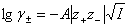 ,离子强度越大,平均活度因子越小。这里KCl的离子强度最小,所以它的平均活度因子最大。
,离子强度越大,平均活度因子越小。这里KCl的离子强度最小,所以它的平均活度因子最大。
8.下列电池中,哪个电池的电动势与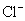 的活度无关? ( )
的活度无关? ( )
(A) Zn│ZnCl2(aq)│Cl2(g)│Pt
(B) Zn│ZnCl2(aq)‖KCl(aq)│AgCl(s)│Ag
(C) Ag│AgCl(s)│KCl(aq)│Cl2(g)│Pt
(D) Hg│Hg2Cl2(s)│KCl(aq)‖AgNO3(aq)│Ag
答:(C)。原则上应写出各个电池的反应,再决定电池的电动势与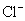 是否有关,这显然要化去不少时间。快速判断的方法是看电极反应,若正、负极的反应中都有
是否有关,这显然要化去不少时间。快速判断的方法是看电极反应,若正、负极的反应中都有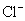 ,两个电极反应中的
,两个电极反应中的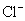 刚好可以消去,这样
刚好可以消去,这样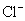 的活度与电池的电动势就无关,所以只有(C)符合条件。(A)和(D)只有一个电极反应有
的活度与电池的电动势就无关,所以只有(C)符合条件。(A)和(D)只有一个电极反应有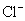 ,不能对消。(B)中虽然用了ZnCl2(aq),但这是一类电极,电极反应中不会出现
,不能对消。(B)中虽然用了ZnCl2(aq),但这是一类电极,电极反应中不会出现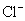 ,所以也不能对消。
,所以也不能对消。
9.用对消法(补偿法)测定可逆电池的电动势,主要是为了 ( )
(A) 消除电极上的副反应 (B) 减少标准电池的损耗
(C) 在可逆情况下测定电池电动势 (D) 简便易行
答:(C)。在用对消法测定电池的电动势时,外加了一个与电池的电动势大小相等、方向相反的工作电源,相当于外电路的电阻趋于无穷大,忽略电池内部的电阻,所得两个电极之间的电位降,可以近似作为电池的电动势。在测定时电路中几乎无电流通过,使极化现象可以忽略不计,所得的电动势可以近似作为可逆电池的电动势。
10.若算得可逆电池的电动势为负值,表示此电池反应的方向是 ( )
(A) 正向进行 (B) 逆向进行
(C) 不可能进行 (D) 反应方向不确定
答:(B)。电池电动势为负值,表明该电池是非自发电池,不能正向进行,而逆向反应是自发的。这种情况只能出现在书面表示中,就是将电池的正、负极排反了。在实验中若将正、负极接反了,就不可能形成对消线路,也就测不到电动势,能测到的电动势都是正值。
11.某电池的电池反应为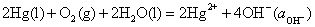 ,在等温、等压下,当电池反应达平衡时,电池的电动势
,在等温、等压下,当电池反应达平衡时,电池的电动势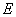 的值必然是 ( )
的值必然是 ( )
(A) 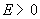 (B)
(B) 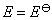
(C) 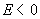 (D)
(D) 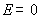
答: (D) 。在等温、等压下,电池反应达平衡时,Gibbs自由能的变化值为零,即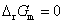 。因为
。因为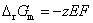 ,所以电动势E也必然等于零。
,所以电动势E也必然等于零。
12.某电池在298 K、标准压力下可逆放电的同时,放出 100 J 的热量,则该电池反应的焓变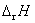 为: ( )
为: ( )
(A) 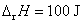 (B)
(B) 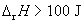
(C) 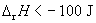 (D)
(D) 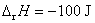
答:(C) 。因为在等温时,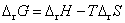 ,可逆放电时放出的热量为
,可逆放电时放出的热量为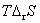 ,即
,即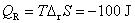 ,
,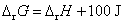 。电池能放电,说明是自发电池,
。电池能放电,说明是自发电池,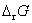 必定小于零,所以
必定小于零,所以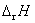 必须小于
必须小于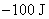 。
。
13.在等温、等压下,电池以可逆方式对外作电功时的热效应QR等于 ( )
(A) 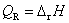 (B)
(B) 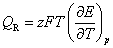
(C) 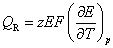 (D)
(D) 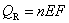
答:(B)。因为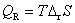 ,
, 所以只有(B)是正确的。平时必须熟练记住电化学与热力学的各种联系公式,才能用电动势测定方法计算热力学函数的变化值。
所以只有(B)是正确的。平时必须熟练记住电化学与热力学的各种联系公式,才能用电动势测定方法计算热力学函数的变化值。
14.有两个电池,电动势分别为E1和E2:
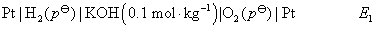
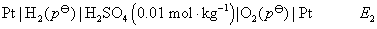
在相同温度下,两个电动势大小的关系为 ( )
(A) E1< E2 (B) E1> E2
(C) E1= E2 (D) 不能确定
答:(C) 。氢-氧燃料电池的净反应为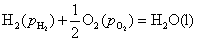 ,只要两种气体的压力相同,电动势就相等,与溶液的pH值无关,因为电动势的计算公式中没有离子浓度项。若两种气体的压力都等于标准压力,则pH在
,只要两种气体的压力相同,电动势就相等,与溶液的pH值无关,因为电动势的计算公式中没有离子浓度项。若两种气体的压力都等于标准压力,则pH在 的范围内,电动势都等于
的范围内,电动势都等于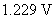 。
。
15.有如下两个电池:
(1) 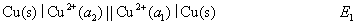
(2) 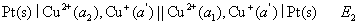
两个电池的反应都可以表示为 ,已知
,已知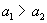 ,则两个电池电动势E1与E2之间的关系为 ( )
,则两个电池电动势E1与E2之间的关系为 ( )
(A) 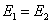 (B)
(B) 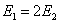
(C) 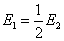 (D) 无法比较
(D) 无法比较
答: (C) 。两个电池的电池反应相同,Gibbs 自由能的变化值也相同,因为Gibbs 自由能是状态函数。但是电子得失不同,(1)中有两个电子得失,而(2)中只有一个电子得失,所以电子得失多的电动势反而小。即
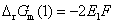 ,
, 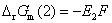 ,
,
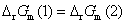 ,
, 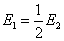 。
。
如果从电极的结构看,这两个电池的电极都不同,所以电池的电动势也不可能相同。电动势之间的关系必须在写出电极反应之后才能判断。
16.298 K时有如下两个电池
(1)
(2)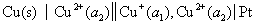
两个电池的电池反应都可写成  ,则两个电池的
,则两个电池的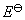 和
和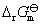 之间的关系为 ( )
之间的关系为 ( )
(A)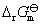 和
和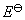 都相同 (B)
都相同 (B)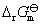 相同,
相同,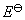 不同
不同
(C) 和
和 都不同 (D)
都不同 (D) 不同,
不同, 相同
相同
答:(B)。因为Gibbs自由能是状态函数,具有容量性质,反应方程式相同,则反应的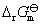 也相同。但两个反应的电子得失不同,所以根据式
也相同。但两个反应的电子得失不同,所以根据式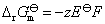 ,电池的标准电动势当然不相同,显然
,电池的标准电动势当然不相同,显然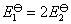 。还有一种判断方式是,看一下电池的表示式,两个电池的阳极不相同,其电动势也不可能相同。
。还有一种判断方式是,看一下电池的表示式,两个电池的阳极不相同,其电动势也不可能相同。
17. 以石墨为阳极,电解浓度为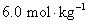 的NaCl水溶液。已知:
的NaCl水溶液。已知: ,
,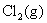 在石墨上的超电势
在石墨上的超电势 ,
, ,
,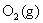 在石墨上的超电势
在石墨上的超电势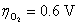 ,设活度因子均为1。在电解时阳极上首先析出 ( )
,设活度因子均为1。在电解时阳极上首先析出 ( )
(A) 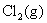 (B)
(B) 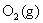
(C) Cl2与 O2的混合气体 (D) 无气体析出
答: (A) 。在阳极上两者的析出电势分别为:


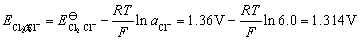
析出氯气的电极电势比析出氧气的电极电势低,所以在阳极首先析出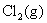 。
。
在氯碱工业上,用C(石墨)作为阳极,就是因为氧气在石墨上析出时有超电势,而氯气没有,从而电解NaCl 浓的水溶液,在阳极可以获得氯气作为化工原料。
18.电解时,在阳极上首先发生氧化作用的是 ( )
(A) 标准还原电极电势最大者
(B) 标准还原电极电势最小者
(C) 考虑极化后,实际上的不可逆还原电极电势最大者
(D) 考虑极化后,实际上的不可逆还原电极电势最小者
答:(D)。实际析出电极电势最小者,首先在阳极上氧化,因而最先析出。
五.习题解析
1.用惰性电极电解CuSO4的水溶液,通入1930 C的电量,在阴极有0.018 mol的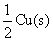 沉积出来,计算同时在阴极上产生的
沉积出来,计算同时在阴极上产生的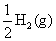 的物质的量?
的物质的量?
解:通入电量的物质的量为:

根据Faraday 定律,在阴极上析出物质(荷1价电荷)的物质的量为 。现在析出的
。现在析出的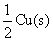 为0.018 mol,则剩余析出的就是
为0.018 mol,则剩余析出的就是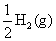


2.在300 K和100 kPa压力下,用惰性电极电解水以制备氢气。设所用直流电的强度为5 A,设电流效率为100%。如制备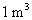 的
的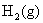 ,需通电多少时间?如制备
,需通电多少时间?如制备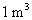 的
的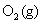 ,需通电多少时间?已知在该温度下水的饱和蒸气压为3 565 Pa。
,需通电多少时间?已知在该温度下水的饱和蒸气压为3 565 Pa。
解: 在放出的气体中饱和了水蒸气,首先要求出在该实验条件下放出气体的分压,然后计算其物质的量,再用Faraday定律计算所需的电量及通电的时间。由于还原相同体积的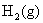 和
和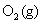 所需的电量不同,所以两者所需的通电时间也不同,通电时间与所需的电量成正比。
所需的电量不同,所以两者所需的通电时间也不同,通电时间与所需的电量成正比。
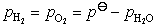
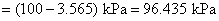
在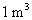 中所含气体的物质的量为
中所含气体的物质的量为

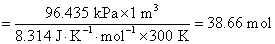
根据Faraday定律

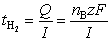
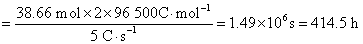
同理 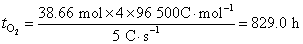
3.在用界面移动法测定 离子的电迁移率(淌度)时,在历时750 s后,界面移动了4.0 cm。已知迁移管两极之间的距离为9.6 cm,电位差为16.0 V,设电场是均匀的。试求
离子的电迁移率(淌度)时,在历时750 s后,界面移动了4.0 cm。已知迁移管两极之间的距离为9.6 cm,电位差为16.0 V,设电场是均匀的。试求 离子的电迁移率。
离子的电迁移率。
解: 离子的迁移速率
离子的迁移速率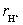 与电迁移率
与电迁移率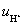 之间的关系为
之间的关系为
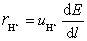
因假设电场是均匀的,即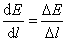 ,所以
,所以
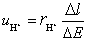
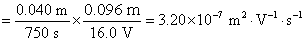
4.在某电导池内,装有两个直径为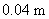 并相互平行的圆形银电极,电极之间的距离为
并相互平行的圆形银电极,电极之间的距离为 。若在电导池内盛满浓度为
。若在电导池内盛满浓度为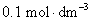 的
的 溶液,施以20 V的电压,则所得电流强度为0.1976 A。试计算该电导池的电导池常数、
溶液,施以20 V的电压,则所得电流强度为0.1976 A。试计算该电导池的电导池常数、 溶液的电导、电导率和摩尔电导率。
溶液的电导、电导率和摩尔电导率。
解:根据所要计算物理量的定义式,即可以进行计算,但都要严格使用SI的基本单位(即 ),才能得到正确的结果。
),才能得到正确的结果。
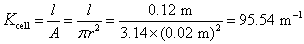
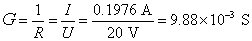
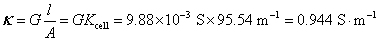
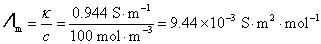
5.在298 K时,用同一电导池测得浓度为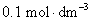 的KCl水溶液的电阻为24.69 W,浓度为
的KCl水溶液的电阻为24.69 W,浓度为 的乙酸(HAc)水溶液的电阻为1982 W。试计算该HAc水溶液的解离平衡常数。已知:298 K时,
的乙酸(HAc)水溶液的电阻为1982 W。试计算该HAc水溶液的解离平衡常数。已知:298 K时,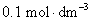 的KCl水溶液的电导率为
的KCl水溶液的电导率为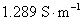 ,
,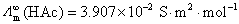 。
。
解:用电导测定的方法计算弱电解质溶液的解离平衡常数,要使用Ostwald稀释定律,即计算达到解离平衡时HAc的摩尔电导率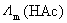 ,将它代入Ostwald稀释定律公式就能计算得到解离平衡常数的值。也可以用摩尔电导率
,将它代入Ostwald稀释定律公式就能计算得到解离平衡常数的值。也可以用摩尔电导率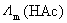 先计算出HAc的解离度
先计算出HAc的解离度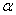 ,
,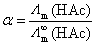 ,代入解离平衡常数的计算公式也可以。
,代入解离平衡常数的计算公式也可以。
要计算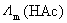 ,必须先计算HAc水溶液的电导率。电导的测定实际是测定电阻,但计算时要用到电导池中电极的面积和电极间的距离,这又是不容易测定的数值,因为电极的表面一般都是镀了铂黑的。常用的方法是用已知电导率的标准KCl水溶液先测定电导池常数,然后用该电导池测定未知溶液的电阻,就可得到未知溶液的电导率数值。
,必须先计算HAc水溶液的电导率。电导的测定实际是测定电阻,但计算时要用到电导池中电极的面积和电极间的距离,这又是不容易测定的数值,因为电极的表面一般都是镀了铂黑的。常用的方法是用已知电导率的标准KCl水溶液先测定电导池常数,然后用该电导池测定未知溶液的电阻,就可得到未知溶液的电导率数值。
用已知电导率的KCl溶液测定电导池的电阻,主要是测定该电导池的电导池常数,
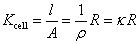
相同的电导池,电导池常数也相同,则电导率之比就等于电阻的反比,即
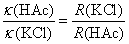
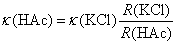
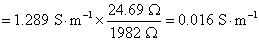
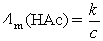
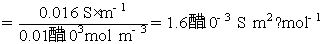
代入Ostwald稀释定律的公式,可得到解离平衡常数
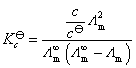

也可以先计算HAc的解离度
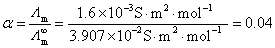
HAc的解离平衡为
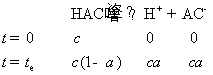
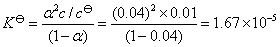
6.在298 K时,测得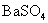 饱和水溶液的电导率为
饱和水溶液的电导率为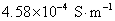 ,求
,求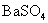 的活度积常数
的活度积常数 。已知所用溶剂纯水的电导率为
。已知所用溶剂纯水的电导率为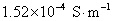 ,离子的无限稀释摩尔电导率
,离子的无限稀释摩尔电导率 ,
,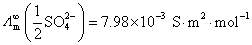 。
。
设所有的活度因子均为1。
解:用电导测定法计算难溶盐的活度积 ,首先要计算其饱和水溶液的浓度
,首先要计算其饱和水溶液的浓度 ,这就要用到摩尔电导率的计算公式,
,这就要用到摩尔电导率的计算公式,
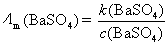
在BaSO4饱和水溶液的电导率中有水的贡献,因为BaSO4的溶解度很小,所以水的贡献就不能忽略。另外BaSO4的摩尔电导率可以近似等于无限稀释时的摩尔电导率。
方法1: 以BaSO4为单位,BaSO4的摩尔电导率为
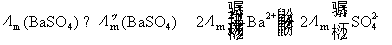
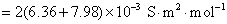
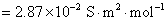
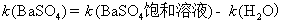
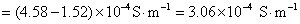
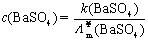
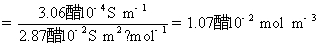

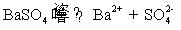
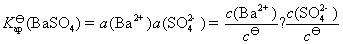
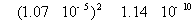
方法2:以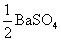 为单位,
为单位,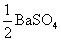 的摩尔电导率为
的摩尔电导率为
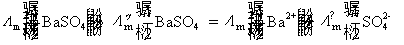

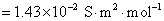
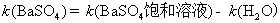
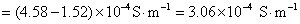
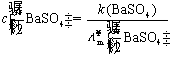
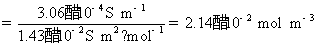
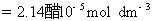
因为 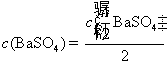
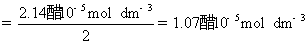
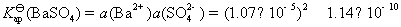
在解这类题目时容易犯的错误是:(1)浓度的单位问题,要注意 与
与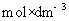 之间的换算。(2)离子摩尔电导率与电解质摩尔电导率之间的关系问题,要求的是
之间的换算。(2)离子摩尔电导率与电解质摩尔电导率之间的关系问题,要求的是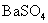 的
的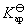 ,所以要计算
,所以要计算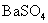 的浓度和摩尔电导率,若计算得到的是
的浓度和摩尔电导率,若计算得到的是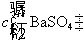 ,要换算成
,要换算成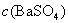 才行。
才行。
7.在标准压力和 时,已知纯水的电导率
时,已知纯水的电导率 ,水的密度
,水的密度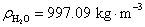 ,
, ,
,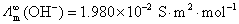 。计算纯水的解离度和离子活度积常数
。计算纯水的解离度和离子活度积常数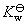 。
。
解:纯水是弱电解质,它的无限稀释摩尔电导率可以用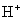 和
和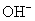 的无限稀释摩尔电导率的加和得到。它的物质的量浓度可以用密度除以摩尔质量得到。
的无限稀释摩尔电导率的加和得到。它的物质的量浓度可以用密度除以摩尔质量得到。

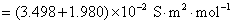
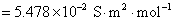


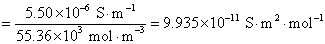


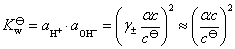
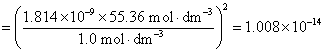
8.分别计算下列各溶液的离子强度。设所有电解质的质量摩尔浓度均为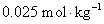 ,并假定这些电解质都能完全电离。①
,并假定这些电解质都能完全电离。①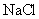 ;②
;②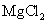 ;③
;③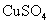 ;④
;④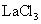 ;⑤
;⑤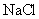 和
和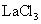 的混合溶液,质量摩尔浓度各为
的混合溶液,质量摩尔浓度各为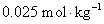 。
。
解:将各离子浓度代入离子强度的定义式计算即可。因为浓度都相同,从计算结果可以比较一下哪一种类型的电解质离子强度最大。离子强度的定义式为
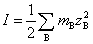
① 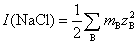
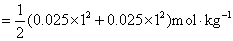
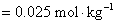
对于 价型的强电解质,离子强度就等于它的质量摩尔浓度。
价型的强电解质,离子强度就等于它的质量摩尔浓度。
② 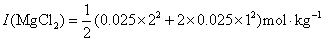
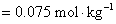
对于 或
或 价型的强电解质,离子强度是它质量摩尔浓度的三倍。
价型的强电解质,离子强度是它质量摩尔浓度的三倍。
③ 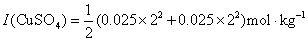
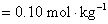
对于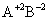 价型的强电解质,离子强度是它质量摩尔浓度的四倍。
价型的强电解质,离子强度是它质量摩尔浓度的四倍。
④ 
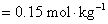
对于 或
或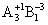 价型的强电解质,离子强度是它质量摩尔浓度的六倍。
价型的强电解质,离子强度是它质量摩尔浓度的六倍。
⑤ 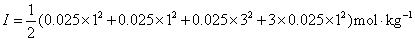

对于混合强电解质溶液,离子强度等于组成溶液的所有电解质的离子强度的加和。从计算结果可知, 或
或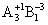 价型的强电解质的离子强度最大。
价型的强电解质的离子强度最大。
9.298 K 时,某溶液含CaCl2和ZnSO4的浓度均为 0.002 mol·kg-1。试用Debye-Hückel极限定律,计算ZnSO4的离子平均活度因子。已知:常数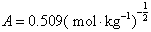 。
。
解:对于混合电解质溶液,在计算离子强度时,要把所有的离子都计算在内。但在计算离子平均活度因子时,只用到相关电解质离子电荷数。
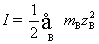
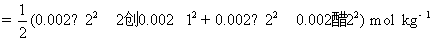

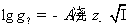

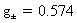
10.298 K时,当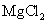 和
和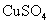 溶液的浓度都等于
溶液的浓度都等于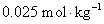 ,并假定它们能完全电离。试分别计算这两种溶液的
,并假定它们能完全电离。试分别计算这两种溶液的
(1)离子强度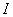 。
。
(2)离子平均质量摩尔浓度 。
。
(3)离子平均活度因子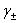 ,已知
,已知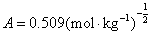 。
。
(4)电解质的离子平均活度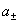 和电解质的活度
和电解质的活度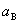 。
。
解 (1)离子强度根据第8题的简便的方法计算
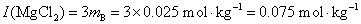
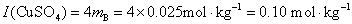
(2)根据平均质量摩尔浓度 的定义,
的定义,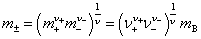

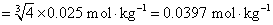
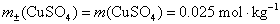
(3)利用Debye-H?ckel极限公式 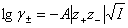 ,
,
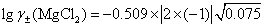
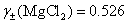
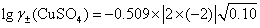
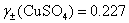
(4) 已知  ,
, 
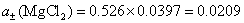
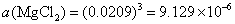
11.有下列电池,写出各电池的电极反应和电池反应
(1)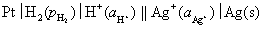
(2)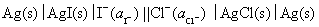
(3)
(4)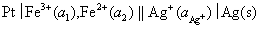
解:(1)负极 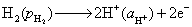
正极 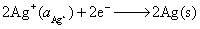
净反应 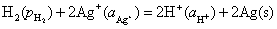
(2) 负极 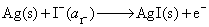
正极 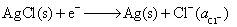
净反应 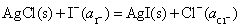
(3) 负极 
正极 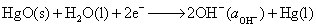
净反应 
(4) 负极 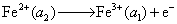
正极 
净反应 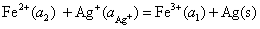
12. 试将下述化学反应设计成合适的电池
(1)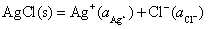
(2)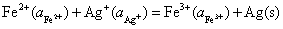
(3)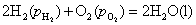
(4)
(5)
解 :(1)生成物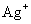 是由
是由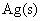 氧化而来的,所以电极
氧化而来的,所以电极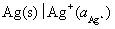 做阳极,
做阳极,
难溶盐电极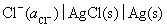 做阴极,所设计的电池为
做阴极,所设计的电池为
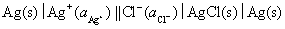
然后写出电极反应和电池反应进行验证。
负极 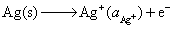
正极 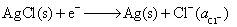
净反应 
说明设计的电池是正确的。同理,其余设计的电池为
(2) 
(3) 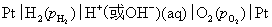
(4) 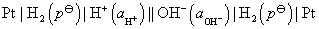
(5) 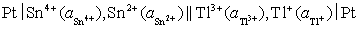
13.分别写出下列两个电池在作为原电池和电解池时的电池反应,并判断是否有可能成为可逆电池。
(1) Zn(s)│H2SO4(aq)│Cu(s)
(2) Pt│H2(p)│HCl(aq)│AgCl(s)│Ag
解:(1) 作为原电池时
负极,氧化 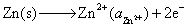 -
-
正极,还原 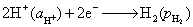
电池净反应为: 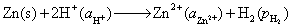
作为电解池时:在正极(即阳极)上,Cu(s)氧化,在负极(即阴极)上,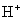 还原
还原
阳极,氧化 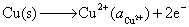
阴极,还原 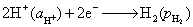
电解池的总反应为: 
同一个电池,在分别作为原电池和电解池时,电池反应不是互为逆反应,所以电池(1)不可能成为可逆电池。
(2) 作为原电池时的电池反应为
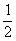 H2(g)+AgCl(s) → Ag(s)+HCl
H2(g)+AgCl(s) → Ag(s)+HCl
作为电解池时的电池反应为:
Ag(s)+HCl → 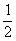 H2(g)+AgCl(s)
H2(g)+AgCl(s)
电池(2)的电池反应,在充、放电时是互为逆反应,所以电池(2)有可能成为可逆电池,只要在充、放电时的电流为无限小值。
14.在 298 K 时,有下述电池:
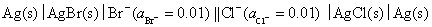
试计算电池的电动势E,并判断该电池反应能否自发进行?已知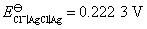 ,
,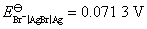 。
。
解: 首先写出电极反应和电池反应
负极,氧化 
正极,还原 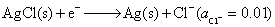
电池净反应: 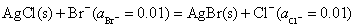
根据电池反应,利用Nernst 方程计算电池的电动势
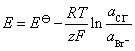

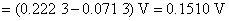
电池的电动势大于零,则电池为自发电池,反应的DrGm小于零,电池反应能自发进行。
15.反应 Zn(s) + CuSO4(a=1) ──→ Cu(s) + ZnSO4(a=1) 在电池中进行,在288 K时,测得电动势E = 1.0934 V,已知电池的温度系数 。
。
(1) 写出该反应所对应电池的书面表示式和电极反应。
(2) 求电池反应的 DrG ,DrS
,DrS ,DrH
,DrH 和 QR 。
和 QR 。
解:(1) 在反应式中,Zn(s)被氧化为ZnSO4,应作为阳极放在电池的左边,CuSO4还原为Cu(s),应作为阴极放在电池的右边,所以,反应所对应电池的书面表示式为:
Zn(s)│ZnSO4(a=1)‖CuSO4(a=1)│Cu(s)
电极反应为
负极,氧化 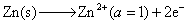
正极,还原 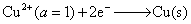
(2) 从化学反应式可以看出,电子的计量系数等于2,已知电池的电动势和温度系数的值,代入相应的计算式,就可以得到所求的热力学函数的变化值。因为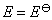 ,所以
,所以
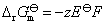

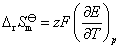
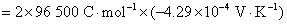
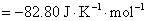
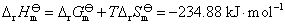
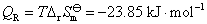
16.电池 的电动势与温度的关系为
的电动势与温度的关系为
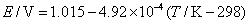
试计算,在298 K,电极反应的电子计量系数等于2时,电池反应的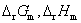 ,
,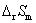 和可逆热效应
和可逆热效应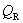 。
。
解: 因为已指定电极反应的电子计量系数等于2,如果没有指定,一定要先写出电池反应,计算与电池反应对应的、当反应进度为1 mol 时的热力学函数的变化值。已知电池的电动势与温度的关系式,则就可以得到在298 K时的电动势。将关系式对温度求微分,可以得到电动势的温度系数。
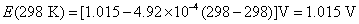
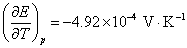
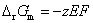
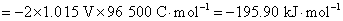
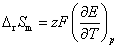
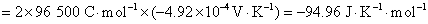
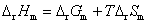
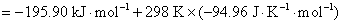
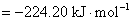
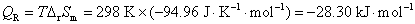
17.电池(1)Cu(s)│Cu+‖Cu+,Cu2+│Pt 和电池(2)Cu(s)│Cu2+‖Cu+,Cu2+│Pt 的电池反应均可简写作: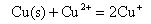 ,则此两个电池的DrG
,则此两个电池的DrG 和 E$ 的关系如何?
和 E$ 的关系如何?
解: 首先应该把两个电池的电极反应和电池反应写出来,
电池(1)
负极,氧化 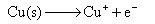
正极,还原 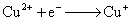
电池净反应 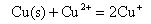
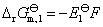
电池(2)
负极,氧化 
正极,还原 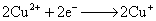
电池净反应 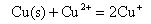
对于相同的电池反应,DrG 的值应该相同,但是由于两个反应的电子得失不同,所以E$ 不相同,
的值应该相同,但是由于两个反应的电子得失不同,所以E$ 不相同,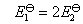 。
。
另外,从电池的组成也可以看出两个电池的E$ 是不相同的。两个电池的正极相同,但是两个电池的负极不相同,所以它们的E$ 也不可能相同。
18. 有一个化学反应 H2 (g,p$) + I2 (s)  2HI (aq,a=1)
2HI (aq,a=1)
(1) 将反应设计成相应的电池,写出电池的书面表达式。
(2) 计算上述反应在 298 K 时的 E、E$、DrG 和 K$。
和 K$。
(3) 若反应写成 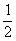 H2(g,p$) +
H2(g,p$) + 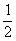 I2(s)
I2(s)  HI (aq,a=1) ,则 E , E$ ,DrG
HI (aq,a=1) ,则 E , E$ ,DrG 和 K$各为多少?
和 K$各为多少?
已知 298 K 时,I- (aq) 的标准摩尔Gibbs生成自由能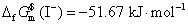 。
。
解: (1) 反应式中,H2氧化为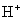 ,将氢电极作为负极放在电池的左边。I2 (s)还原为
,将氢电极作为负极放在电池的左边。I2 (s)还原为 ,将碘电极作为正极放在电池的右边,并各放上导电用的金属Pt,则电池的书面表达式为
,将碘电极作为正极放在电池的右边,并各放上导电用的金属Pt,则电池的书面表达式为
Pt│H2(p$)│HI(aq,a=1)│I2(s)│Pt
(2) 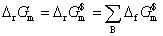
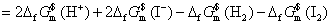
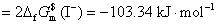
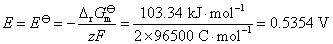
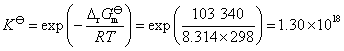
或 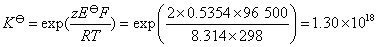
(3) 电动势的值不变,因为电动势是电池的性质,与电池反应的写法无关,所以
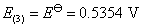
Gibbs 自由能的变化值降低一半,因为反应进度都是1 mol ,但发生反应的物质的量少了一半,即
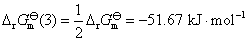
根据平衡常数与Gibbs 自由能变化值的关系,
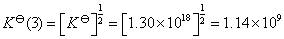
19.氢-氧燃料电池的电池反应为:H2(g)+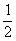 O2(g)→H2O(l),已知
O2(g)→H2O(l),已知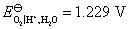
(1) 写出对应电池的书面表示式和电极反应。
(2) 当H2(g)和O2(g)的压力都等于标准压力p$时,计算电池的标准电动势值。
(3) 计算电池反应的标准平衡常数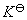 。
。
(4) 计算每摩尔H2(g)所能作的最大电功。
解:(1) 电池反应中H2(g)被氧化,氢电极作负极,O2(g)被还原,氧电极作正极,故电池的表示式为: Pt│H2(g)│H+(aq)│O2(g)│Pt
负极,氧化 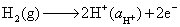
正极,还原 
(2) 
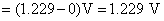
(3) 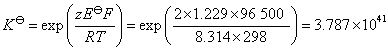
(4) 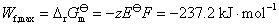
20.已知电极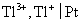 的还原电极电势
的还原电极电势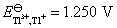 ,电极
,电极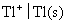 的还原电极电势
的还原电极电势  。试计算电极
。试计算电极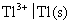 的还原电极电势
的还原电极电势 的值。
的值。
解:首先写出电极反应,写出摩尔Gibbs自由能变化值与标准电极电势之间的关系。根据Hess定律,电极反应相加减,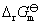 也是相加减的关系,但是电极电势不能相加减,而要从
也是相加减的关系,但是电极电势不能相加减,而要从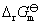 的数值和关系式得到。
的数值和关系式得到。
(1) 
(2) 
(3) 
因为(3)=(1)+(2),所以
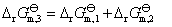
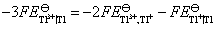
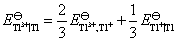

21. 已知  ,
,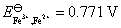 。试计算
。试计算
(1) 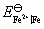 的值。
的值。
(2) 反应 的标准平衡常数。
的标准平衡常数。
解:首先写出电极反应,写出摩尔Gibbs自由能变化值与标准电极电势之间的关系。根据Hess定律,电极反应相加减,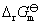 也是相加减的关系,但是电极电势不能相加减,而要从
也是相加减的关系,但是电极电势不能相加减,而要从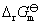 的数值得到。
的数值得到。
(1) 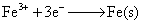 ①
① 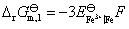
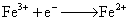 ②
② 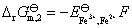
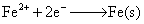 ③
③ 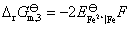
③=①-② 
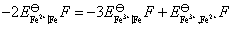
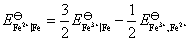
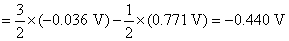
(2) 需要设计一个电池,使电池反应就是 这个反应。这里Fe氧化为Fe2+,把这个电极作负极。Fe3+还原为Fe2+,把这个氧化还原电极作正极,则所设计的电池为: Fe (s)│Fe2+(a=1)‖Fe3+(a=1), Fe2+(a=1)│Pt
这个反应。这里Fe氧化为Fe2+,把这个电极作负极。Fe3+还原为Fe2+,把这个氧化还原电极作正极,则所设计的电池为: Fe (s)│Fe2+(a=1)‖Fe3+(a=1), Fe2+(a=1)│Pt
在电池反应 中,有2个电子得失,该电池的标准电动势为:
中,有2个电子得失,该电池的标准电动势为:
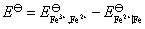

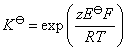

也可将电池设计为 Fe (s)│Fe3+(a=1)‖Fe3+(a=1), Fe2+(a=1)│Pt
电池反应也是 Fe (s)+2 Fe3+=3 Fe2+ ,有3个电子得失
该电池的标准电动势为:
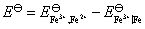
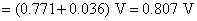
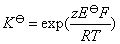
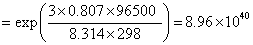
22.(1) 在含有 FeCl3 (2.0 mol·kg-1) 和 FeCl2 (1.0×10-4 mol·kg-1) 的烧杯中插入铂电极,当与标准氢电极组成电池时,计算该电池的电动势的值? 已知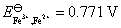 。
。
(2)在含有 KBr (3.0 mol·kg-1) 和Br2 (1.0×10-4 mol·kg-1) 的烧杯中插入铂电极, 当与标准氢电极组成电池时的电动势为多少? 已知 。
。
(3)当将上面两个烧杯中的溶液混合时,根据上述反应,判断将发生什么反应? (设活度因子均等于1) 。
解:(1) 这是一个氧化还原电极,其电极反应为:
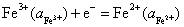
该电极的还原电极电势,就等于与标准氢电极组成电池时的电动势,即
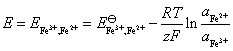
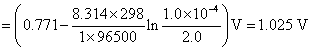
(2) 这是一个卤素电极,其电极反应为:
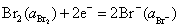
该电极的还原电极电势,就等于与标准氢电极组成电池时的电动势,即
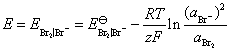

(3) 第一个氧化还原电极的电势高,作正极,发生还原反应,第二个电极的电势低,作负极,发生氧化反应。所以,当两个烧杯中的溶液混合时,可能发生的反应为:
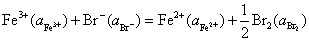
23.在 298 K时,电极反应为 的标准还原电极电势为 0.860 V,电极反应为
的标准还原电极电势为 0.860 V,电极反应为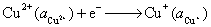 的标准还原电极电势为0.153 V,计算
的标准还原电极电势为0.153 V,计算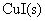 的标准活度积常数
的标准活度积常数 。
。
解:第一个电极是难溶盐电极,第二个电极是氧化还原电极,将它们组成电池,电极电势高的作正极,发生还原反应,电极电势低的作负极,发生氧化反应,所组成的电池为:
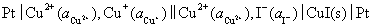
该电池的净反应为: 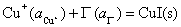
电池反应恰好是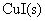 解离反应的逆反应,只要求出电池的标准电动势,就可以计算电池反应的平衡常数,其倒数就是
解离反应的逆反应,只要求出电池的标准电动势,就可以计算电池反应的平衡常数,其倒数就是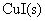 的活度积常数。
的活度积常数。
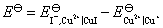

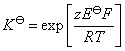
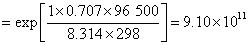

如果将两个电极对调,组成非自发电池,则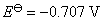 ,计算所得的平衡常数就是
,计算所得的平衡常数就是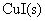 的标准活度积常数。
的标准活度积常数。
24.在298 K时,已知电极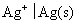 的还原电极电势
的还原电极电势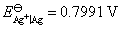 ,电极
,电极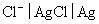 的电极电势
的电极电势 ,试计算
,试计算
(1)  在浓度为0.01 mol·dm-3的KNO3溶液中的饱和溶液的浓度。已知在该溶液中,
在浓度为0.01 mol·dm-3的KNO3溶液中的饱和溶液的浓度。已知在该溶液中,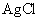 的平均活度因子
的平均活度因子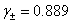 。
。
(2) 反应 的标准摩尔反应Gibbs自由能
的标准摩尔反应Gibbs自由能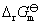 。
。
(3)从计算结果说明,反应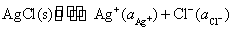 自发进行的方向? 写出这两个电极在298 K和标准状态下,组成自发电池的表示式。
自发进行的方向? 写出这两个电极在298 K和标准状态下,组成自发电池的表示式。
解:(1) 要计算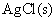 饱和溶液的浓度,首先要计算它的解离平衡常数,这可通过设计电池的方法来解决,使设计的电池反应就是
饱和溶液的浓度,首先要计算它的解离平衡常数,这可通过设计电池的方法来解决,使设计的电池反应就是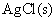 的解离反应。所设计的电池为
的解离反应。所设计的电池为
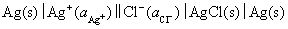
该电池的电池反应就是 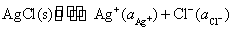
电池的标准电动势
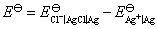
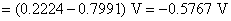
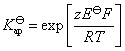
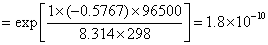
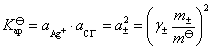
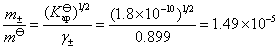
AgCl 在 0.01 mol·dm-3 KNO3溶液中的饱和溶液的浓度用AgCl的质量摩尔浓度表示,
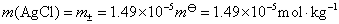
(2)根据电池的标准电动势E$与标准摩尔反应Gibbs自由能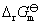 之间的关系,得:
之间的关系,得:
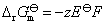
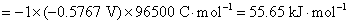
或根据标准摩尔反应Gibbs自由能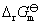 与标准平衡常数之间的关系,得
与标准平衡常数之间的关系,得
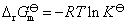
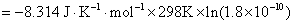
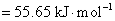
(3)从计算结果说明,在298 K和标准情况下,对应电池的电动势为负值,是非自发电池。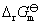 是个大于零的正值,所以反应
是个大于零的正值,所以反应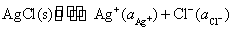 是个非自发的反应,反应自动向左进行。要组成自发电池,必须将上面电池的两个电极对换,电池的表示式为
是个非自发的反应,反应自动向左进行。要组成自发电池,必须将上面电池的两个电极对换,电池的表示式为

25.试将化学反应 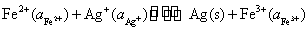 设计成一个电池,已知:
设计成一个电池,已知: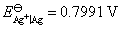 ,
,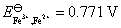 。
。
(1) 写出电池的表达式。
(2) 计算上述电池反应在 298 K时的标准平衡常数 K$ 。
(3) 若将过量的磨成细粉的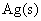 加到浓度为 0.05 mol·kg-1的 Fe(NO3)3溶液中,当反应达平衡后,
加到浓度为 0.05 mol·kg-1的 Fe(NO3)3溶液中,当反应达平衡后,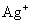 的浓度为多少?设活度因子均等于1。
的浓度为多少?设活度因子均等于1。
解:(1) 从所给反应可知,Fe2+氧化为Fe3+,这个氧化还原电极应该做阳极,放在电池左边作负极。Ag+还原为Ag(s),这个金属电极应该做阴极,放在电池右边作正极。所设计的电池表达式为:

(2) 从已知的电极电势首先计算上述电池的标准电动势,这样就可以计算反应的标准平衡常数K$

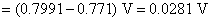
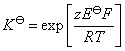

(3) 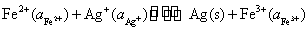
开始时 0 0 0.05
平衡时 x x 0.05- x

则当反应达平衡后,Ag+ 的浓度为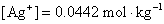 。
。
26.298 K 时,测得下列电池的电动势 E = 1.136 V,
Ag│AgCl(s)│HCl(aq)│Cl2(p$)│Pt
在此温度下,已知 ,
,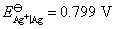 。请计算:AgCl(s)的标准摩尔生成Gibbs自由能
。请计算:AgCl(s)的标准摩尔生成Gibbs自由能 和标准活度积常数
和标准活度积常数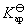 。
。
解:首先写出已知电池的电极反应和电池反应,
负极,氧化 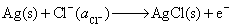
正极,还原 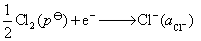
电池净反应 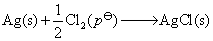
这个净反应就是AgCl(s)的生成反应,要计算AgCl(s)的标准摩尔生成Gibbs自由能 ,就要计算该电池的标准电动势。这个电池反应的各个物质都处在标准状态下,所以电池的电动势就是它的标准电动势,所以
,就要计算该电池的标准电动势。这个电池反应的各个物质都处在标准状态下,所以电池的电动势就是它的标准电动势,所以
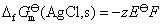
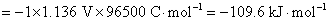
要计算AgCl(s)的活度积常数,首先要设计一个电池,使电池反应就是AgCl(s)的解离反应,这样可从所设计电池的标准电动势,计算该电池的平衡常数,这就是AgCl(s)的标准活度积常数。所设计的电池(2)为:
Ag(s)│Ag+‖HCl(aq) │AgCl(s)│Ag(s)
电池的净反应为 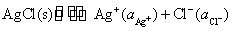
电池的标准电动势为
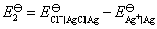
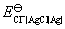 的数值要从已知电池的电动势得到
的数值要从已知电池的电动势得到
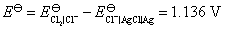
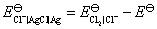
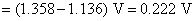
所以 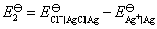
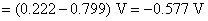
这虽然是一个非自发电池,但对于计算AgCl(s)的活度积常数是没有关系的,因为AgCl(s) 的解离反应本身就是一个非自发反应。电池的标准活度积常数为:
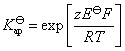

27.有电池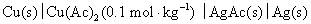 ,已知298 K时该电池的电动势
,已知298 K时该电池的电动势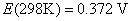 ,在308 K时,
,在308 K时, ,设电动势E随温度的变化是均匀的。又知298 K时,
,设电动势E随温度的变化是均匀的。又知298 K时,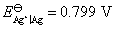 ,
,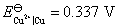 。
。
(1)写出电极反应和电池反应。
(2)当电池反应中电子的得失数为2时,求反应进度为1 mol时的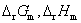 和
和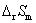 。
。
(3)求醋酸银AgAc(s)的活度积常数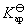 (设活度因子均为1)。
(设活度因子均为1)。
解: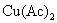 是可溶性盐,不要误认为是难溶盐,将电极反应写错,这样就会一错到底。
是可溶性盐,不要误认为是难溶盐,将电极反应写错,这样就会一错到底。
(1) 负极,氧化 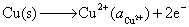
正极,还原 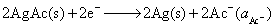
净反应 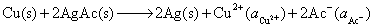
(2)设电动势E随温度的变化是均匀的,意味着电动势的温度系数可以用电动势的差值除以温度的差值来求,得到的是平均值。计算时要注意的是,已规定电子的得失数为2。所以
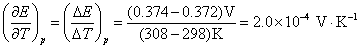
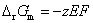
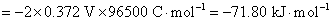
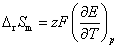

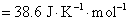
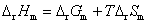

(3)要计算AgAc(s)的活度积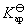 ,一般是要设计一个电池,使电池反应恰好是AgAc(s)的解离反应。也可以将二类电极反应写成一类电极反应的形式,直接将
,一般是要设计一个电池,使电池反应恰好是AgAc(s)的解离反应。也可以将二类电极反应写成一类电极反应的形式,直接将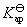 引入计算电动势的Nernst方程,使之成为唯一的未知数。
引入计算电动势的Nernst方程,使之成为唯一的未知数。
解法1:首先设计一个电池,使电池反应就是AgAc(s)的解离反应,这样可从所设计电池的标准电动势,计算该电池反应的平衡常数,这就是AgAc(s) 的活度积。所设计的电池为:
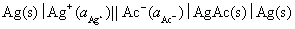
电池反应为: 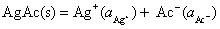
现在要从已知电池的电动势,求出 。已知电池电动势的计算式为:
。已知电池电动势的计算式为: 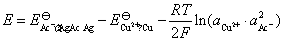
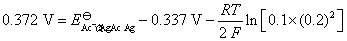
解得: 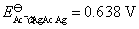
则所设计电池的标准电动势为: 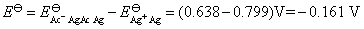
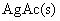 的活度积为:
的活度积为:
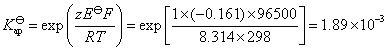
解法2:将电极反应和电池反应写成
负极,氧化 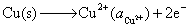
正极,还原 
净反应 

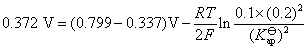
解得: 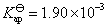
28.在298 K和标准压力下,以Pt(s)为阳极,Fe(s)为阴极,电解浓度为1.0 mol·kg-1的NaCl水溶液(平均活度因子为0.66)。设阴极表面有H2(g)不断逸出时的电流密度为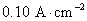 ,在Pt电极上逸出Cl2(g)的超电势可近似看作为零。若Tafel公式为
,在Pt电极上逸出Cl2(g)的超电势可近似看作为零。若Tafel公式为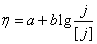 ,且已知Tafel常数
,且已知Tafel常数 ,
,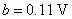 ,
,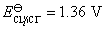 ,试计算该电解池的实际分解电压(忽略电池中的电阻造成的电位降)。
,试计算该电解池的实际分解电压(忽略电池中的电阻造成的电位降)。
解:若电解池能在大气压力下顺利工作,通常将逸出的气体的压力看作等于外压。理论分解电压在数值上就等于该电池作为原电池时的电动势,原电池的正极为氯气电极,电极的还原反应和电极电势为
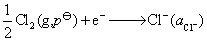
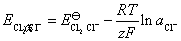
原电池的负极为氢气电极,电极的还原反应和电极电势为
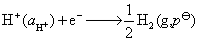
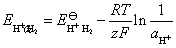
原电池的电动势为
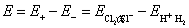
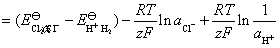
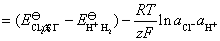

根据Tafel公式,析出H2(g)的超电势为
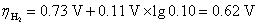
所以,实际分解电压为
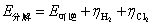
29.在298 K和标准压力下,用 电极电解浓度为
电极电解浓度为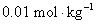 的
的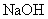 溶液,控制电流密度
溶液,控制电流密度 。问这时在两个银电极上首先发生什么反应?此时外加电压为多少?已知在该电流密度时,
。问这时在两个银电极上首先发生什么反应?此时外加电压为多少?已知在该电流密度时,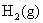 和
和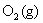 在
在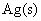 电极上的超电势分别为0.87 V和0.98 V。已知
电极上的超电势分别为0.87 V和0.98 V。已知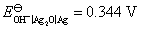 ,
,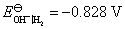 ,
,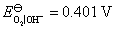 ,
,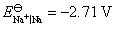 。设活度因子均为1。
。设活度因子均为1。
解:将在阴极上有可能发生还原反应的电极电势计算出来,还原电极电势最大的将首先在阴极发生反应,
(1) 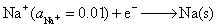


(2) 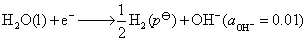
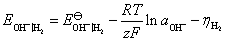
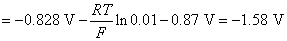
这个电极电势也可以这样计算,两个结果是一样的。
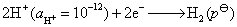

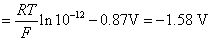
在阴极上,还原电极电势大的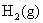 先还原析出。通常情况下,
先还原析出。通常情况下, 的析出一般是不考虑的,这里仅是用来说明考虑的方法。
的析出一般是不考虑的,这里仅是用来说明考虑的方法。
阳极上可能发生的反应除阴离子外,还要考虑银电极本身也有可能发生氧化
(1) 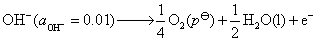
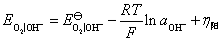
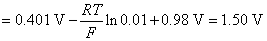
(2) 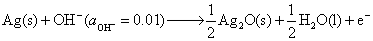
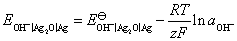
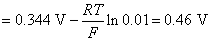
在阳极上,还原电极电势最小的首先发生反应,所以银电极先氧化成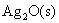 。这时外加的最小电压是
。这时外加的最小电压是
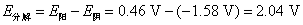
30.在298 K和标准压力时,电解一含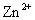 溶液,希望当
溶液,希望当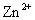 浓度降至
浓度降至 时,仍不会有
时,仍不会有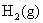 析出,试问溶液的pH应控制在多少为好?已知
析出,试问溶液的pH应控制在多少为好?已知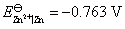 ,
,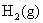 在Zn(s)上的超电势为0.72 V,并设此值与浓度无关。
在Zn(s)上的超电势为0.72 V,并设此值与浓度无关。
解:要使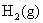 不析出,
不析出,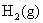 的实际析出电势应小于
的实际析出电势应小于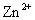 的析出电势。首先分别列出两个电极电势的计算式
的析出电势。首先分别列出两个电极电势的计算式
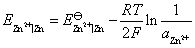
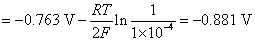

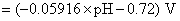
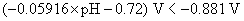
解得 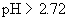
溶液的pH应控制在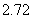 以上,
以上,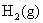 才不会与Zn(s)同时析出。
才不会与Zn(s)同时析出。
31.在298 K和标准压力下,用铁Fe(s)为阴极,C(石墨)为阳极,电解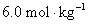 的NaCl水溶液。若
的NaCl水溶液。若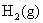 在铁阴极上的超电势为0.20 V,
在铁阴极上的超电势为0.20 V,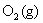 在石墨阳极上的超电势为0.60 V,
在石墨阳极上的超电势为0.60 V,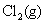 的超电势可忽略不计。试用计算说明两极上首先发生的反应,并计算使电解池发生反应至少所需加的外加电压。已知
的超电势可忽略不计。试用计算说明两极上首先发生的反应,并计算使电解池发生反应至少所需加的外加电压。已知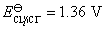 ,
,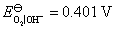 ,
,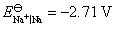 ,设活度因子均为1。
,设活度因子均为1。
解:由于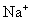 还原成
还原成 的析出电势很小,而且在水溶液中不可能有
的析出电势很小,而且在水溶液中不可能有 析出,所以不考虑
析出,所以不考虑 的析出,在铁阴极上析出的是
的析出,在铁阴极上析出的是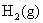 ,其析出电势为
,其析出电势为

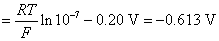
阳极上可能发生氧化的离子有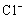 和
和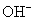 。它们的析出电势分别为
。它们的析出电势分别为
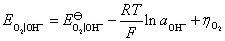
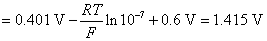
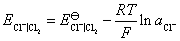
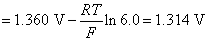
所以阳极上发生的反应是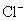 氧化为
氧化为 。最小的外加分解电压为
。最小的外加分解电压为
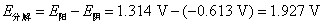
这里利用C(石墨)为阳极,就是因为氧气在石墨阳极上析出有超电势,而氯气没有,从而电解NaCl浓的水溶液在石墨阳极上获得氯气作为化工原料。
32.298 K 时,某钢铁容器内盛 pH = 4.0 的溶液,试用计算说明,此时钢铁容器是否会被腐蚀?假定容器内 Fe2+的浓度超过 10-6 mol·dm-3 时,则认为容器已被腐蚀。
已知: ,H2(g)在Fe(s)上析出时的超电势为 0.40 V。
,H2(g)在Fe(s)上析出时的超电势为 0.40 V。
解:只要算出氢电极和铁电极的电极电势,比较其大小,就可以判断容器是非会被腐蚀。
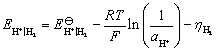
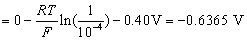
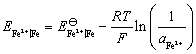
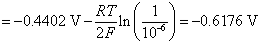
因为 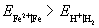 ,电势高的做正极,是原电池的阴极,故钢铁容器不会被腐蚀。
,电势高的做正极,是原电池的阴极,故钢铁容器不会被腐蚀。
