选修4第三章《水溶液中的电离平衡》复习测试题
第一部分 选择题(共90分)
一、选择题(每小题只有一个选项符合题意)
1.有一支50mL酸式滴定管中盛盐酸,液面恰好在amL刻度处,把管内液体全部放出,盛入量筒内,所得液体体积一定是
A. a mL B.(50―a)mL
C. 大于(50―a)mL D. 大于a mL
2.用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是
A.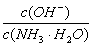 B.
B.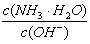
C.c(H+)和c(OH-)的乘积 D.OH-的物质的量
3.某学生的实验报告所列出的下列数据中合理的是
A.用10mL量筒量取7.13mL稀盐酸 B.用托盘天平称量25.20g NaCl
C.用广泛pH试纸测得某溶液的pH为2.3
D.用25mL滴定管做中和滴定时,用去某浓度的碱溶液21.70mL
4.下列溶液加热蒸干后,能析出溶质固体的是
A.AlCl3 B.KHCO3 C.Fe2(SO4)3 D.NH4HCO3
5. 在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH- 离子浓度分别为Amol/L与Bmol/L,则A和B关系为
A. A>B B. A=10-4 B C. B=10-4 A D. A=B
6.一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的
①NaOH固体 ②H2O ③NH4Cl固体 ④CH3COONa固体 ⑤NaNO3固体 ⑥KCl溶液
A .②④⑥ B.①② C.②③⑤ D.②④⑤⑥
7.1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液的pH等于
A. 9.0 B. 9.5 C. 10.5 D. 11.5
8.含等物质的量NaOH的溶液分别用pH为2和3的CH3COOH溶液中和,设消耗CH3COOH溶液的体积依次为 ,则两者的关系正确的是
,则两者的关系正确的是
A. 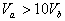 B.
B. 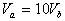
C. 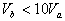 D.
D. 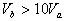
9.若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是
A.生成了一种强酸弱碱盐 B.弱酸溶液和强碱溶液反应
C.强酸溶液和弱碱溶液反应 D.一元强酸溶液和一元强碱溶液反应
10.下列溶液,一定呈中性的是
A. c(H+)=1×10-7mol/L的溶液 B. pH=pOH 的溶液
C. pH=14-pOH 的溶液
D. 由等体积、等物质的量浓度的一元酸跟氢氧化钠溶液混合后所形成的溶液
11 . 25℃时,在某物质的溶液中,由水电离出的c(H+)=1×10-a mol/L,下列说法不正确的是
A.a<7时,水的电离受到抑制 B.a>7时,水的电离受到抑制
C.a<7时,溶液的pH一定为a
D.a>7时,溶液的pH一定为14-a或a
12.下列离子方程式中正确的是
A. 氢氧化钠溶液吸收过量的二氧化碳 OH-+CO2 = HCO3-
B. 亚硫酸氢铵溶液与足量氢氧化钠溶液反应 HSO3-+ OH-= SO32-+ H2O
C. 氯气通入冷水中 Cl2 +H2O = Cl-+ClO-+2H+
碳酸镁悬浊液中加醋酸 CO32-+2CH3COOH = 2CH3COO-+CO2↑+H2O
13.(双选)氢氰酸(HCN)的下列性质中,可以证明它是弱电解质的是
A. 1mol/L氢氰酸酸溶液的pH约为3 B. HCN易溶于水
C. 10 mL1mol/LHCN恰好与10 mL 1mol/L NaOH溶液完全反应
D. 在相同条件下,HCN溶液的导电性比强酸溶液的弱
14. 已知当NH4Cl溶液的浓度小于0.1mol/L时,其pH>5.1。现用0.1mol/L的盐酸滴定10mL0.05mol/L的氨水,用甲基橙作指示剂达到终点时所用盐酸的量应是
A.10mL B.5mL C.大于5mL D.小于5mL
15.将40℃的饱和石灰水冷却至10℃;或加入少量CaO,但温度仍保持40℃,在这两种情况下均未改变的是
A.Ca(OH)2的溶解度、溶剂的质量 B.溶液中溶质的质量分数
C.溶液的质量、水的电离平衡 D.溶液中Ca2+的数目
16.(双选) 将pH=11 NaOH溶液和pH=3的甲酸溶液以等体积混合后,对所得溶液,下列判断一定正确的是
A.c(HCOO-)< c(Na+) B.c(HCOO-)> c(Na+)
C.c(OH-)< c(HCOO-) D.c(OH-)> c(HCOO-)
17.室温下,pH相同体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是
A. 加水稀释2倍后,两溶液的pH均减小
B. 使温度都升高20℃后,两溶液的pH均不变
C. 加适量的醋酸钠晶体后,两溶液的pH均增大
D. 加足量的锌充分反应后,醋酸产生的氢气比盐酸多
18. 0.1 mol?L-1 KHS溶液中下列表达式不正确的是( )
A.c(K +)+c(H+)= c(OH-)+ c(HS-)+2 c(S2-)
B.c(K+)> c(HS-)> c(OH-)> c(S2-)> c(H+)
C.c(HS-)+ c(S2-)+ c(H2S)= 0.1 mol?L-1
D.c(K+)> c(HS-)> c(OH-)> c(H2S)> c(H+)
19、 某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子。则下列描述正确的是( )
A.该溶液由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而
B.该溶液由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶
混合而成
C.加入适量NaOH,溶液中离子浓度为c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.加入适量氨水,c(CH3COO-)一定大于c(Na+)、c(NH4+)之和
20 在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的有( )
A. 滴加石蕊试液显红色的溶液:Fe3+、NH4+、Cl-、I-
B. pH值为1的溶液:Cu2+、Na+、Mg2+、NO3-
C. 水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+
D. 所含溶质为Na2SO4的溶液:K+、CO32-、NO3-、Al3+
21 下列叙述正确的是( )
A. 将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+)
B. 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
C. pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D. 向0.1 mol/L的氨水中加入少量硫酸铵固体,则溶液中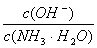 增大
增大
22、下列水解化学方程式或水解离子方程式正确的是:( )
A.CH3COO— + H2O 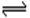 CH3COOH + OH—
CH3COOH + OH—
B.NH4+ + H2O  NH4OH + H+
NH4OH + H+
C.CH3COOH + NaOH  CH3COONa + H2O
CH3COONa + H2O
D.NaCl + H2O NaOH + HCl
NaOH + HCl
23、把0.02mol/LCH3COOH溶液和0.01mol/LNaOH溶液以等体积混和,则混合液中微粒浓度关系正确的为 ( )
A.c (CH3COO-)>c (Na+) B.c (CH3COOH)+c (CH3COO-)=0.01mol/L
C.c (CH3COOH)>c (CH3COO-) D.c (OH-)>c (H+)
二.填空题
23.(1)对于Ag2S(s)  2Ag+(aq)+ S2-(aq),其Ksp=____________。
2Ag+(aq)+ S2-(aq),其Ksp=____________。
(2)下列说法不正确的是__________。
A. 用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小;
B. 物质的溶解度随温度的升高而增加,故物质的溶解都是吸热的;
C. 对于Al(OH)3(s)  Al(OH)3(aq)
Al(OH)3(aq)  Al3++3OH-,前者为溶解平衡,后者为电离平衡;
Al3++3OH-,前者为溶解平衡,后者为电离平衡;
D. 除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3大
E. 沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全。
24 (1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________。
A. KMnO4 B. H2O2 C. Cl2 水 D. HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的________。
A. NaOH B. NH3·H2O C. CuO D. Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________(填“可行”或“不可行”)。
25 .(6分)pH=12的NaOH溶液100mL,要使它的pH为11。(体积变化忽略不计)
(1)如果加入蒸馏水,应加_________mL;
(2)如果加入pH=10的NaOH溶液,应加_________mL;
(3)如果加0.01mol/L HCl,应加_________mL。
26、在25℃时,有pH=a的盐酸与pH=b的NaOH溶液,取VaL该盐酸同该NaOH溶液恰好反应,需VbLNaOH溶液,问:
(1)若a+b=14时,则Va/Vb= (填数值);
(2)若a+b=13时,则Va/Vb= (填数值);
(3)若a+b>14时,则Va/Vb= (填表达式),且Va -------Vb(填>、<或=)
.
27、(1) 25℃时, 0.05mol/LH2SO4溶液的PH=_________;0.05mol/LBa(OH)2溶液C(H+)=_______
(2)某温度下纯水中的C(H+)= 2×10-7mol/L,则此时溶液中的C(OH-)
= ;若温度不变,滴入稀盐酸,使C(H+)= 5×10-4mol/L,则
溶液中C(OH-)= ,此时溶液中由水电离产生的C(H+)= 。
28、在2mL0.1mol/L的NaCl溶液中,加入2mL0.1mol/L的AgNO3溶液,可观察到 ,此反应的离子方程式 。将此混合液过滤,滤渣加入2mL0.1mol/L的KI溶液,搅拌,可观察 到 ,反应的离子方程式为
29、用已知浓度的NaOH溶液测定未知浓度的醋酸,选用的指示剂______;用已知浓度的HCl溶液测定未知浓度的氨水,选用的指示剂________
30.(4分)物质的量浓度均为0.1 mol/L的下列溶液:KNO3、Na2CO3、NaHCO3、NaHSO4 、CH3COOH、NaOH 、Ba(OH)2、NH4Cl,pH 由大到小的顺序为
-------------------------------
31、常温下某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合pH=7,求酸溶液体积V(酸)和碱溶液体积V(碱)的关系。(4分 )
32、已知在室温时,Mg (OH)2的溶度积Ksp=5.6×10-12mol3·L-3,求室温下Mg (OH)2饱和溶液中Mg 2+和OH-的物质的量浓度(12分)
32 用酸式滴定管准确移取25.00mL某未知浓度的盐酸溶于一洁净的锥形瓶中,然后用0.20mol·L -1的氢氧化钠溶液(指示剂为酚酞).滴定结果如下:

(1)根据以上数据可以计算出盐酸的物质的量浓度为 mol·L-1.
(2)达到滴定终点的标志是
(3)以下操作造成测定结果偏高的原因可能是 。
A. 配制标准溶液的氢氧化钠中混有Na2CO3杂质
B. 滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C. 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E. 未用标准液润洗碱式滴定管
33.炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑。请回答:
(1)铁锅的锈蚀是 腐蚀(填“析氢”或“吸氧”)。
(2)写出铁锅腐蚀正极的电极反应式:
选修4第三章《水溶液中的电离平衡》单元测试题答案
第一部分 选择题(共90分)
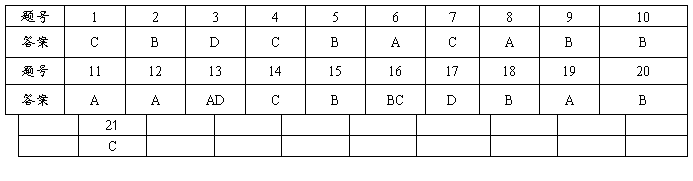
19. (1)[c(Ag+)]2·c(S2-) (2)BD22. (1)B CD (2)4 3.3 可行
23. (1)900 (2)1000 (3)81.8
第二篇:选修4第三章《水溶液中的电离平衡》单元测试题
选修4第三章《水溶液中的电离平衡》单元测试题
1.有一支50mL酸式滴定管中盛盐酸,液面恰好在amL刻度处,把管内液体全部放出,盛入量筒内,所得液体体积一定是( )
A. a mL B.(50―a)mL C. 大于(50―a)mL D. 大于a mL
2.用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是( )
A. B.
B.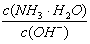 C.c(H+)和c(OH-)的乘积 D.OH-的物质的量
C.c(H+)和c(OH-)的乘积 D.OH-的物质的量
3.某学生的实验报告所列出的下列数据中合理的是( )
A.用10mL量筒量取7.13mL稀盐酸 B.用托盘天平称量25.20g NaCl
C.用广泛pH试纸测得某溶液的pH为2.3
D.用25mL滴定管做中和滴定时,用去某浓度的碱溶液21.70mL
4.下列溶液加热蒸干后,能析出溶质固体的是( )
A.AlCl3 B.KHCO3 C.Fe2(SO4)3 D.NH4HCO3
5.在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH- 离子浓度分别为Amol/L与Bmol/L,则A和B关系为( )
A. A>B B. A=10-4 B C. B=10-4 A D. A=B
6.一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的( )
①NaOH固体 ②H2O ③NH4Cl固体 ④CH3COONa固体
⑤NaNO3固体 ⑥KCl溶液
A.②④⑥ B.①② C.②③⑤ D.②④⑤⑥
7.1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液的pH等于( )
A. 9.0 B. 9.5 C. 10.5 D. 11.5
8.含等物质的量NaOH的溶液分别用pH为2和3的CH3COOH溶液中和,设消耗CH3COOH溶液的体积依次为 ,则两者的关系正确的是( )
,则两者的关系正确的是( )
A.  B.
B. 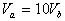 C.
C.  D.
D. 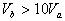
9.若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是( )
A.生成了一种强酸弱碱盐 B.弱酸溶液和强碱溶液反应
C.强酸溶液和弱碱溶液反应 D.一元强酸溶液和一元强碱溶液反应
10.下列溶液,一定呈中性的是( )
A. c(H+)=1×10-7mol/L的溶液 B. pH=pOH 的溶液
C. pH=14-pOH 的溶液
D. 由等体积、等物质的量浓度的一元酸跟氢氧化钠溶液混合后所形成的溶液
11.下列说法中不正确的是 ( )
A.Ksp只与难溶电解质本身的性质和温度有关
B.在一定温度下,向AgCl饱和溶液中加入盐酸时,Ksp值变大
C.在一定温度下的AgCl饱和溶液中,C(Ag+)和C(Cl-)的乘积是一个常数
D.由于Ksp(FeS)>Ksp(CuS),所以FeS沉淀在一定条件下可以转化为CuS沉淀
12.下列有关滴定操作的顺序正确的是:( )①用标准溶液润洗滴定管; ②往滴定管内注入标准溶液; ③检查滴定管是否漏水; ④滴定; ⑤洗涤
A.③⑤①②④ B.⑤①②③④ C.⑤②③①④ D.②①③⑤④
13.氢氰酸(HCN)的下列性质中,可以证明它是弱电解质的是( )
A. 1mol/L甲酸溶液的pH约为3 B. HCN易溶于水
C. 10 mL1mol/LHCN恰好与10 mL 1mol/L NaOH溶液完全反应
D. 在相同条件下,HCN溶液的导电性比强酸溶液的弱
14.在20mL0.1mol·L-HCl溶液中加入同体积、同物质的量浓度的NH3·H2O溶液,反应后溶液中各粒子浓度的关系错误的是( )
A.C(H+)+C(NH4+)=C(OH-)+C(Cl-)
B.C(H+)= C(OH-)+ C(NH 3·H2O)
C.C(Cl-)>C(NH4+)>C(OH-)>C(H+)
D.C(Cl-)=C(NH4+)+ C(NH 3·H2O)
15.将40℃的饱和石灰水冷却至10℃;或加入少量CaO,但温度仍保持40℃,在这两种情况下均未改变的是( )
A.Ca(OH)2的溶解度、溶剂的质量 B.溶液中溶质的质量分数
C.溶液的质量、水的电离平衡 D.溶液中Ca2+的数目
16.将pH=11 NaOH溶液和pH=3的甲酸溶液以等体积混合后,对所得溶液,下列判断一定正确的是( )A.c(HCOO-)< c(Na+) B.c(HCOO-)> c(Na+)
C.c(OH-)< c(HCOO-) D.c(OH-)> c(HCOO-)
17.常温下,在由水电离产生的c(H+)H2O=10-12mol/ L的溶液中,一定能大量共存的离子组是( )A.NH4+、Ba2+、Cl-、NO3- B.Na+、K+、SO42-、NO3-
C.Fe3+、Cu2+、SO42-、Cl- D.Mg2+、K+、ClO-、I-
18.25℃时,已知:Ksp(AgCl ) =1.8×10-10,Ksp(AgI) =1.0×10-16。下列关于不溶物之间转化的说法中错误的是 ( ) A.AgCl不溶于水,不可能转化为AgI
B.AgI比AgCl更难溶于水,所以AgCl可以转化为AgI
C.两种不溶物的Ksp相差越大,不溶物就越容易转化为更难溶的不溶物 D.25℃时,AgCl若要在KI溶液中转化为AgI,则C(KI)必须≥×10-11 mol/L
19.当用标准盐酸溶液滴定待测氢氧化钠溶液时,下列操作中会使测定结果偏低的( )
A.用酸式滴定管滴至终点时,俯视滴定管读数
B.将碱液移入锥形瓶后,加了10 ml蒸馏水再滴定
C.酸式滴定管用蒸馏水润洗后,未用标准盐酸溶液润洗
D.酸式滴定管注入酸液时,尖嘴处留有气泡,达滴定终点时气泡消失
20.室温下,pH相同体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是( )A. 加水稀释2倍后,两溶液的pH均减小
B. 使温度都升高20℃后,两溶液的pH均不变
C. 加适量的醋酸钠晶体后,两溶液的pH均增大
D. 加足量的锌充分反应后,醋酸产生的氢气比盐酸多
21.(1)Al2(SO4)3的水溶液呈 (填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示): ;实验室在配制Fe2(SO4)3的溶液时,常将Fe2(SO4)3固体先溶于较浓的 中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解。
(2)在配制硫化钾(K2S)溶液时,为了防止发生水解,可以加入少量的 。
22.(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性”,“中性”或“碱性”),溶液中c(Na+) c(CH3COO-)(填“ >” 或“=”或“<” )。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 ,(填“酸性”,“中性”或“碱性”),溶液中c(Na+) c(CH3COO-) (填“ >” 或“=”或“<” )。
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 ,(填“酸性”,“中性”或“碱性”),醋酸体积 氢氧化钠溶液体积。(填“ >” 或“=”或“<” )。
23.用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是 。 A. 配制标准溶液的氢氧化钠中混有Na2CO3杂质
B. 滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C. 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E. 未用标准液润洗碱式滴定管
24.0.1mol/L某溶液的pH值为5.1,其溶液中的溶质可能是 ( )
A.氯化氢 B.BaCl2 C.氯化铵 D.硫酸氢钠
25.⑴已知:难溶于水的盐在水中存在溶解平衡,例如氯化银在水中的溶解平衡为: AgCl(s) Ag+(aq) + Cl—(aq)。在一定温度下,水溶液中银离子(Ag+)和氯离子(Cl-)的物质的量浓度的乘积为一常数,可用Ksp表示:Ksp = [Ag+]·[Cl-] = 1.8 × 10-10。现把足量氯化银晶体分别放入:①50mL 0.1mol·L-1的盐酸溶液中;②50mL0.1 mol·L-1的氯化钙溶液中;
Ag+(aq) + Cl—(aq)。在一定温度下,水溶液中银离子(Ag+)和氯离子(Cl-)的物质的量浓度的乘积为一常数,可用Ksp表示:Ksp = [Ag+]·[Cl-] = 1.8 × 10-10。现把足量氯化银晶体分别放入:①50mL 0.1mol·L-1的盐酸溶液中;②50mL0.1 mol·L-1的氯化钙溶液中;
③50mL 0.1 mol·L-l的氯化铁溶液中;④50mL蒸馏水中。
充分搅拌后,在相同温度下,银离子浓度最大的是(用序号回答) ,银离子浓度最小的是(用序号回答) 。在0.1mol·L-l氯化钙溶液中,银离子的浓度最大可达到 mol·L-1。
26、在Na2S溶液中c(Na+)与c(S2-)的比值是:( )
A .2 B. 小于2 C.大于2 D.1/2
27物质的量浓度相同的下列各溶液,由水电离出的氢氧根浓度由大到小的顺序( )
①NaHSO4 ② NaHCO3 ③ Na2CO3 ④ Na2SO4
A ④③②① B ①②③④ C ③②④① D ③④②①
28.下列说法中错误的是 ( )在Na2S溶液中滴入酚酞试液,呈红色
B.升高温度能使FeCl3溶液中的H+浓度增大
C.一切钾盐、钠盐、硝酸盐都不发生水解 D.醋酸盐溶于水能发生水解
29.相同温度下,相同物质的量浓度的四种溶液:①CH3COONa,②NaHSO4,③NaCl,④ 。按pH值由大到小顺序排列正确的是 ( )
。按pH值由大到小顺序排列正确的是 ( )
A.④①③② B.①④③② C.①②③④ D.④③②①
30.能使0.1mol/LCH3COONa溶液的pH值增大的方法是 ( )
A.加水 B.加盐酸 C.加热 D.加醋酸钠晶体
31.把NaHCO3作为发酵粉使用时,往往加入少量的明矾,这是因为 ( )
A.明矾起催化作用 B.硫酸铝钾比碳酸氢钠更易分解
C.明矾受热分解放出气体 D.铝盐在水中能起到酸的作用
32.将滴有甲基橙的醋酸钠饱和溶液加热,溶液的颜色是 ( )
A.黄色不变 B.黄色变橙色 C.黄色变红色 D.橙色不变
33.现有NH4Cl和NH3·H2O组成的混合溶液,若其pH=7,则该溶液中c(NH4+)___c(Cl-);
若pH>7,则该溶液中c(NH4+)______c(Cl-)。(填“>”、“<”、“=”).
34.比较下列溶液的pH (填“>”、“<”、“=”)
(1)0.1mol/LNH4Cl溶液______0.01mo1/L NH4Cl溶液;
(2)0.1mol/LNa2CO3溶液______0.1mol/L NaHCO3溶液;
(3)25℃、1mol/LFeCl3溶液_____80℃、1mol/LFeCl3溶液;
(4)0.1mol/L(NH4)2CO3溶液______0.1mol/L Na2CO3溶液。
35.25℃时,pH=12.0的KOH溶液中,由水电离出的(OH-)=_________mol/L;
pH=12.0的KCN溶液中,由水电离出来的(OH-)________mol/L。
36、向少量Mg(OH)2悬浊液中加入适量的饱和NH4Cl溶液,结果固体完全溶解。对此甲、乙两同学各自作了自己的解释:甲:Mg(OH)2(s)  Mg2++2OH- ①NH4++H2O
Mg2++2OH- ①NH4++H2O NH3·H2O+H+ ②
NH3·H2O+H+ ②
H++OH-=H2O ③由于③反应的发生,使平衡①右移,Mg(OH)2溶解。
乙:Mg(OH)2(s)  Mg2++2OH- ① NH4++ OH-
Mg2++2OH- ① NH4++ OH- NH3·H2O ②
NH3·H2O ②
由于②反应的发生,使平衡①右移,沉淀溶解。
(1)丙同学不能肯定哪位同学的解释合理,于是用下面的一种试剂重做了该实验,证明甲、乙的解释只有一种正确。他用的试剂是 。
A.NH4NO3 B.CH3COONH4 C.(NH4)2SO4 D.氨水
(2)丙同学将所选试剂滴入Mg(OH)2的浊液中,Mg(OH)2溶解;由此推知,甲和乙哪位同学的解释更合理___________(填“甲”或“乙”);完成NH4Cl饱和溶液使Mg(OH)2悬浊溶解的离子方程式_________________。
37.配制氯化铁溶液常出现浑浊现象,其原因是___________________________。
如何操作既可得到透明溶液而又不引进杂质离子_________________ ___ 。
38.在1 mol·L-1 Na2CO3溶液中,欲使CO32-的浓度尽量接近1mol·L-1,则应向溶液中加入少量的_______或_________原因是 。
39、某同学欲使用氯化铝溶液和硫化钠溶液制取硫化铝固体,你认为他的目的能达到吗? 为什么?用离子方程式表示 如果请你制取硫化铝固体,你将设计什么方案?(用化学方程式表示)
40、在一定条件下,x A+y B z C的反应达到平衡。
z C的反应达到平衡。
(1)已知A、B、C都是气体,在减压后平衡向逆反应方向移动,则x、y、z之间的关系是____ (2)已知C是气体,且x +y =z,在增大压强时,如果平衡发生移动,则平衡一定向______ ____移动;(3)已知B、C是气体,当其他条件不变,增大A的物质的量时,平衡不发生移动,则A是_____________态物质。
(4)若加热后C的质量分数减少,则正反应是_________(填“放热”或“吸热” )反应。
