?1、Ksp 数值的大小可以用来比较相同温度下相同类型难溶电解质溶解度的大
小。
2、相同温度下,难溶电解质的溶度积越小,则其溶解度也越小。………………………………………………( )
3、在难溶电解质的饱和溶液中加入与该难溶电解质含有相同离子的易溶盐时,该难溶电解质的溶解度 (填“增大、减小或不变”)。
4、298.15K下,AgI在下列哪种溶液中的溶解度最大………………………( ) ( A ) 纯水 ( B ) 0.0010 mol·L-1 KI溶液 ( C ) 0.0020 mol·L-1 KI溶液 ( D ) 0.00050 mol·L-1 KI溶液
5、下列物质中,可用溶度积来表示其溶解能力大小的是…………………( )
(A) KCl (B) NaOH (C) HCl (D) AgBr
6、在298K时,CaCO3在纯水中的溶解度为s1,在1.0 mol?dm?3的盐酸溶液中的溶解度为s2,在1.0 mol?dm?3的Na2CO3溶液中的溶解度为s3,则三者按大小顺序排列为:………………………………………………( )
(A) s3 > s2 > s1 (B) s1 > s2 > s3 (C) s2 > s1 > s3
(D) 不能判断其大小顺序
计算题:
1、已知298.15K时,Ks?(MgF2) = 6.5?10-9,计算:
(1)298.15K时,MgF2在纯水中的溶解度(mol?dm?3)。
(2)298.15K时,MgF2在0.10mol?dm?3KF水溶液中的中的溶解度(mol?dm?3)。
2、已知298.15K时,Ks?(CaF2) = 1.5?10-10,计算:
(1)298.15K时, CaF2在纯水中的溶解度(mol?dm?3)。
(2)298.15K时, CaF2在0.10mol?dm?3NaF水溶液中的溶解度(mol?dm?3)。 3、 在298.15K时,根据PbI2的溶度积(K
(1) PbI2在纯水中的溶解度(mol·L-1);
(2) PbI2在0.010 mol·L-1 KI溶液中的溶解度(mol·L-1)
4、根据Ag2CrO4的溶度积(Kθθ 10sp( PbI2 ) = 8.4 ×-9),计算: 10sp( Ag2CrO4 ) = 1.1 ×-12),在298.15K下,计
算:
(1) Ag2CrO4在纯水中的溶解度(mol·L-1);
(2) Ag2CrO4在0.010 mol·L-1 AgNO3溶液中的溶解度(mol·L-1)
第二篇:高二化学水溶液中的离子平衡练习题2
北京一对一上门家教品牌 家教电话:010—62561255
一、选择题(本题包括16小题,每题3分,共48分;每小题只有一个选项符合题意)
1.可以判定某酸(HA)是强电解质的事实是( )
A.该酸加热至沸腾不分解 B.0.01 mol·L-1该酸的pH=2
C.该酸可以溶解Cu(OH)2 D.该酸与CaCO3反应放出CO2
解析: 0.01 mol·L-1HA完全电离时,c(H+)=1×10-2mol·L-1,pH=2,弱酸也有其他三个选项的性质。
答案: B
2.下列溶液一定呈中性的是( )
A.pH=7的溶液
B.c(H+)=c(OH-)的溶液
C.由强酸、强碱等物质的量反应得到的溶液
D.非电解质溶于水得到的溶液
解析: 本题考查溶液酸碱性的判断,解题关键在于抓住溶液呈中性的根本标志。
中
—
错误!
答案: B
3.用蒸馏水逐步稀释0.2 mol/L的稀氨水时,若温度不变,在稀释过程下列数据始终保持增大趋势的是( )
A.c(OH-) B.c(NH4+)
清华北大家教中心 家教电话:010—62561255 性溶液
北京一对一上门家教品牌 家教电话:010—62561255
C.c(NH3·H2O) D.c(NH4+)/c(NH3·H2O)
解析: NH3·H2ONH4++OH-在稀释过程中,溶液中主要微粒NH4+、OH-、NH3·H2O的浓度都减小,故可用排除法选D。D中可这样理解,先假定平衡不动,则同等强度降低,但平衡正移,故比值增大。
答案: D
4.室温下,若溶液中由水电离产生的c(OH-)=1×10-14mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是( )
A.Al3+、Na+、NO3-、Cl- B.K+、Na+、Cl-、NO3-
C.K+、Na+、Cl-、AlO2- D.K+、NH4+、SO42-、NO3-
解析: 在室温下,纯水中c(H+)水=c(OH-)水=1×10-14mol·L-1,由此看出该溶液中水的电离受到抑制,该溶液可能为c(H+)=1 mol·L-1的酸溶液或c(OH-)=1 mol·L-1的碱溶液,A项中的Al3+、D项中的NH4+都会与OH-反应,C项中AlO2-会与H+反应,只有B项一定可以大量共存。
答案: B
5.下列反应不属于水解反应或水解方程式不正确的是( )
①HCl+H2OH3O++Cl- ②ZnCl2+H2O===Zn(OH)2+2HCl ③Na2CO3+H2OH2CO3+2NaOH
6H2O2Al(OH)3↓+3H2CO3
清华北大家教中心 家教电话:010—62561255 ④Al2(CO3)3+
北京一对一上门家教品牌 家教电话:010—62561255
A.①② B.③④
C.①②④ D.全部
答案: D
6.下列各种试纸,在使用时预先不能用蒸馏水润湿的是( )
A.红色石蕊试纸 B.蓝色石蕊试纸
C.碘化钾淀粉试纸 D.pH试纸
解析: pH试纸使用前不能润洗,否则可能产生误差。
答案: D
7.用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液时,下列实验操作会引起测量结果偏高的是( )
①用天平称量NaOH固体,将小烧杯放在右盘,砝码放在左盘,并移动游码,使之平衡 ②配制烧碱溶液时,将称量后的NaOH固体溶于水,立即移入容量瓶,将洗涤烧杯的液体注入容量瓶后,加蒸馏水至刻度线 ③中和滴定时,锥形瓶内有少量水 ④酸式滴定管用蒸馏水洗后,未用标准液洗 ⑤读取滴定管终点读数时,仰视刻度线
A.①②③ B.②④⑤
C.③④⑤ D.①②③④⑤
解析: ①称量药品时应遵循“左物右码”原则,因游码质量总是加到右盘上,故题中操作实验少称了NaOH固体,故所配溶液浓度偏低,消耗V标减小,使测定结果偏低。②由于NaOH溶于水时会放出大量的热,若趁热在容量瓶中定容,恢复至室温时溶液体积将减小,NaOH溶液浓度将增大,滴定同体积的NaOH时,消耗V标增大,清华北大家教中心 家教电话:010—62561255
北京一对一上门家教品牌 家教电话:010—62561255 使测定结果偏高。④V标偏高,测定结果偏高。⑤V标偏高,测定结果偏高,故应选②④⑤组合,即选B项。
答案: B
8.下列溶液蒸干后,能析出溶质固体的是( )
①FeCl3 ②Fe2(SO4)3 ③Ca(HCO3)2 ④Na2CO3
A.仅①④ B.仅②④
C.仅①② D.全部
答案: B
9.有①Na2CO3溶液 ②CH3COONa溶液 ③NaOH溶液各25 mL,物质的量浓度均为0.1 mol/L,下列说法正确的是( )
A.3种溶液pH的大小顺序是③>②>①
B.若将3种溶液稀释相同倍数,pH变化最大的是②
C.若分别加入25 mL 0.1 mol/L盐酸后,pH最大的是①
D.若3种溶液的pH均为9,则物质的量浓度大小顺序是③>①>②
解析: 相同物质的量浓度的①、②、③溶液:pH的大小顺序应为③>①>②,故A项错误。稀释相同倍数时,①、②存在水解平衡,③中pH变化最大,故B项错误。若pH相同的三种溶液,物质的量浓度大小顺序为:②>①>③,故D项错误。与25 mL 0.1 mol/L盐酸反应后①中为NaHCO3和NaCl溶液,②中为CH3COOH和NaCl溶液,③中为NaCl溶液,pH最大的是①,故C项正确。
答案: C
清华北大家教中心 家教电话:010—62561255
北京一对一上门家教品牌 家教电话:010—62561255
10.(2009·重庆理综)物质的量浓度相同的下列溶液,pH由大到小排列正确的是( )
A.Ba(OH)2、Na2SO3、FeCl3、KCl
B.Na2SiO3、Na2CO3、KNO3、NH4Cl
C.NH3·H2O、H3PO4、Na2SO4、H2SO4
D.NaHCO3、C6H5COOH、C2H5OH、HCl
解析: A项,FeCl3水解使溶液呈酸性,比KCl溶液的pH小;C项,Na2SO4溶液呈中性,H3PO4为中强酸;D项,C6H5COOH溶液呈酸性,C2H5OH显中性,故pH值排列顺序错误。正确答案选B。 答案: B
11.若1体积硫酸恰好与10体积pH=11的氢氧化钠溶液完全反应,则二者物质的量浓度之比应为( )
A.10∶1 B.5∶1
C.1∶1 D.1∶10
解析: 酸碱中和时n(H+)酸=n(OH-)碱,即:
c(H2SO4)·V[H2SO4(aq)]×2=c(NaOH)·V[NaOH(aq)],c(H2SO4)/c(NaOH)=V[NaOH(aq)]/2V[H2SO4(aq)]=10/2=5∶1。 答案: B
12.将pH=2的盐酸和pH=12的氨水等体积混合后,在所得的混合溶液中,下列关系式正确的是( )
A.c(Cl-)>c(NH4+)>c(OH-)>c(H+) B.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
清华北大家教中心 家教电话:010—62561255
北京一对一上门家教品牌 家教电话:010—62561255
C.c(NH4+)>c(Cl-)>c(H+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
解析: NH3·H2O是弱电解质,pH=2的氨水的浓度比pH=12的盐酸的浓度大得多。二者反应时,NH3·H2O过量,反应后溶液中既有NH3·H2O电离又有NH4+水解,一般是电离大于水解(首先看题目的信息,若无信息则一般是电离大于水解),溶液呈碱性,答案为D。 答案: D
13.已知Zn(OH)2的溶度积常数为1.2×10-17,则Zn(OH)2在水中物质的量浓度为( )
A.1.4×10-6 mol·L-1 B.2.3×10-6 mol·L-1
C.1.4×10-9 mol·L-1 D.2.3×10-9 mol·L-1
解析: Zn(OH)2(s)Zn2+(aq)+2OH-(aq)
Ksp[Zn(OH)2]=c(Zn2+)·[c(OH-)]2=4[c(Zn2+)]3=1.2×10-17 c(Zn2+)=1.4×10-6 mol·L-1。
答案: A
14.下列关于电解质溶液的叙述正确的是( )
A.常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为c(Cl-)>c(NH4+)>c(H+)=c(OH-)
B.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D.常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大 清华北大家教中心 家教电话:010—62561255
北京一对一上门家教品牌 家教电话:010—62561255 解析: pH=7的NH4Cl与氨水的混合溶液中,存在NH4+、H+、Cl-和OH-四种离子,根据电荷守恒原则,应存在下列等式关系:c(NH4+)+c(H+)=c(Cl-)+c(OH-),因pH=7,所以c(OH-)=c(H+),因此c(NH4+)=c(Cl-),A错;pH=4的醋酸溶液中除含H+和CH3COO-外还含有OH-,当对醋酸溶液进行稀释时,c(H+)和c(CH3COO-)减小,但根据c(H+)·c(OH-)=1×10-14知,c(OH-)将增大,故B错;中和pH与体积均相同的盐酸和醋酸时,后者消耗NaOH的物质的量多,故C错;而Na2S和NaHS同浓度时,Na2S更易水解,故其pH大。
答案: D
15.常温下,将NH4NO3溶于水得无色溶液,为使该溶液中的c(NH4+)∶c(NO3-)=1∶1,可以采取的下列措施是( )
A.加入适量的HNO3,抑制NH4+水解
B.加入适量的氨水,使溶液的pH等于7
C.加入适量的NH4NO3
D.加入适量的NaOH,使溶液的pH等于7
解析: 因为NH4+部分水解使NH4NO3溶液中c(NH4+)∶c(NO3-)<1∶1,要使c(NH4+)∶c(NO3-)=1∶1,可通过抑制水解达到目的。A中增加了NO3-;B中根据电荷守恒c(NH4+)+c(H+)=c(NO3-)+c(OH-),又pH=7,则c(NH4+)=c(NO3-);C增加NH4NO3的浓度,其比值依然小于1∶1,D中由电荷守恒:c(NO3-)+c(OH-)=c(H+)+c(NH4+)+c(Na+),因为pH=7,显然清华北大家教中心 家教电话:010—62561255
北京一对一上门家教品牌 家教电话:010—62561255 c(NO3-)≠c(NH4+)。
答案: B
16.(2011·杭州测试)今有室温下四种溶液,有关叙述不正确的是( )
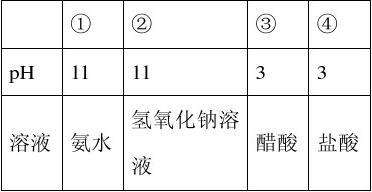
A.①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小
B.分别加入稀释10倍,四种溶液的pH ①>②>④>③ C.①、④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+)
D.Va L④与Vb L②溶液混合后,若混合后溶液pH=4,则Va∶Vb=11∶9
解析: ①④等体积混合氨水过量,溶液呈碱性,溶液中的离子浓度大小为c(NH4+) >c(Cl-)>c(OH-)>c(H+)。
答案: C
二、非选择题(本题包括4小题,共52分)
17.(10分)25 ℃时,硫氢化钾溶液里存在下列平衡:
(a)HS-+H2O
(b)HS-OH-+H2S H++S2-
(1)________是电离平衡;________是水解平衡。
(2)当向其中加入硫酸铜溶液时,生成了CuS沉淀,则电离平衡向清华北大家教中心 家教电话:010—62561255
北京一对一上门家教品牌 家教电话:010—62561255 ________移动;水解平衡向________移动;c(H+)变________(填“大”或“小”)。
(3)当向其中加入氢氧化钠固体时,c(S2-)变________(填“大”或“小”)。
(4)若将溶液加热至沸腾,c(OH-)·c(H+)将变________(填“大”或“小”)。
解析: 本题综合考查电离平衡和水解平衡。抓住题目给出的平衡的移动方向,合理判断离子浓度变化。
答案: (1)b a (2)正反应方向 逆反应方向 大
(3)大 (4)大
18.(14分)现有25 ℃时0.1 mol/L的氨水。请回答以下问题:
c?OH-(1)若向氨水中加入少量硫酸铵固体,此时溶液中c?NH3·H2O?
________(填“增大”“减小”或“不变”);
(2)若向氨水中加入稀硫酸,使其恰好中和,写出反应的离子方程式________________
________________________________________________________; 所得溶液的pH________7(填“>”“<”或“=”),用离子方程式表示其原因____________ ____________________________________________________________。
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=a mol/L,则c(SO42-)=________;
清华北大家教中心 家教电话:010—62561255
北京一对一上门家教品牌 家教电话:010—62561255
(4)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1∶1,则所得溶液中各离子物质的量浓度由大到小的关系是___________________________________
_____________________________。
解析: (1)NH3·H2ONH4++OH-,加入(NH4)2SO4固体,________ NH3·H2O的电离平衡向左移动,故c(OH-)/c(NH3·H2O)减小。(2)略。
(3)由电荷守恒,有c(NH4+)+c(H+)=2c(SO42-)+c(OH-),pH=
a7,c(H+)=c(OH-),故c(NH4+)=2c(SO42-),故c(SO42-)=2
mol/L。
(4)pH=1的硫酸,c(H+)=0.1 mol/L,H2SO4与NH3·H2O正好反应:2NH3·H2O+H2SO4 === (NH4)2SO4+2H2O,由于NH4+水解,溶液呈酸性,故有c(NH4+)>c(SO42-)>c(H+)>c(OH-)。
答案: (1)减小
(2)NH3·H2O+H+===NH4++H2O <
NH4++H2O
a(3)2L-1
(4)c(NH4+)>c(SO42-)>c(H+)>c(OH-)
19.(12分)实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:
4NH4++6HCHO3H++6H2O+(CH2)6N4H+[滴定时,1 清华北大家教中心 家教电话:010—62561255 NH3·H2O+H+
北京一对一上门家教品牌 家教电话:010—62561255 mol(CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ 称取样品1.500 g。
步骤Ⅱ 将样品溶解后,完全转移到250 mL容量瓶中,定容、充分摇匀。
步骤Ⅲ 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”“偏低”或“无影响”)。 ②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积________(填“偏大”“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察________。
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由________色变成______色。
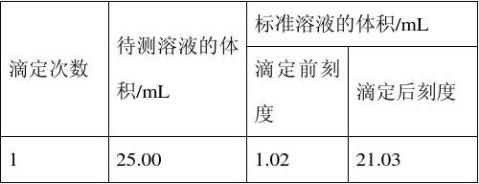
(2)滴定结果如下表所示:
清华北大家教中心 家教电话:010—62561255
北京一对一上门家教品牌 家教电话:010—62561255
若NaOH标准溶液的浓度为0.101 0 mol·L-1,则该样品中氮的质量分数为________。
解析: 由4NH4++6HCHO===3H++6H2O+(CH2)6N4H+[滴定时,1 mol(CH2)6N4H+与1 mol H+相当]可知,4 mol NH4+与甲醛反应产生的H+与(CH2)6N4H+可消耗4 mol NaOH,则消耗的NaOH的物质的量等于NH4+的物质的量,若碱式滴定管没有用标准溶液清洗,则NaOH溶液浓度变小,滴定时用去NaOH溶液的体积增加,计算出的NH4+的物质的量偏大,滴定时反应的实质为H++OH-===H2O,是物质的量相等,所以锥形瓶中加水不会影响反应结果,滴定时锥形瓶中的溶液是由酸性变为中性,在酚酞为指示剂的情况下,溶液颜色由无色变为浅粉色。N的质量分数为
v?NaOH?×c?NaOH?×10×14 g/mol×100%,NaOH的体积利用三次测得的1.5 g
平均值为20.00 mL,代入上式可得结果。
答案: (1)①偏高 ②无影响 ③B ④无 粉红(或浅红)
(2)18.85%
20.(16分)(2011·黄冈中学质检)工业制备氯化铜时,将浓盐酸加热至80 ℃左右,慢慢加入粗CuO粉末(含杂质Fe2O3、FeO),充分搅拌,使之溶解,得一强酸性的混合溶液,现欲从该混合溶液中制备纯净的CuCl2溶液,采用以下步骤[参考数据:pH≥9.6时,Fe2+完全水解成Fe(OH)2;pH≥6.4时,Cu2+完全水解成Cu(OH)2;pH≥3.7时,Fe3清华北大家教中心 家教电话:010—62561255
北京一对一上门家教品牌 家教电话:010—62561255 +完全水解成Fe(OH)3]。请回答以下问题:
(1)第一步除去Fe2+,能否直接调整pH=9.6,将Fe2+沉淀除去?________,理由是________________________________________________________________________,
有人用强氧化剂NaClO将Fe2+氧化为Fe3+:
①加入NaClO后,溶液的pH变化是________(填代号)。
A.一定增大 B.一定减小
C.可能增大 D.可能减小
②你认为用NaClO作氧化剂是否妥当?________,理由是_____________________。
现有下列几种常用的氧化剂,可用于除去混合溶液中Fe2+的有________(有几个选几个)。
A.浓HNO3 B.KMnO4
C.Cl2 D.O2
E.H2O2
(2)除去溶液中Fe3+的方法是调整溶液的pH=3.7,现有下列试剂均可以使强酸性溶液的pH调整到3.7,可选用的有________。(多选不限)
A.NaOH B.氨水
C.Cu2(OH)2CO3 D.Na2CO3
E.CuO F.Cu(OH)2
清华北大家教中心 家教电话:010—62561255
北京一对一上门家教品牌 家教电话:010—62561255 解析: 此题综合性强,考查思维的严密性和前后知识的联系。由题意可知:Fe2+沉淀的pH≥9.6,如果直接调整pH=9.6,Cu2+、Fe3+先于Fe2+沉淀(这两种离子沉淀的pH均比Fe2+沉淀的pH小),故不能直接调整pH=9.6,可将Fe2+氧化成Fe3+。NaClO在酸性条件下与Fe2+的反应是2Fe2++ClO-+2H+===2Fe3++Cl-+H2O,由于反应过程中要消耗H+,溶液pH一定升高。NaClO可以将Fe2+氧化成Fe3+,但引入了新杂质Na+,实际上不能采用。必须应用既能氧化Fe2+又不能引入新杂质的氧化剂,例如Cl2、O2、H2O2。同理,调整pH所选用的试剂可以是CuO、Cu2(OH)2CO3、Cu(OH)2等不会引入新杂质的物质。
答案: (1)不能 因Fe2+沉淀的pH最大,Fe2+沉淀完全时Cu2+、Fe3+亦沉淀 ①A ②不妥当 引入新杂质Na+ CDE
(2)CEF
清华北大家教中心 家教电话:010—62561255
