石家庄铁道大学
实 验 报 告
课程名称 分院 班 组 桌号
实验者姓名 实验日期 年 月 日
评分教师签名
一、实验目的
1、了解水热合成纳米材料的原理
2、掌握水热合成CdS纳米材料的方法及特性
二、实验原理
(一)水热法材料合成原理
水热合成法是指在特制的密闭反应釜中,以水作为溶剂,通过对反应体系加热并利用水的自身蒸汽压,创造一个相对高温高压的反应环境而进行相关化学反应的一种材料合成与处理的有效方法。依照反应类型的不同,水热法可以分为水热氧化、水热还原法、水热沉淀、水热结晶等。
一般来说,在高温高压水热体系中,水的性质将发生很大变化。例如:水的离子积和蒸汽压变高,介电常数、密度、粘度和表面张力均变低等。此时,物质在水中的物性与化学反应性能均发生很大的变化,因此水热反应与普通反应有很大的差别。一些热力学分析上可能进行,而在常温常压下受动力学条件影响进行缓慢或难于进行的反应,在水热条件下都可以进行。
相对于传统方法制备无极功能材料,水热法有以下特点: 低中温液相控制,能耗较低,且适用性广,可以合成各种形态的材料; 原料相对廉价,工艺较为简单,反应产率高,可以直接得到物相均匀、结晶完好、粒度分布窄的粉体,而且产物分散性好、纯度高;合成反应始终在密闭反应釜中进行,可控水热反应条件(前驱物形式、反应温度、反应时间等)来为产物的晶相、形貌以及纯度进行调控。
在实际应用中也常将水换为其他溶剂(也称为溶剂热法)
(二)CdS纳米材料的水热合成原理
CdS是典型的Ⅱ-Ⅵ族半导体材料,在光催化、光电转换、光电器件等方面表现出巨大的应用潜力。但纳米CdS具有很大的比表面,在常态下不稳定,若想将其特殊性付诸于应用,则需把它以某种形式与其他材料符合与组装,进而实现对CdS尺寸、粒度分布、形态及组装维数的控制。
1. 硫源的影响:本实验中作为硫源的硫脲是一种常用的有机硫源,在加热情况下,能够释放出反应所需要的硫离子。另一方面,硫脲分子与Cd2+还存在着一种配位关系,在反应体系中形成比较稳定的Cd2+ -硫脲螯合体。使得硫脲离子如果要同镉离子反应生成CdS必须要与硫脲分子展开竞争,造成的一个结果就是使得在成核阶段的反应物Cd2+离子浓度变小,并且给之后的晶体生长阶段提供浓度较为稳定的反应源。这样更有利于CdS纳米晶体沿c轴择优取向生长。
2. 修饰剂的影响:当CdS纳米粒子被有机物修饰后,其粒径大小会由于表面修饰剂的作用而发生变化,有机物阻止了CdS纳米粒子之间的相互碰撞和键
合。这是由于无机反应物同高分子之间的相互作用,在成核位置上粒子流入速度及高分子格子对反应物的空间位阻作用等三个因素对无机离子的形态、尺寸及晶型起着决定性作用。
本实验所用的修饰剂PVA分子中含有的-OH基团会与CdS产生相互作用,吸附在CdS特定的晶面上,使得该晶面的表面能降低,从而造成CdS晶体在垂直于该晶面方向的生长速度大大降低。而对于六角纤维矿结构的CdS,其(00h)面与PVA之间相互作用要弱于其它晶面。因此相对而言,PVA分子不容易吸附在(00h)晶面,而更倾向于吸附在沿[00h]方向,即c轴取向生长的CdS晶体的侧面,这样就有效的限制了侧面的生长。
另一方面,过高的PVA浓度造成对CdS表面的作用方式发生变化,高分子与高分子之间的交联作用,以及PVA分子强烈的空间位阻作用,极大的限制了反应物离子的扩散速度,降低了CdS晶粒的成核与生长速率,各晶面的生长不再具有明显的优势,使得产物CdS晶体最终的形貌发生很大改变。
3、溶剂的影响:镉(Cd)离子会同乙二胺合成Cd(en)22+。而乙二胺能够与水无限互溶,两者之间有较强的氢键作用。有较多水存在时,Cd(en)22+的形成被抑止。而该中间态络合物的结构在CdS纳米棒的形成起关键作用,其形成的四配位平面几何结构使得S2-只有上下一个优先方向接近络合物中心离子
Cd2+,因而倾向于生成CdS纳米棒。另外溶剂的介电常数对粒子的成核与生长也有重要作用。溶剂的介电常数越高,离子浓度越大,扩散能力越强,导致了离子易于向各个晶面移动,最终得到的粒子三维尺寸均较大,趋向于球状颗粒。
三、实验所用的试剂和设备
1. 实验设备:不锈钢反应釜(带聚四氟乙烯内胆)、磁力搅拌器、电热恒温干燥箱、离心机。JEM-2100型透射电镜(TEM)。
2. 实验材料:氯化镉(CdCl2·2.5H2O)、硫脲[SC(NH2)2]、聚乙烯醇(PVA,1788)、乙二胺(C2N2H8)、无水乙醇。
四、实验内容与步骤
1. CdS纳米晶粒的制备
以氯化镉为镉源,硫脲为硫源,在100ml聚四氟乙烯内衬的不锈钢反应釜里180℃下水热合成CdS粉末样品。具体操作步骤如下:
(1)分别称取不同质量的PVA(平均分子量1788)0g、1g、3g,各加1mmolCdCl2·2.5H2O及40ml蒸馏水,磁力搅拌使之完全溶解。
(2)称取3mmol硫脲超声溶解于10ml蒸馏水中。
(3)将上述两溶液混合,再添加30ml蒸馏水,磁力搅拌30min使之混合均匀。
(4)将混合溶液转入反应釜中180℃反应12h。反应完毕自然冷却。
(5)产物分别用蒸馏水和无水乙醇离心清洗数次,得到的黄色沉淀产物在真空干燥箱内干燥 。
(6)做样品的TEM照片,分析其形貌结构。
2. 溶剂对CdS纳米晶粒形貌的影响
(1)分别称取1mmolCdCl2·2.5H2O和3mmol的硫脲,将两者反应釜内胆中。
(2)加入80ml溶剂充分搅拌使其混合均匀。溶剂的水和乙二胺的比例分别为80:0,40:40,0:80,。
(3)装入反应釜密封后在180℃下恒温反应24h
(4)反应完毕自然冷却至室温,然后用蒸馏水和无水乙醇离心清洗几次,得到的产物在真空干燥箱中干燥。
(5)做样品的TEM照片,分析其形貌结构。
五、实验报告要求
1. 简述水热合成法的原理以及溶剂所起的作用。
2. 简述以上实验反应的反应机理以及CdS合成实验中的PVA对反应所起作用的可能机理。
六、问题与讨论
1. 相对于其他纳米材料的合成方法,水热法有哪些优点?
2. CdS纳米粒子合成实验中,PVA作用是什么?改变PVA的加入量会对合成产物产生什么影响?
3. 乙二胺如何影响CdS纳米晶粒的形貌?
4. 讨论实验过程和条件能否进行优化和改进。
第二篇:水热法制备TiO_2一维纳米材料研究进展
化 工 进

展
·332·
CHEMICAL INDUSTRY AND ENGINEERING PROGRESS 20xx年第30卷第2期
水热法制备TiO2一维纳米材料研究进展
李雪飞,矫庆泽,赵 芸,黎汉生
(北京理工大学化工与环境学院,北京 100081)
摘 要:TiO2一维纳米材料因其特殊的物理化学性能,在光催化、太阳能电池和传感器等方面受到广泛关注。水热法制备TiO2一维纳米材料具有简单易行、成本低、产率高等优点。本文综述了水热法制备TiO2一维纳米材料过程中原料、反应温度和反应时间、酸洗过程等反应条件对其形貌和晶体结构的影响,探讨了其形成机理及热稳定性,以期为实现TiO2一维纳米材料的形貌和晶体结构可控及应用提供借鉴。 关键词:二氧化钛;一维纳米材料;形貌;晶体结构;热稳定性;形成机理
中图分类号:TQ 050.4+21 文献标志码:A 文章编号:1000–6613(2011)02–0332–07
Hydrothermal synthesis of one-dimensional TiO2 nanomaterials
LI Xuefei,JIAO Qingze,ZHAO Yun,LI Hansheng
(School of Chemical Engineering and the Environment,Beijing Institute of Technology,Beijing 100081,China)
Abstract:One-dimensional TiO2 nanomaterials have been paid much attention for their potential applications in various fields,such as photocatalysis,solar cells and gas sensors due to their special physical and chemical properties. The synthesis of one-dimensional TiO2 nanomaterials by hydrothermal method is simple,cheap,and highly efficient. In this paper,the effect of the conditions of hydrothermal synthesis,such as raw materials,reaction temperature and time,and acid washing,on the morphology and crystal structure of the nanomaterials are reviewed,and the formation mechanism and thermal stability are also discussed in order to provide reference for controlling the morphology and crystal structure and applications of one-dimensional TiO2 nanomaterials. Key words:titanium dioxide;one-dimensional nanomaterial;morphology;crystal structure;thermal stability;formation mechanism
19xx年Ijima等[1]发现的碳纳米管显示出奇异的物理化学特性(如独特的金属或半导体导电性、极高的机械强度、储氢能力、吸附能力等),引起了人们对一维纳米材料的极大兴趣。随着研究的日益深入,SiO2、TiO2、Al2O3、V2O5、SnO2等氧化物
-
一维纳米材料[25]先后被合成出来。其中,TiO2一维纳米材料既保持了其传统的价格低廉、化学性质稳定、无毒副作用等优点,同时又增大了比表面积,
-
提高了吸附能力,可望提高TiO2在光催化[67]、太
--
阳能电池[811]、传感器[1214]、催化剂载体[15]等方面的应用性能而受到关注。
目前,TiO2一维纳米材料的制备方法主要有3种:模板法
[2,16]
水热法是Kasuga等于19xx年首先开发的,即将TiO2与高浓度的NaOH溶液(10 mol/L)充分混和后转入聚四氟乙烯内衬的高压反应釜中进行反应,得到的产物用去离子水和0.1mol/L的HCl或HNO3溶液充分洗涤即得TiO2一维纳米材料。与模板法、阳极氧化法相比,它简单易行、成本低、产率高(几乎为100%),因而成为研究的热点。
收稿日期:2010-06-23;修改稿日期:2010-07-23。
基金项目:北京理工大学基础研究基金项目(20070542001)。 第一作者:李雪飞(1983—),女,博士研究生。联系人:矫庆泽,男,教授,博士生导师,主要从事无机功能材料、工业催化、有机-无机纳米复合材料功能材料开发研究。E-mail jiaoqz@。
、阳极氧化法
[17]
和水热法
[18]
。其中,
第2期 李雪飞等:水热法制备TiO2一维纳米材料研究进展
·333·
本文作者对国内外水热法制备TiO2一维纳米材料的现状进行了阐述,包括对水热法制备TiO2一维纳米材料过程中原料、水热条件、后处理等因素对其形貌与晶体结构的影响、形成机理及热稳定性等内容,为实现TiO2一维纳米材料的形貌和结构可控及其应用提供借鉴。
1 影响TiO2一维纳米材料形貌结构的因素
水热反应后TiO2产物的形貌主要有纳米薄片、纳米管、纳米棒、纳米线等。其主要影响因素有碱的种类和浓度、反应温度和时间,另外,TiO2来源和酸洗过程对产物形貌也有一定的影响。 1.1 原料的影响
碱的种类和浓度在很大程度上影响水热产物的形貌。一般情况下,TiO2与浓NaOH溶液反应易生成纳米管,通常NaOH浓度在5~12 mol/L时均
可制备出TiO2纳米管[19-
20]。但浓KOH溶液则更利于TiO2纳米线的生成[21-
22]。Peng等[23]就提出Na+的存在和强碱性条件是纳米管生成的必备条件,KOH或NaCl不能代替NaOH与TiO2反应制备纳米管。其原因可能与反应温度和反应时间有关系,并且Ti4+在KOH溶液中的溶解度要比在同浓度NaOH溶液中高几倍,从而有利于纳米线的生成。
TiO2的来源也能在一定程度上影响水热产物的形貌。早在20xx年,Peng等[23]指出无定形TiO2不利于薄片状中间体的生成,不能作为纳米管的原材料。Yuan等[22]发现在一般的反应温度下无定形TiO2或TiOSO4反应产物不是纳米管,而是纳米线,而锐钛矿或金红石均可生成纳米管。Nakahira等[24]则发现锐钛矿比金红石更容易形成纳米管。但是,Guo等[25]则认为TiO2来源对产物的形貌影响不大,金红石、锐钛矿、无定形TiO2及其混合物甚至金属Ti等,均可用于TiO2纳米管的制备。出现以上矛盾结论的可能原因在于反应条件不同所致。
另外,粒径较小的TiO2颗粒有利于与NaOH溶液的接触反应(超声混合能够破碎TiO2原料中的大
颗粒[26])
,较易生成长度较大的纳米管。 1.2 反应温度与反应时间的影响
在一定程度上,升高反应温度与延长反应时间对TiO2与NaOH的反应作用是等效的。如Li等[7]发现升高反应温度使纳米管长度变大,与Yoshida
等[27]提出的纳米管的长度随着反应时间(t≤12 h)的延长而变大是一致的。但是,如果反应温度不能够提供反应过程中所需要的活化能,仅仅延长反应时间就是毫无意义的。
反应温度对于产物的形貌起着至关重要的作用。通常,反应温度在110~150 ℃均可以制备出TiO2纳米管[18
,28-29]
,其直径为8~10 nm,长度为
几百纳米,管壁为3~5层,并且产率随着温度升高而增大[30];
而反应温度高于170 ℃产物为纳米棒或纳米线[31],其直径约为50 nm,长度达微米级。但是温度高于170 ℃时也可能得到纳米管产物。如Seo等[32]在230 ℃条件下制备出了纳米管,在较低温度(160 ℃,200 ℃)下制备的纳米管反而管长度要小,直径要大。Peng等[33]则在170~210 ℃条件下制备出了纳米管束,并且温度越高,管束越多,并提出纳米管自身团聚形成管束可以降低能量。
产生上述矛盾的原因可能在于反应时间不同。Huang等[34]发现随着反应时间的延长,产物形貌会产生从纳米薄片到纳米管到纳米线等一系列的变化,认为高温下的反应体系能量高,能够更好地提供产物转变过程中所需的活化能,因而加速了反应进程。而在较低温度(110~150 ℃)下,反应进程则慢得多,在一般反应时间12~72 h内,体系不能够提供产物从纳米管到纳米线必需的活化能(103.8 kJ/mol),产物均为纳米管。但是,在较低温度下旋转搅拌可以加速反应,为纳米管的进一步转变提供足够的活化能[35],得到纳米线产物。 1.3 酸洗过程的影响
目前关于酸洗过程对产物形貌的影响没有统一认识。Kasuga等[28
,36-37]
认为酸洗过程是纳米管
形成的关键步骤。Hu等
[30,38-41]
则认为酸洗过程只
是一个离子交换过程,只影响产物中Na+的含量,并不影响其结构和形貌。Qamar等[42]认为酸洗过程不仅影响Na+含量的多少,结晶结构也有一定的变化。Suetake等[43]则认为酸洗过程是否影响纳米管的晶体结构和形貌取决于酸浓度的大小,较低的酸浓度可以在一定程度上保持纳米管的形貌,酸浓度过高会造成产物晶型的转变和管结构的破裂。这是与Na+的存在形式有关的,存在于纳米管晶格结构中的Na+失去会导致管结构的破裂;存在于纳米管表面的Na+很容易进行离子交换,不影响纳米管结构。
·334· 化 工 进 展 20xx年第30卷
2 影响TiO2一维纳米材料晶体结构的因素
水热法制备的TiO2一维纳米材料结晶不完整,晶体微粒之间有凝聚现象,XRD图谱峰变宽;并且纳米管稳定性差,加热、酸或其它化学试剂处理都会造成其晶型再一次发生转变。这些因素使得水热产物的具体晶体结构的确定比较困难,因此既可将
其看做是质子钛酸盐一维纳米材料,也可以看做是TiO2一维纳米材料。表1列举了目前提出的TiO2一维纳米材料的晶体结构。
反应温度是影响TiO2一维纳米材料晶体结构的主要因素,碱的种类和酸洗过程也会在一定程度上影响其晶体结构。而反应时间、TiO2的来源和碱的浓度虽然在很大程度上影响了水热产物形貌,但对于产物晶体结构的影响并未见报道。
表1 TiO2一维纳米材料的晶体结构
晶胞参数
晶体结构 锐钛矿 H2Ti3O7
HxTi2-x/4□x/4O4·H2O(x≈0.7,□ 缺位)
H2Ti2O4(OH)2
H2Ti4O9 H2Ti5O11 Na2Ti6O13
晶系
a/nmb/nmc/nmβ/(?)
XRD衍射峰
90
25.32,37.8,48.12,54.0,55.0,63.7 11,24.4,29,33,38,48.4,60,62
9.5,24.5,28,48,62 9,24.3,28,34,38,48,62
10,24,28,48 10,14,36,43,46
11.9,14.1,21.3,23.8,24.4,29.1,33.4,43.5,44.4
四方晶系0.3780.3780.952
单斜晶系1.6020.3750.919101.5正交晶系0.3781.8340.29890.0正交晶系1.9260.3780.30090.0单斜晶系1.8250.3791.201106.4单斜晶系2.0010.3761.499124.0单斜晶系15.133.80
9.21
99.2
2.1 反应温度的影响
反应温度对TiO2一维纳米材料的晶体结构起着决定性作用,一般可以分为110~130 ℃、130~170 ℃和170 ℃以上3个温度区间来考察。 2.1.1 110~130 ℃温度区间
在110~130 ℃温度条件下反应进程较缓慢,在TiO2和钛酸盐之间存在着溶解-结晶动态平衡,平衡偏向于且TiO2在NaOH溶液中的溶解度较低,
TiO2方向,因此基于XRD、EDX和SAED数据大多认为产物为锐钛矿
[18,36,44-48]
XRD、HRTEM和EDX数据,在产物组成为TiOx[49]认识的基础上,首先提出了纳米管H2Ti3O7晶体结并认为纳米管是由(100)晶面沿着[010]构模型[23],
晶轴卷曲而形成的,管轴平行于H2Ti3O7的b轴。(100)晶面是沿着[001]晶轴进但是Wu等[50]认为,
行卷曲的,这两种卷曲形式所形成的纳米管壁层间距均为0.72 nm。由于H2Ti3O7结构在各种钛酸盐晶体结构中相对稳定,其晶格参数与产物的XRD等表征结果一致,因而受到了广泛认同[20
,27,29,32,40-41,51]
。
。而Peng等[49]提出,
Mori等[52]还以第一性原理通过计算分析了H2Ti3O7纳米管的晶体结构及其形成过程。
HxTi2-x/4□x/4O4·H2O(其中x≈0.7,□为缺位)是另一种晶型的质子钛酸,属于正交晶系,由TiO6八面体共边而成的二维单层薄片结构,可以沿着[100]晶轴进行卷曲。这种晶体结构是Ma等[28
,53-54]
水热产物不是锐钛矿,不考虑H元素的存在,产物组成应为TiOx。这说明薄片状钛酸盐是纳米管形成的必须步骤,在较低温度下溶解-结晶平衡偏向于TiO2,产物晶体结构为锐钛矿,在较高温度下平衡偏向于钛酸盐,产物晶体结构为钛酸盐。 2.1.2 130~170 ℃温度区间
在130~170 ℃温度区间内,产物组成为钛酸HxTi2-x/4□4·H2O盐,其晶体结构主要包括H2Ti3O7、(x≈0.7,□为缺位)、H2Ti2O4(OH)2和H2Ti4O9。
H2Ti3O7属于单斜晶系,具有由TiO6八面体共边而成的层状结构。它的(100)晶面能够沿着[010]或[001]晶轴进行卷曲而形成纳米管。Peng等基于
基于X射线吸收精细结构图谱、Raman、ED和TG分析首先提出的,并得到了纳米尺度电子衍射图的证实[55]。但是值得注意的是,当Na+浓度很高时,HxTi2-x/4□x/4O4·H2O不像Na2Ti3O7那样可以稳定存在。但是这种结构的纳米管之所以能够稳定存在,其原因可能在于水热环境与固体焙烧法制备计量钛酸钠的环境不同。
第2期 李雪飞等:水热法制备TiO2一维纳米材料研究进展
·335·
H2Ti2O4(OH)2是质子钛酸的又一种晶体结构,属于正交晶系,其XRD衍射数据与H2Ti3O7类似,但它的两个H+均可以进行离子交换。这种晶体是
Jin和Tsai等[37,56-
57]基于酸洗过程中不同pH值下Na+的浓度对产物晶型和形貌的影响而提出来的,
得到了Chen等[34,43,
58]的认同。
Nakahira等[24]根据XRD和TEM数据提出纳米管为H2Ti4O9结构,但由于XRD峰宽度很大,不能排除产物为其它晶体结构的可能性。但这种结构仍得到了Kim等[59]的承认,并提出当反应温度为180~210 ℃时,随着产物形貌从纳米管到纳米线的转变,晶体结构也发生了相应的改变,为H2Ti5O11·H2O结构。
2.1.3 170 ℃以上温度区间
当反应温度高于170 ℃时,产物形貌会发生从纳米管到纳米线的转变,产物晶体结构也可能会相
应地发生变化[30]。
Kim等[59]就认为产物晶体结构会由H2Ti4O9转变为H2Ti5O11。
Lee等[31]提出反应温度大于160 ℃时,晶体结构为Na2Ti6O13。但是也有研究认为,产物晶体结构并不随着反应温度的改变
而变化[32,
51]。
造成以上不同结果的原因可能与反应时间有关。
2.2 其它因素的影响
碱的种类和酸洗过程对于产物的晶体结构也有一定的影响。Dong等[21]分别用浓NaOH溶液和浓KOH溶液与TiO2进行反应,产物晶体结构
分别为Na2Ti6O13和K2Ti8O17。
Qamar等[42]研究酸洗过程虽然不影响纳米管的形貌,但会影响其晶体结构,而不仅影响产物中Na+的含量。Tsai 等[37]发现纳米管对酸洗过程非常敏感,过低的pH值不仅会造成纳米管破裂,也会使晶体结构发生相应的变化。
3 水热法制备TiO2一维纳米材料的形成机理
自从19xx年Kasuga等[18]首次用水热法成功制备TiO2纳米管以来,人们对它进行了大量的研究,发现反应过程中产物会发生从纳米薄片到纳米管到纳米线等一系列的形貌变化(图1),认为TiO2一维纳米材料的形成过程可分为以下几个阶段:①TiO2与高浓度NaOH溶液作用生成纳米薄片;②纳米薄片的脱落;③纳米薄片上溶解的钛酸盐结晶形成机械张力,促使纳米薄片卷曲成管;④纳米管沿
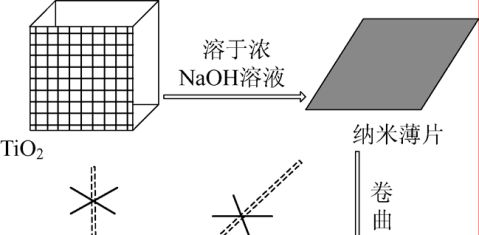
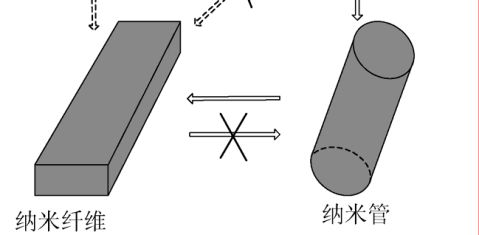
图1 纳米薄片、纳米管和纳米线的形成过程[34]
着长度方向的生长;⑤纳米管到纳米线的转变;⑥离子交换。
Kasuga等[36]认为TiO2纳米管是在酸洗过程中进行离子交换并卷曲而形成的。Ma等[28]和Tsai
等[37]支持这种说法。但是Peng等[23,49,
56]则认为纳
米管是TiO2与NaOH水热反应过程中形成的,
酸洗步骤与纳米管形成过程无关。Tsai等[57]认为产生这种分歧的原因在于反应温度和时间不同。如果反应温度较高或者反应时间较长,纳米管就可能在水热过程中形成,搅拌也会加速纳米管的形成。但如果反应温度较低,反应时间较短,水热产物仅为纳米薄片中间体,而在洗涤过程中卷曲为管。
关于纳米管形成过程中卷曲的动力,大多[30,33,44,58,
60]认为是由不平衡悬挂键产生的。水热条件下,温度越高,体系能量越高,这些不平衡的悬挂键产生的不平衡力越大。二维纳米薄片在这个不平衡力的作用下发生卷曲而形成同轴的或非同轴的纳米管,但目前所合成的纳米管均为非同轴的。如果反应温度过高,纳米管会发生团聚形成管束以降低体系能量,进而转变成为单晶纳米棒。还有一种假设[20]认为TiO2与NaOH作用生成的是多层纳米薄片,卷曲动力是溶解/结晶过程中产生的机械力。为了降低表面能,在薄片形成过程中,宽度的变化使其在多层薄片中移动而产生了机械能,造成了多层纳米薄片的卷曲。卷曲的速率与反应温度有关,可能对纳米管直径起决定性作用。但这种假设并不受普遍的认同。
当反应时间足够长特别是反应温度≥170 ℃时,产物会发生从纳米管到纳米线的转变,这可能
与高温下Ti4+在浓NaOH溶液中的溶解度较大
(170 ℃时溶解度为0.0047 mol/L,溶解焓为23 kJ/mol)有关系。而由于TiO2在浓KOH溶液中溶解度要比
·336· 化 工 进 展 20xx年第30卷
浓NaOH溶液高几倍,因而能在更大的温度范围内得到纳米线。但是,将纳米线在较低温度下再次进行水热反应不能够重新得到纳米管。这说明纳米线比纳米管稳定。有趣的是,虽然纳米管和纳米线可以在同一体系中得到,但纳米管晶轴与纳米线晶轴并不总是重合。当纳米管晶轴与纳米线晶轴不重合时,纳米线晶轴为晶体c轴,说明在这个方向上溶解/结晶速率达到了最大值。由于纳米薄片的不平衡是沿着c轴的,因此它以b轴为中心轴进行卷曲。当卷曲过程完成了一个循环,此过程不再继续,而是沿着a轴(径向)或b轴(轴向)继续生长。但在较高的温度下,纳米薄片不会发生卷曲,而是薄片厚度沿着晶轴c增长,进而破裂形成纳米线。但这种机理模型不能够解释纳米管与纳米线晶轴重合的情况,也不能够解释从纳米管到纳米线转变的过
程。为探讨此过程,Zhu和Elsanousi等[30,
61]提出了Ostwald成熟(OR)机理,认为为了降低温度升高或时间延长而增加的体系能量,纳米颗粒会沉积在纳米管的内壁和外壁,纳米棒或纳米线就是以这些纳米颗粒的消失而生长起来。Kukovecz等[35]则认为纳米线的形成是相互取向连接(OA)机理作用的
结果。OA机理是19xx年Banfield等[62-
63]首先提出来的,认为为了降低体系能量,纳米管相互取向连接而形成纳米管束,结晶开始变得粗糙而形成纳米棒或纳米线,并且温度越高,OA过程越快。但是,Huang等[34]认为OR或OA机理并不能完全解释此过程,纳米棒或纳米线的形成是OR和OA机理共同作用的结果。
4 TiO2一维纳米材料的热稳定性
虽然TiO2一维纳米材料的具体晶体结构难以确定,但在质子钛酸盐这一点上人们基本已经达成共识,其中Na+含量多少取决于后处理过程。Na+对纳米管的热稳定性、形貌和晶体结构的变化都有一定的影响[27
,40-41]
,这与Na+的存在形式有关[43]。
另外,原料也可能影响纳米管的热稳定性[41]。
总体来说,纳米线要比纳米管的热稳定性高。通常情况下,当焙烧温度T≤400 ℃时,纳米管的形貌能够得以保持,Na+含量高的产物晶型不发生改变
[64]
,Na+含量低的产物转变为TiO2(B)
[65]
或
锐钛矿[41]结构;500 ℃下焙烧纳米管开始向纳米颗粒或纳米棒[65
-66]
转变,但Na+含量高的纳米管依然
可以保持焙烧前结构和形貌;600 ℃时产物全部转
变为纳米颗粒或纳米棒,Na+含量高的产物晶型转变为Na2Ti6O13,Na+含量低的产物晶型转变为锐钛矿或金红石[67]。
关于焙烧过程中纳米管结构和形貌的变化,Zhu等[68]提出了相应的反应机理,认为纳米管焙烧过程中,表面的脱水过程使得不平衡的悬挂键增多。为了平衡这些悬挂键,TiO2纳米管自动平行排列、自我定向依附形成纳米管束,纳米颗粒在纳米晶体中自由移动或表面限制移动(表面限制移动使纳米管更容易形成纳米管束)。由于静电力的存在和纳米管之间的界面连接造成它们不易弯曲,从而造成管状结构的破裂并产生了表面紊乱,转变为晶体结构更加稳定的纳米棒。
5 结语与展望
水热法制备TiO2一维纳米材料简单易行、产率高、成本低廉的优点使其成为人们关注的焦点。水热处理后TiO2产物的形貌有纳米薄片、纳米管、纳米棒、纳米线等;TiO2一维纳米材料的晶体结构为质子钛酸盐,主要有锐钛矿、H2Ti3O7、HxTi2-x/4□4·H2O、H2Ti2O4(OH)2、H2Ti4O9、H2Ti5O11等。TiO2一维纳米材料的水热形成过程经历了纳米薄片的形成、纳米薄片的脱落、纳米薄片卷曲成管、纳米管沿着长度方向的生长、纳米管到纳米线的转变以及离子交换等过程,水热产物的形貌和晶体结构与TiO2的来源、碱的种类和浓度、酸洗过程特别是反应温度和反应时间等因素密切相关。如何实现TiO2一维纳米材料的形貌和晶体结构可控,是TiO2一维纳米材料大规模制备和应用过程中亟待解决的问题。这需要充分了解水热环境中TiO2一维纳米材料的形成机理。目前,水热法制备的TiO2一维纳米材料的形成机理仍不透彻,尚需进一步探讨,为TiO2一维纳米材料的应用奠定理论基础。
参 考 文 献
[1] Iijima S. Helical microtubules of graphitic carbon[J]. Nature,1991,
354(6348):56-58.
[2] Hoyer P. Formation of a titanium dioxide nanotube array[J].
Langmuir,1996,12(6):1411-1413.
[3] Lakshmi B B,Patrissi C J,Martin C R. Sol-gel template synthesis
of semiconductor oxide micro- and nanostructures[J]. Chemistry of Materials,1997,9(11):2544-2550.
[4] An X H,Meng G W,Wei Q,et al. SiO2 nanowires growing on
hexagonally arranged circular patterns surrounded by TiO2 films[J]. Journal of Physical Chemistry B,2006,110(1):222-226.
第2期 李雪飞等:水热法制备TiO2一维纳米材料研究进展
·337·
[5] Zhu W,Wang W Z,Xu H L,et al. Fabrication of ordered SnO2
nanotube arrays via a template route[J]. Materials Chemistry and Physics,2006,99(1):127-130.
[6] An H Q,Zhu B L,Li J X,et al. Synthesis and characterization of
thermally stable nanotubular TiO2 and its photocatalytic activity[J]. Journal of Physical Chemistry C,2008,112(48):18772-18775. [7] Li Q Y,Lu G X. Controlled synthesis and photocatalytic investigation
of different-shaped one-dimensional titanic acid nanomaterials[J]. Journal of Power Sources,2008,185(1):577-583.
[8] Adachi M,Okada I,Ngamsinlapasathian S,et al. Dye-sensitized solar
cells using semiconductor thin film composed of titania nanotubes[J]. Electrochemistry,2002,70(6):449-452.
[9] Kim D,Ghicov A,Albu S P,et al. Bamboo-type TiO2 nanotubes:
Improved conversion efficiency in dye-sensitized solar cells[J]. Journal of the American Chemical Society,2008,130(49):16454-16455.
[10] Park H,Yang D J,Kim H G,et al. Fabrication of MgO-coated TiO2
nanotubes and application to dye-sensitized solar cells[J]. Journal of Electroceramics,2009,23(2-4):146-149.
[11] Wang J,Lin Z Q. Dye-sensitized TiO2 nanotube solar cells with
markedly enhanced performance via rational surface engineering[J]. Chemistry of Materials,2010,22(2):579-584.
[12] Varghese O K,Gong D W,Paulose M,et al. Hydrogen sensing using
titania nanotubes[J]. Sensors and Actuators B:Chemical,2003,93(1-3):338-344.
[13] Varghese O K,Mor G K,Grimes C A,et al. A titania nanotube-array
room-temperature sensor for selective detection of hydrogen at low concentrations[J]. Journal of Nanoscience and Nanotechnology,2004,4(7):733-737.
[14] Seo M H,Yuasa M,Kida T,et al. Detection of organic gases using
TiO2 nanotube-based gas sensors[J]. Proceedings of the Eurosensors Xxiii Conference,2009,1(1):192-195.
[15] Ntho T A,Anderson J A,Scurrell M S. CO oxidation over titanate
nanotube supported Au:Deactivation due to bicarbonate[J]. Journal of Catalysis,2009,261(1):94-100.
[16] Hoyer P. Semiconductor nanotube formation by a two-step template
process[J]. Advanced Materials,1996,8(10):857-859. [17] Gong D,Grimes C A,Varghese O K,et al. Titanium oxide nanotube
arrays prepared by anodic oxidation[J]. Journal of Materials Research,2001,16(12):3331-3334.
[18] Kasuga T,Hiramatsu M,Hoson A,et al. Formation of titanium oxide
nanotube[J]. Langmuir,1998,14(12):3160-3163.
[19] Li W J,Fu T,Xie F,et al. The multi-staged formation process of
titanium oxide nanotubes and its thermal stability[J]. Materials Letters,2007,61(3):730-735.
[20] Bavykin D V,Parmon V N,Lapkin A A,et al. The effect of
hydrothermal conditions on the mesoporous structure of TiO2 nanotubes[J]. Journal of Materials Chemistry,2004,14(22):3370-3377.
[21] Dong Z H,Zhao Y N,Su H,et al. Hierarchical titanate nanostructures
through hydrothermal treatment of commercial titania powders[J]. Zeitschrift Fur Anorganische Und Allgemeine Chemie,2009,635(3):417-419.
[22] Yuan Z Y,Su B L. Titanium oxide nanotubes,nanofibers and
nanowires[J]. Colloids and Surfaces a-Physicochemical and Engineering Aspects,2004,241(1-3):173-183.
[23] Chen Q,Zhou W Z,Du G H,et al. Trititanate nanotubes made via a
single alkali treatment[J]. Advanced Materials,2002,14(17):1208-1211.
[24] Nakahira A,Takezoe S,Yamasaki Y. Synthesis of dense Y-zeolite
bulks with large surface area using a hydrothermal hot-pressing(HHP)process[J]. Chemistry Letters,2004,33(10):1400-1401. [25] Guo Y,Lee N H,Oh H J,et al. Structure-tunable synthesis of titanate
nanotube thin films via a simple hydrothermal process[J]. Nanotechnology,2007,18(29)
:295608. [26] Viriya-Empikul N,Sano N,Charinpanitkul T,et al. A step towards
length control of titanate nanotubes using hydrothermal reaction with sonication pretreatment[J]. Nanotechnology,2008,19(3):035601. [27] Yoshida R,Suzuki Y,Yoshikawa S. Effects of synthetic conditions
and heat-treatment on the structure of partially ion-exchanged titanate nanotubes[J]. Materials Chemistry and Physics,2005,91(2-3):409-416.
[28] Ma R Z,Bando Y,Sasaki T. Nanotubes of lepidocrocite titanates[J].
Chemical Physics Letters,2003,380(5-6):577-582.
[29] Seo H K,Kim G S,Ansari S G,et al. A study on the structure/phase
transformation of titanate nanotubes synthesized at various hydrothermal temperatures[J]. Solar Energy Materials and Solar Cells,2008,92(11):1533-1539.
[30] Lan Y,Gao X P,Zhu H Y,et al. Titanate nanotubes and nanorods
prepared from rutile powder[J]. Advanced Functional Materials,2005,15(8):1310-1318.
[31] Lee C K,Lin K S,Wu C F,et al. Effects of synthesis temperature
on the microstructures and basic dyes adsorption of titanate nanotubes[J]. Journal of Hazardous Materials,2008,150(3):494-503.
[32] Seo M H,Yuasa M,Kida T,et al. Gas sensing characteristics and
porosity control of nanostructured films composed of TiO2 nanotubes[J]. Sensors and Actuators B:Chemical,2009,137(2):513-520.
[33] Peng H R,Lia G C,Zhang Z K. Synthesis of bundle-like structure of
titania nanotubes[J]. Materials Letters,2005,59(10):1142-1145. [34] Huang J Q,Cao Y G,Huang Q F,et al. High-temperature formation
of titanate nanotubes and the transformation mechanism of nanotubes into nanowires[J]. Crystal Growth & Design,2009,9(8):3632-3637. [35] Horvath E,Kukovecz A,Konya Z,et al. Hydrothermal conversion of
self-assembled titanate nanotubes into nanowires in a revolving autoclave[J]. Chemistry of Materials,2007,19(4):927-931. [36] Kasuga T,Hiramatsu M,Hoson A,et al. Titania nanotubes prepared
by chemical processing[J]. Advanced Materials,1999,11(15):1307-1311.
[37] Tsai C C,Nian J N,Teng H S. Mesoporous nanotube aggregates
obtained from hydrothermally treating TiO2 with NaOH[J]. Applied Surface Science,2006,253(4):1898-1902.
[38] Hu W B,Li L P,Li G S,et al. Synthesis of titanate-based nanotubes
for one-dimensionally confined electrical properties[J]. Journal of Physical Chemistry C,2009,113(39):16996-17001.
·338· 化 工 进 展 20xx年第30卷
[39] Yin J B,Zhao X P. Electrorheological properties of titanate nanotube
suspensions[J]. Colloids and Surfaces a-Physicochemical and Engineering Aspects,2008,329(3):153-160.
[40] Morgado E,de Abreu M A S,Pravia O R C,et al. A study on the
structure and thermal stability of titanate nanotubes as a function of sodium content[J]. Solid State Sciences,2006,8(8):888-900. [41] Gajovic A,Friscic I,Plodinec M,et al. High temperature Raman
spectroscopy of titanate nanotubes[J]. Journal of Molecular Structure,2009,924-26:183-191.
[42] Qamar M,Yoon C R,Oh H J,et al. Preparation and photocatalytic
activity of nanotubes obtained from titanium dioxide[J]. Catalysis Today,2008,131(1-4):3-14.
[43] Suetake J,Nosaka A Y,Hodouchi K,et al. Characteristics of titanate
nanotube and the states of the confined sodium ions[J]. Journal of Physical Chemistry C,2008,112(47):18474-18482.
[44] Wang Y Q,Hu G Q,Duan X F,et al. Microstructure and formation
mechanism of titanium dioxide nanotubes[J]. Chemical Physics Letters,2002,365(5-6):427-431.
[45] Lin Y J,Wang L Y,Chiu W Y. Preparation and characterization of
titania nanotubes and hybrid materials derived from them[J]. Journal of Vacuum Science & Technology B,2005,23(6):2398-2402. [46] Xu J W,Ha C H,Cao B,et al. Electrochemical properties of anatase
TiO2 nanotubes as an anode material for lithium-ion batteries[J]. Electrochimica Acta,2007,52(28):8044-8047.
[47] Khan M A,Yang O B. Optimization of silica content in initial sol-gel
grain particles for the low temperature hydrothermal synthesis of titania nanotubes[J]. Crystal Growth & Design,2009,9(4):1767-1774.
[48] Awate S V,Sahu R K,Kadgaonkar M D,et al. Photocatalytic
mineralization of benzene over gold containing titania nanotubes:Role of adsorbed water and nanosize gold crystallites[J]. Catalysis Today,2009,141(1-2):144-151.
[49] Du G H,Chen Q,Che R C,et al. Preparation and structure analysis
of titanium oxide nanotubes[J]. Applied Physics Letters,2001,79(22):3702-3704.
[50] Wu D,Liu J,Zhao X N,et al. Sequence of events for the formation
of titanate nanotubes,nanofibers,nanowires,and nanobelts[J]. Chemistry of Materials,2006,18(2):547-553.
[51] Umek P,Cevc P,Jesih A,et al. Impact of structure and morphology
on gas adsorption of titanate-based nanotubes and nanoribbons[J]. Chemistry of Materials,2005,17(24):5945-5950.
[52] Mori M,Kumagai Y,Matsunaga K,et al. First-principles investigation
of atomic structures and stability of proton-exchanged layered sodium titanate[J]. Physical Review B,2009,79(14):144117.
[53] Ma R Z,Fukuda K,Sasaki T,et al. Structural features of titanate
nanotubes/nanobelts revealed by Raman,X-ray absorption fine structure and electron diffraction characterizations[J]. Journal of Physical Chemistry B,2005,109(13):6210-6214.
[54] Ma R Z,Sasaki T,Bando Y. Layer-by-layer assembled multilayer
films of titanate nanotubes,Ag- or Au-loaded nanotubes,and nanotubes/nanosheets with polycations[J]. Journal of the American Chemical Society,2004,126(33):10382-10388.
[55] Kubota Y,Kurata H,Isoda S. Nanodiffraction and characterization of
titanate nanotube prepared by hydrothermal method[J]. Molecular Crystals and Liquid Crystals,2006,445:107-113.
[56] Yang J J,Jin Z S,Wang X D,et al. Study on composition,structure
and formation process of nanotube Na2Ti2O4(OH)2[J]. Dalton Transactions,2003(20):3898-3901.
[57] Tsai C C,Teng H S. Structural features of nanotubes synthesized from
NaOH treatment on TiO2 with different post-treatments[J]. Chemistry of Materials,2006,18(2):367-373.
[58] Chen W P,Guo X Y,Zhang S L,et al. TEM study on the formation
mechanism of sodium titanate nanotubes[J]. Journal of Nanoparticle Research,2007,9(6):1173-1180.
[59] Kim S,Park H,Kwak C,et al. Characterization of pore structure of
mesoporous hydrogen titanium oxide hydrates[J]. Journal of Physics and Chemistry of Solids,2008,69(5-6):1139-1141.
[60] Yao B D,Chan Y F,Zhang X Y,et al. Formation mechanism of TiO2
nanotubes[J]. Applied Physics Letters,2003,82(2):281-283. [61] Elsanousi A,Elssfah E M,Zhang J,et al. Hydrothermal treatment
duration effect on the transformation of titanate nanotubes into nanoribbons[J]. Journal of Physical Chemistry C,2007,111(39):14353-14357.
[62] Penn R L,Banfield J F. Oriented attachment and growth,twinning,
polytypism,and formation of metastable phases:Insights from nanocrystalline TiO2[J]. American Mineralogist,1998,83(9-10):1077-1082.
[63] Penn R L,Banfield J F. Imperfect oriented attachment:Dislocation
generation in defect-free nanocrystals[J]. Science,1998,281(5379):969-971.
[64] Zhang H,Gao X P,Li G R,et al. Electrochemical lithium storage of
sodium titanate nanotubes and nanorods[J]. Electrochimica Acta,2008,53(24):7061-7068.
[65] Kuo H L,Kuo C Y,Liu C H,et al. A highly active bi-crystalline
photocatalyst consisting of TiO2(B)nanotube and anatase particle for producing H2 gas from neat ethanol[J]. Catalysis Letters,2007,113(1-2):7-12.
[66] Yu J G,Yu H G,Cheng B,et al. Effects of calcination temperature on
the microstructures and photocatalytic activity of titanate nanotubes[J]. Journal of Molecular Catalysis a-Chemical,2006,249(1-2):135-142.
[67] Poudel B,Wang W Z,Dames C,et al. Formation of crystallized
titania nanotubes and their transformation into nanowires[J]. Nanotechnology,2005,16(9):1935-1940.
[68] Zhu K R,Yuan Y,Zhang M S,et al. Structural transformation from
NaHTi3O7 nanotube to Na2Ti6O13 nanorod[J]. Solid State Communications,2007,144(10-11):450-453.
