一、实验室常用试剂、缓冲液的配制方法

1 M Tris-HCl(pH7.4,7.6,8.0)
组份浓度 1 M Tris-HCl
配制量 1L
配制方法 1.称量121.1 g Tris置于l L烧杯中。
2.加入约800 ml的去离子水,充分搅拌溶解。
3.按下表加入浓HCl量调节所需要的pH值。
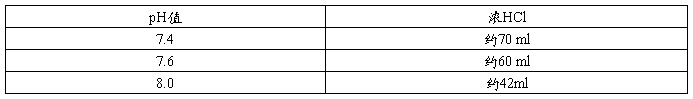
4.将溶液定容至1 L。
5.高温高压灭菌后,室温保存。
注意:应使溶液冷却至室温后再调定pH值,因为Tris溶液的pH值随温度的变化差异很大,温度每升高l℃,溶液的pH值大约降低0.03个单位。

1.5 M Tris-HCl(pH8.8)
组份浓度 1.5 MTris-HCl
配制量 1 L
配制方法 1.称量181.7 g Tris置于1 L烧杯中。
2.加入约800 ml的去离子水,充分搅拌溶解。
3.用浓HCl调节pH值至8.8。
4.将溶液定容至1 L。
5.高温高压灭菌后,室温保存。
注意:应使溶液冷却至室温后再调定pH值,因为Tris溶液的pH值随温度的变化差异很大,温度每升高l℃,溶液的pH值大约降低0.03个单位。

1 0×TE Buffer (pH7.4, 7.6,8.0)
组份浓度 100 mM Tris-HCl,10 mM EDTA
配制量 1 L
配制方法 1.量取下列溶液,置于l L烧杯中。

2.向烧杯中加入约800 ml的去离子水,均匀混合。
3.将溶液定容至1 L后,高温高压灭菌。
4.室温保存。

3 M醋酸钠(pH5.2)
组份浓度 3 M醋酸钠
配制量 100 ml
配制方法 1.称量40.8 g NaOAc·3H2O置于100~200 ml烧杯中,加入约40 ml的去离子水搅拌溶解。
2.加入冰醋酸调节pH值至5.2。
3.加去离子水将溶液定容至100 ml。
4.高温高压灭菌后,室温保存。

PBS Buffer
组份浓度 137 mM NaCl,2.7 mM KCl,10 mM Na2HPO4,2 mM KH2PO4
配制量 1 L
配制方法 1.称量下列试剂,置于l L烧杯中。
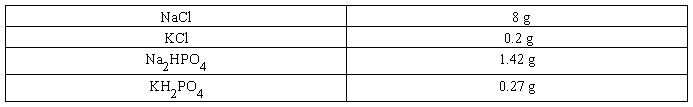
2.向烧杯中加入约800 ml的去离子水,充分搅拌溶解。
3.滴加浓HCl将pH值调节至7.4,然后加入去离子水将溶液定容至1 L。
4.高温高压灭菌后,室温保存。
注意:上述PBS Buffer中无二价阳离子,如需要,可在配方中补充1 mM CaCl2和0.5 mM MgCl2。

10 M醋酸铵
组份浓度 10 M醋酸铵
配制量 100 ml
配制方法 1.称量77.1 g醋酸铵置于100~200 ml烧杯中,加入约30 ml的去离子水搅拌溶解。
2.加去离子水将溶液定容至100 ml。
3.使用0.22 µm滤膜过滤除菌。
4.密封瓶,室温保存。
注意:醋酸铵受热易分解,所以不能高温高压灭菌。

Tris-HCl平衡苯酚
配制方法 1.使用原料:大多数市售液化苯酚是清亮无色的,无需重蒸馏便可用于分子生物学实验。但有些液化苯酚呈粉红色或黄色,应避免使用。同时也应避免使用结晶苯酚,结晶苯酚必须,160℃对其进行重蒸馏除去诸如醌等氧化产物,这些氧化产物可引起磷酸二酯键的断裂或导致RNA和DNA的交联等。因此,苯酚的质量对DNA、RNA的提取极为重要,我们推荐使用高质量的苯酚进行分子生物学实验。
2.操作注意:苯酚腐蚀性极强,并可引起严重灼伤,操作时应戴手套及防护镜等。所有操作均应在通风橱中进行,与苯酚接触过的皮肤部位应用大量水清洗,并用肥皂和水洗涤,忌用乙醇。
3.苯酚平衡:因为在酸性pH条件下DNA分配于有机相,因此使用苯酚前必须对苯酚进行平衡使其pH值达到7.8以上,苯酚平衡操作方法如下:
①液化苯酚应贮存于-20℃,此时的苯酚呈结晶状态。从冰柜中取出的苯酚首先在室温下放置使其达到室温,然后在68℃水浴中使苯酚充分融解。
②加入羟基喹啉(8-Qulnollnol)至终浓度0.1%。该化合物是一种还原剂、RNA酶的不完全抑制剂及金属离子的弱螯合剂,同时因其呈黄色,有助于方便识别有机相。
③加入等体积的1 M Tris-HCl(pH8.0),使用磁力搅拌器搅拌l5min,静置使其充分分层后,除去上层水相。
④重复操作步骤③。
⑤加入等体积的0.1 M Tris-HCl(pH8.0)。使用磁力搅拌器搅拌l5min,静置使其充分分层后,除去上层水相。
⑥重复操作步骤⑤,稍微残留部分上层水相。
⑦使用pH试纸确认有机相的pH值大于7.8。
⑧将苯酚置于棕色玻璃瓶中4℃避光保存。

苯酚/氯仿/异戊醇
配制方法 l.说明:从核酸样品中除去蛋白质时常常使用苯酚,氯仿/异戊醇(25:24:1)。氯仿可使蛋白质变性并有助于液相与有机相的分离,而异戊醇则有助于消除抽提过程中出现的气泡。
2.配制方法:将Tris-HCl平衡苯酚与等体积的氯仿/异戊醇(24:1)混合均匀后,移入棕色玻璃瓶中4℃保存。

10%(W/V)SDS
组份浓度 10%(W/V)SDS
配制量 100 ml
配制方法 1.称量10 g高纯度的SDS置于100~200 ml烧杯中,加入约80 ml的去离子水,68℃加热溶解。
2.滴加浓HCl调节pH值至7.2。
3.将溶液定容至100 ml后,室温保存。

2 N NaOH
组份浓度 2 N NaOH
配制量 100 ml
配制方法 1.量取80 ml去离子水置于100~200 ml塑料烧杯中(NaOH溶解过程中大量放热,有可能使玻璃烧杯炸裂)。
2.称取8 g NaOH小心地逐渐加入到烧杯中,边加边搅拌。
3.待NaOH完全溶解后,用去离子水将溶液定容至100 ml。
4.将溶液转移至塑料容器中后,室温保存。

2.5 N HCl
组份浓度 2.5 N HCl
配制量 100 ml
配制方法 1.在78.4 ml的去离子水中加入21.6 ml的浓HCl(11.6 N),均匀混合。
2.室温保存。

5 M NaCl
组份浓度 5 M NaCl
配制量 1 L
配制方法 1.称量292.2 g NaCl置于1 L烧杯中,加入约800 ml的去离子水后搅拌溶解。
2加去离子水将溶液定容至1 L后,适量分成小份。
3.高温高压灭菌后,4℃保存。

20%(W/V)Glucose(葡萄糖)
组份浓度 20%(W/V)Glucose
配制量 100 ml
配制方法 1.称取20 g Glucose置于100~200 ml烧杯中,加入约80 ml的去离子水后。搅拌溶解。
2.加去离子水将溶液定容至l 00 ml。
3.高温高压灭菌后,4℃保存。

Solution l (质粒提取用)
组份浓度 25 mM Tris-HCl(pH8.0),10 mM EDTA,50 mM Glucose
配制量 1 L
配制方法 1.量取下列溶液,置于l L烧杯中。
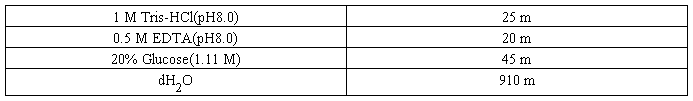
2.高温高压灭菌后,4℃保存。
3.使用前每50 ml的Solution l中加入2 ml的RNase A(20 mg/ml)。

Solution Ⅱ(质粒提取用)
组份浓度 200 mM NaOH,1%(W/V)SDS
配制量 500 ml
配制方法 1.量取下列溶液,置于500 ml烧杯中。

2.加灭菌水定容至500 ml,充分混匀。
3.室温保存。此溶液保存时间最好不要超过一个月。
注意:SDS易产生气泡,不要剧烈搅拌。

Sol ution Ⅲ(质粒提取用)
组份浓度 3 M KOAc,5 M Ethanoic acid (乙酸)
配制量 500 ml
配制方法 1.称量下列试剂,置于500 ml烧杯中。

2.加入300 ml去离子水后搅拌溶解。
3.加去离子水将溶液定容至500 ml。
4.高温高压灭菌后,4℃保存。

0.5 M EDTA (pH8.0)
组份浓度 0.5 M EDTA
配制量 1 L
配制方法 1.称取186.1 g Na2EDTA·2H2O,置于1 L烧杯中。
2.加入约800 ml的去离子水,充分搅拌。
3.用NaOH调节pH值至8.0(约20gNaOH)。
注意:pH值至8.0时,EDTA才能完全溶解。
4加去离子水将溶液定容至1 L。
5.适量分成小份后,高温高压灭菌。
6.室温保存。

1 M DTT
组份浓度 1 M DTT
配制量 20 ml
配制方法 1.称取3.09 g DTT,加入到50 ml料离心管内。
2.加20 ml的0.01 M NaOAc(pH5.2),溶解后使用0 22 µm滤膜过滤除菌。
3.适量分成小份后,-20℃保存。

10 mM ATP
组份浓度 10 mM ATP
配制量 20 mL
配制方法 1.称取121 mg Na2ATP·3H2O,加入到50 ml塑料离心管内。
2. 加20 ml的25 mM Tris-HCl(pH8.0),搅拌溶解。
3.适量分成小份后,-20℃保存。
二、蛋白质电泳相关试剂、缓冲液的配制方法

30%(W/V)Acrylamide(丙烯酰胺)
组份浓度 30%(W/V)Acrylamide
配制量 1 L
配制方法 1.称量下列试剂,置于l L烧杯中。

2.向烧杯中加入约600 ml的去离子水,充分搅拌溶解。
3.加去离子水将溶液定容至l L,用0.45 µm滤膜滤去杂质。
4.于棕色瓶中4℃保存。
注意:丙烯酰胺具有很强的神经毒性,并可通过皮肤吸收,其作用具有积累性,配制时应戴手套等。聚丙烯酰胺无毒,但也应谨慎操作,因为有可能含有少量的未聚合成份。

40%(W/V)Acrylamide
组份浓度 40%(W/V)Acrylamide
配制量 1 L
配制方法 1.称量下列试剂,置于l L烧杯中。

2.向烧杯中加入约600 ml的去离子水,充分搅拌溶解。
3.加去离子水将溶液定容至l L,用0.45 µm滤膜滤去杂质。
4.于棕色瓶中4℃保存。
注意:丙烯酰胺具有很强的神经毒性,并可通过皮肤吸收,其作用具有积累性,配制时应戴手套等。聚丙烯酰胺无毒,但也应谨慎操作,因为有可能含有少量的未聚合成份。

10%(W/V) AP (过硫酸铵)
组份浓度 10%(W/V)AP
配制量 10 ml
配制方法 1.称取1 g AP。
2.加入10 ml的去离子水后搅拌溶解。
3.贮存于4℃。
注意:1 0%过硫酸铵溶液在4℃保存时可使用2周左右,超过期限会失去催化作用。

5×Tris-Glyclne Buffer(SDS-PAGE电泳缓冲液)
组份浓度 0.125 M Tris,1.25 M Glyclne(甘氨酸),0.5%(W/V)SDS
配制量 1 L
配制方法 1.称量下列试剂,置于l L烧杯中。
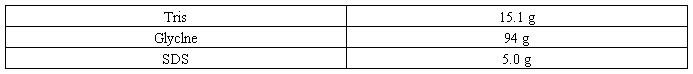
2.加入约800 ml的去离子水,搅拌溶解。
3.加去离子水将溶液定容至1 L后,室温保存。

2×SDS -PAGE Loading Buffer
组份浓度
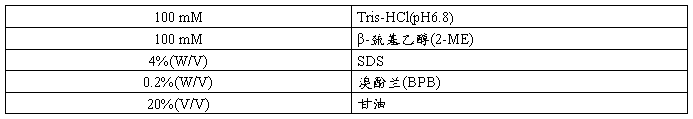
配制量 5 ml
配制方法 1.量取下列试剂,置于10 ml塑料离心管中。
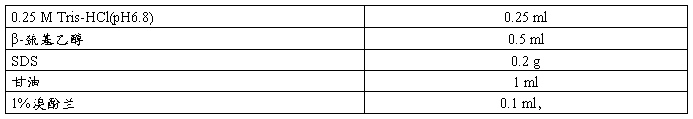
2.加去离子水溶解后定容至5 ml。
3.小份(500 µl/份)分装后,于室温保存。
4.加入2-ME的Loading Buffer可在室温下保存一个月左右

5×SDS-PAGE Loading Buffer
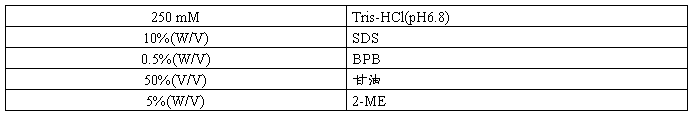
组份浓度
配制量 5 ml
配制方法 1.量取下列试剂,置于10 ml塑料离心管中。
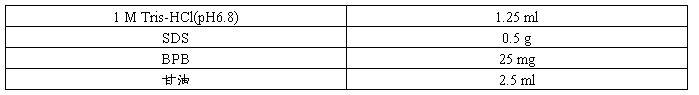
2.加去离子水溶解后定容至5 ml。
3.小份(500 µl/份)分装后,于室温保存。
4.使用前将25 µl的2-ME加到每小份中。
5.加入2-ME的Loading Buffer可在室温下保存一个月左右。

考马斯亮蓝R-250染色液
组份浓度 0.1%(W/V)考马斯亮蓝R-250,25%(V/V)异丙醇,10%(V/V)冰醋酸
配制量 1 L
配制方法 1.称取1 g考马斯亮蓝R-250,置于1 L烧杯中。
2.量取250 ml的异丙醇加入上述烧杯中,搅拌溶解。
3.加入100 ml的冰醋酸,搅拌均匀。
4.加入650 ml的去离子水,搅拌均匀。
5.用滤纸除去颗粒物质后,室温保存。

考马斯亮蓝染色脱色液
组份浓度 10%(V/V) Ethanoic acid,30%(V/V)乙醇
配制量 1 L
配制方法 1.量取下列溶液,置于l L烧杯中。
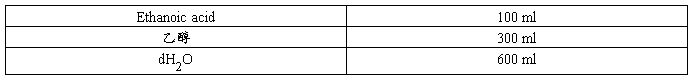
2.充分混合后使用。

凝胶固定液(SDS-PAGE银氨染色用)
组份浓度 50%(V/V)甲醇,10%(V/V) Ethanoic acid
配制量 100 ml
配制方法 1.量取下列试剂,加入100~200 ml的试剂瓶中。

2.均匀混合后室温保存。

凝胶处理液(SDS-PAGE银氨染色用)
组份浓度 50%(V/V)甲醇,10%(V/V)戊二醛
配制量 100 ml
配制方法 1.量取下列试剂,加入100~200 ml的试剂瓶中。
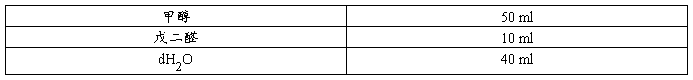
2.均匀混合后室温保存。

显影液 (SDS-PAGE银氨染色用)
组份浓度 0.005%(W/V)柠檬酸,0.02%(V/V)甲醛
配制量 1 L
配制方法 1.称量下列试剂,置于l L试剂瓶中。

2.加入1 L去离子水后,摇动混合溶解。
3.室温保存。
第二篇:缓冲溶液的配制
一、常用溶液的配制
(一)溶液配制注意事项
1.药品要有较好的质量 试剂分为优级纯(保证试剂,Guaranteed reagent,G.R.)、分析试剂(Antalytical reagent,A.R.)化学纯(Chemical pure,C.P.)和实验试剂(Laboratory reagent,L.R.)等等。工业用的化学试剂,杂质较多,只在个别情况下应用,如配洗液用的硫酸、配干燥剂的氯化钙等。
2.药品称量要精确。
3.配制试剂用水应用新鲜的去离子水或双蒸馏水,比电阻值在50万欧姆以上,pH在5.5~7.0之间才可应用,在组织培养等特殊用途时应注意此项要求,配制一般化验用溶液只要求用双蒸馏水或去离子水。
4.配好后的溶液,应立即除菌处理(如高压灭菌、抽滤或加抑菌物质),以防杂菌生长。
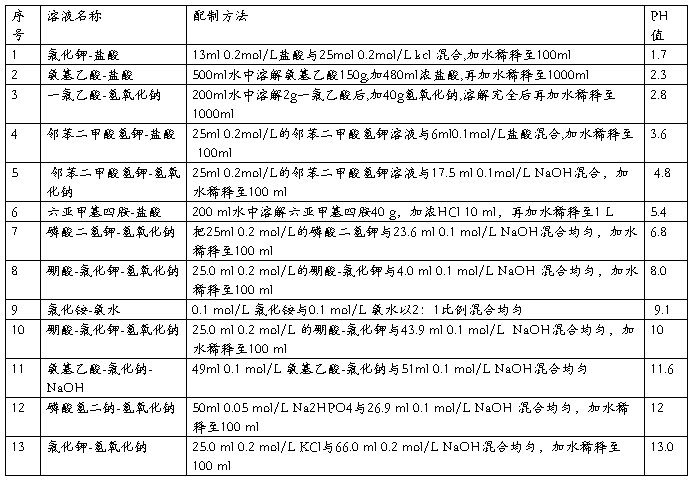
(二)0.067(1/15)Mol/L磷酸缓冲液
1.1/15Mol/L磷酸二氢钾溶液的配制:称取磷酸二氢钾(KH2PO4,A.R.)9.08g,用蒸馏水溶解后,倾入1 000ml容量瓶内,再稀释至刻度(1 000ml)。
2.1/15Mol/L磷酸二氢钠溶液的配制:称取无水磷酸氢二钠(Na2HPO4,A.R.)9.47g(或者Na2HPO4·2H2O 11.87g)用蒸馏水溶解后,放入1 000ml容量瓶内,再加蒸馏水稀释至刻度(1 000ml)。
3.按附表的比例,配制成不同pH值的缓冲溶液。
附表1 磷酸盐缓冲液配制法(单位:毫升)
pH 1/15Mol/L Na2HPO4 1/15Mol/L KH2PO4 pH 1/15Mol/L Na2HPO4 1/15Mol/L KH2PO4
5.8 8.0 92.0 7.1 66.6 23.4
5.9 9.9 90.1 7.2 72.0 28.0
6.0 12.2 87.8 7.3 76.8 23.2
6.1 15.3 84.7 7.3 80.8 19.2
6.2 18.6 81.4 7.5 84.1 15.9
6.3 22.4 77.6 7.6 87.0 13.0
6.4 26.7 73.3 7.7 89.4 10.6
6.5 31.8 68.2 7.8 91.5 8.5
6.6 37.5 62.5 7.9 93.2 6.8
6.7 43.5 56.5 8.8 94.7 5.3
6.8 49.6 50.4 8.1 95.8 4.2
6.9 55.4 44.6 8.2 97.0 3.0
7.0 61.1 38.9 8.4 98.0 2.0
(三)0.15Mol/L PB液
附表2 0.15Mol/LPB液配制法
pH 0.15Mol/L Na2HPO4(ml) 0.15Mol/L NaH2PO4(ml)
6.4 26.5 73.5
6.6 37.5 62.5
6.8 49.0 51.0
7.0 61.0 39.0
7.2 72.0 28.0
7.4 81.0 19.0
7.6 87.0 13.0
Na2HPO4·2H2O分子量=175.05 0.15Mol/L溶液含26.7g/L。
Na2HPO4·12H2O分子量=358.22 0.15Mol/L溶液含53.7g/L。
NaH2PO4·H2O分子量=138.00 0.15Mol/L溶液含20.7g/L。
NaH2PO4·2H2O分子量=156.03 0.15Mol/L溶液含23.4g/L。
(四)0.2Mol/L PB缓冲液
附表3 0.2mol/L PB缓冲液配制法
pH 0.2 Mol/L Na2HPO4(ml) 0.2Mol/L NaH2PO4(ml)
5.8 8.0 92.0
6.0 12.3 87.7
6.2 18.5 81.5
6.4 26.5 73.5
6.6 37.5 62.5
6.8 49.0 51.0
7.0 61.0 39.0
7.2 72.0 28.0
7.4 81.0 19.0
7.6 87.0 13.0
7.8 91.5 8.5
8.0 94.7 5.3
0.2Mol/L Na2HPO4·2 H2O溶液35.61g/L
Na2HPO4·12 H2O溶液含71.64g/L
0.2Mol/LNaH2PO4·H2O溶液含27.60g/L
NaH2PO4·2 H2O溶液含31.21g/L
欲配0.1Mol/L PB缓冲液则在0.2Mol/L PB缓冲液的基础上加H2O稀释1倍即可。欲配制PBS液时,则在溶液中加0.85%的NaCl溶液即可。
(五)无钙镁离子磷酸缓冲盐水(PBS)
(0.15Mol/L PH 7.2)
NaCl 8.0g
KCl 0.2g
Na2HPO4 1.15g
(如为Na2HPO4·12H2O,则为2.89g)
KH2PO4 0.2g
将上述试剂依次溶于1 000ml去离子水中,完全溶解后,115℃高压灭菌10min~15min,存在4℃冰箱中备用。此液可用于配制和稀释细胞分散剂以及洗涤细胞培养物。
(六)硼酸盐缓冲液(Borate saline buffer)
1.硼酸(H3BO3)
0.2Mol/L硼酸:硼酸12.37g加水至1 000ml。
2.硼砂(Na2B4O7)
0.05Mol/L硼砂:硼砂19.07g加水至1 000ml。
附表4 不同pH的0.2Mol/L硼酸缓冲液配制法
pH 0.05Mol/L硼砂(ml) 0.2Mol/L硼酸(ml) pH 0.05Mol/L硼砂(ml) 0.2Mol/L硼酸(ml)
7.4 1.0 9.0 8.2 3.5 6.5
7.6 1.5 8.5 8.4 4.5 5.5
7.8 2.0 8.0 8.7 6.0 4.0
8.0 3.0 7.0 9.0 8.0 2.0
(七)巴比妥缓冲液
1.pH8.2离子强度0.05Mol/L巴比妥缓冲液
巴比妥钠 47.6g
蒸馏水 3 000ml
1.17N HCl 55.0ml
(1.17 N HCl=193ml浓HCl加1 807ml蒸馏水)
⑴ 将4.76g巴比妥钠溶于3 000ml蒸馏水。
⑵ 加1.17 N HCl 55ml。
⑶ 用HCl调节pH到8.2,并加蒸馏水至4 265ml。
2.pH8.4 0.06Mol/L巴比妥缓冲液
巴比妥 1.84g
巴比妥钠 10.30g
加蒸馏水至 1 000.00ml
3.pH8.6 0.06Mol/L巴比妥缓冲液
巴比妥 1.66g
巴比妥钠 12.76g
加蒸馏水 1 000.00ml
(八)0.2Mol/L醋酸盐缓冲液 见表附表5
附表5 0.2Mol/L醋酸盐缓冲液配制法
pH 0.2Mol/L
Tris(ml) 0.1Mol/L
HCl(ml) pH 0.2Mol/L
Tris(ml) 0.1Mol/L
HCl(ml)
23℃ 37℃ 23℃ 37℃
9.10 8.95 25 5 8.06 7.90 25 27.5
8.92 8.76 25 7.5 7.96 7.82 25 30.0
8.75 8.60 25 10.5 7.87 7.73 25 32.5
8.62 8.48 25 12.5 7.77 7.63 25 35.0
8.50 8.37 25 15.5 7.66 7.52 25 37.5
8.40 8.27 25 17.5 7.54 7.40 25 40.0
8.32 8.18 25 20.0 7.36 7.22 25 42.5
(九)三羟甲基甲烷—盐酸缓冲液(Tris—HCl缓冲液)
不同pH,0.05Mol/L
25ml0.2Mol/L三羟甲基氨基甲烷加хml0.1NHCl,加水稀释至100ml(见下表)
附表6 Tris—HCl缓冲液配制法
pH 0.2Mol/L
Tris(ml) 0.1NHCl
(ml) pH 0.2Mol/L
Tris(ml) 0.1NHCl
(ml)
23℃ 37℃ 23℃ 37℃
9.10 8.96 25 5 8.05 7.90 25 27.5
8.92 8.78 25 7.5 7.96 7.82 25 30.0
8.74 8.60 25 10.0 7.87 7.73 25 32.5
8.62 8.48 25 12.5 7.77 7.63 25 35.0
8.50 8.37 25 15.0 7.66 7.52 25 37.5
8.40 8.27 25 17.5 7.54 7.40 25 40.0
8.32 8.18 25 20.0 7.36 7.22 25 42.5
8.23 8.10 25 22.5 7.20 7.05 25 45.0
8.14 8.00 25 25.0 25
三羟甲基氨基甲烷(Tris)
分子量=121.14
0.2Mol/L三羟甲基氨基甲烷:Tris24.23g,加水至1 000ml。
0.1NHCl:取HCl8.6ml,加水至1 000ml。
(十)0.5Mol/L pH9.5碳酸盐缓冲液
NaHCO3 3.70g
Na2CO3 0.60g
溶于600.00ml蒸馏水中即得。
不用时塞紧瓶塞,以免吸收空气中二氧化碳使PH下降。最好小量配制。
(十一)甘油磷酸缓冲液
1.配制pH8.0磷酸缓冲液
0.1Mol/L Na2HPO4 94.50ml
0.1N NaH2PO4 5.50ml
混合即可
2.9份甘油与1份pH8.0磷酸缓冲液混合,即为甘油磷酸缓冲液。
用途:用于免疫荧光试验。
(十二)Hank’s液
1.贮存液
NaCl 80.00g
KCl 4.00g
Na2HPO4·12 H2O 1.52g
KH2PO4 0.60g
葡萄糖 4.00g
0.4%酚红液 50.00ml
双馏水加至 100.00ml
115℃高压灭菌15min,冰冻保存。
2.工作液
贮存液 1份
双馏水 9份
115℃高压灭菌15min。临用时用灭菌的5.6%NaHCO3液调pH值至7.2左右(溶液呈橙红色)。
(十三)萘(钠)氏试剂(Nessler’s reagent)
配方1:氯化汞 6.0g
碘化钾 12.4g
20%NaOH 30ml
加蒸馏水至 100ml
配方2:碘化汞 11.5g
碘化钾 8g
蒸馏水 50ml
(完全溶解后)过滤,加20%NaOH 50ml。
用途:检测溶液中氨离子。
(十四)阿氏(Alsever’s)液
葡萄糖 2.05g
柠檬酸钠 0.80g
氯化钠 0.42g
蒸馏水 100ml
溶解后,以10%柠檬酸调节pH至6.1,过滤,分装,10磅10min灭菌,4℃保存。
(十五)青、链霉素混合液(简称S.P.液或双抗液)
青霉素(40万U) 5支
链霉素(200万μg) 1支
分别溶于100ml灭菌无离子水中或共同溶于200ml灭菌无离子水中,混合后分装小瓶,置-10℃~-20℃冰箱保存备用(1万单位μg/ml)。
临用时,按1%的量加入营养液或其他溶液中,最后浓度是青霉素100U/ml,链霉素100ug/ml。
(十六)洗液(清洁液)
配方1:重铬酸钾 150g
蒸馏水 300ml
浓硫酸 3 000ml
将重铬酸钾加入蒸馏水中,使之自然溶解或水浴溶解,亦可在大坩埚中加热溶解,然后慢慢加入浓硫酸,边加边搅拌,见发热过剧则稍停,冷却后再继续加。此为强洗液。
盛清洁液的容器要坚固,上加厚玻璃盖,操作时要穿橡皮围裙、长统胶靴、戴上眼镜和厚胶皮手套,以保安全。
洗液一旦变绿,表示铬酸已经还原,失去了氧化能力,不宜再用。如将这样洗液加热,再加适量重铬酸钾,又可重新使用。
配方2:浓硫酸 50%
蒸馏水 50%
重铬酸钾 5%
此为中等强度洗液。
配方3:重铬酸钾 100g
蒸馏水 1 000ml
加热溶解,冷却后缓慢加入
工业硫酸 100ml
此液为弱洗液,为棕红色。使用此液时,必须预先用热肥皂水将玻璃器皿洗净,经自来水冲洗,沥干然后才能浸入,否则该洗液很快失效
缓冲溶液(英文:buffer solution)是一种能在加入少量酸或碱和水时大大减低pH变动的溶液。pH缓冲系统对维持生物的正常pH值和正常生理环境起到重要作用。多数细胞仅能在很窄的pH范围内进行活动,而且需要有缓冲体系来抵抗在代谢过程中出现的pH变化。在生物体中有三种主要的pH缓冲体系,它们是蛋白质缓冲系统、重碳酸盐缓冲系统以及磷酸盐缓冲系统。每种缓冲体系所占的分量在各类细胞和器官中是不同的。
在生化研究工作中,常常需要使用缓冲溶液来维持实验体系的酸碱度。研究工作的溶液体系pH值的变化往往直接影响到研究工作的成效。如果“提取酶”实验体系的pH值变动或大幅度变动,酶活性就会下降甚至完全丧失。所以配制缓冲溶液是一个不可或缺的关键步骤。
常用作缓冲溶液
常用作缓冲溶液的酸类由弱酸及其共轭酸盐组合成的溶液具有缓冲作用。生化实验室常用的缓冲系主要有磷酸、柠檬酸、碳酸、醋酸、巴比妥酸、Tris(三羟甲基氨基甲烷)等系统,生化实验或研究工作中要慎重地选择缓冲体系,因为有时影响实验结果的因素并不是缓冲液的pH值,而是缓冲液中的某种离子。如硼酸盐、柠檬酸盐、磷酸盐和三羟甲基甲烷等缓冲剂都可能产生不需要的化学反应。
硼酸盐:硼酸盐与许多化合物形成复盐、如蔗糖。
柠檬酸盐:柠檬酸盐离子容易与钙结合,所以存在有钙离子的情况下不能使用。
磷酸盐:在有些实验,它是酶的抑止剂或甚至是一个代谢物,重金属易以磷酸盐的形式从溶液中沉淀出来。而且它在pH7.5以上时缓冲能力很小。
三羟甲基氨基甲烷:它可以和重金属一起作用,但在有些系统中也起抑制作用。其主要缺点时温度效应。这点往往被忽视,在室温pH是7.8的Tris缓冲液,4℃时是8.4,37℃时是7.4,因此,4℃配制的缓冲液在37℃进行测量时,其氢离子浓度就增加了10倍。在pH7.5以下,其缓冲能力极为不理想。
缓冲溶液组成
缓冲体系由
1、弱酸和它的盐(如HAc---NaAc)
2、弱碱和它的盐(NH3.H2O---NH4Cl)
3、多元弱酸的酸式盐及其对应的次级盐(如NaH2PO4---Na2HPO4)
的水溶液组成。
决定缓冲液pH值的因素
设缓冲系统的弱酸的电离常数为K(平衡常数),平衡时弱酸的浓度为[酸],弱酸盐的浓度为[盐],则由弱酸的电离平衡式可得下式:
[H+] = Ka {[弱酸]/[共轭碱]}
pH = pKa + log {[共轭碱]/[弱酸]}
这就是Henderson-Hasselbach 等式。
如果[弱酸] = [共轭碱],
pH = pKa
根据此式可得出下列几点结论:
1 缓冲液的pH值与该酸的电离平衡常数K及盐和酸的浓度有关。弱酸的pH值衡定,但酸和盐的比例不同时,就会得到不同的pH值。酸和盐浓度相等时,溶液的pH值与PK值相同。
2 酸和盐浓度等比例增减时,溶液的pH值不便。
3 酸和盐浓度相等时,缓冲液的缓冲效率为最高,比例相差越大,缓冲效率越低,缓冲液的一般有效缓冲范围为PK±1pH。
缓冲溶液的配制
只要知道缓冲对的PK值,和要配制的缓冲液的pH值(及要求的缓冲液总浓度),就能按公式计算[盐]和[酸]的量。这个算法涉及对数换算,较麻烦,前人为减少后人的计算麻烦,已为我们总结出pH值与缓冲液对离子用量的关系列出了表格。只要我们知道要配制的缓冲液的pH,经查表便可计算处所用缓冲剂的比例和用量。例如配制500nmpH5.8浓度为0.1M磷酸缓冲液。
经查表知pH5.8浓度为0.2M Na2HPO48.0毫升,而0.2M Na2HPO492.0毫升。依此可推论出配制100ml0.1M的磷酸缓冲液需要0.1M Na2HPO48.0毫升,而0.1M Na2HPO4需要92.0毫升。
计算好后,按计算结果准确称好固态化学成分,放于烧杯中,加少量蒸馏水溶解,转移入50ml容量瓶,加蒸馏水至刻度,摇匀,就能得到所需的缓冲液。
各种缓冲溶液的配制,均按表格按比例混合,某些试剂,必须标定配成准确浓度才能进行,如醋酸、氢氧化钠等。另外,所有缓冲溶剂的配制计量都能从以上的算式准确获得。
