第二章 误差及分析数据的统计处理
思考题答案
1 正确理解准确度和精密度,误差和偏差的概念。
答:准确度表示测定结果和真实值的接近程度,用误差表示。精密度表示测定值之间相互接近的程度,用偏差表示。误差表示测定结果与真实值之间的差值。偏差表示测定结果与平均值之间的差值,用来衡量分析结果的精密度,精密度是保证准确度的先决条件,在消除系统误差的前提下,精密度高准确度就高,精密度差,则测定结果不可靠。即准确度高,精密度一定好,精密度高,准确度不一定好。
2 下列情况分别引起什么误差?如果是系统误差,应如何消除?
(1)砝码被腐蚀; 答:系统误差。校正或更换准确砝码。
(2)天平两臂不等长; 答:系统误差。校正天平。
(3)容量瓶和吸管不配套; 答:系统误差。进行校正或换用配套仪器。
(4)重量分析中杂质被共沉淀; 答:系统误差。分离杂质;进行对照实验。
(5)天平称量时最后一位读数估计不准;答:随机误差。增加平行测定次数求平均值。
(6)以含量为99%的邻苯二甲酸氢钾作基准物标定碱溶液;
答:系统误差。做空白实验或提纯或换用分析试剂。
3 用标准偏差和算术平均偏差表示结果,哪一个更合理?
答:标准偏差。因为标准偏差将单次测定的偏差平方后,能将较大的偏差显著地表现出来。
4 如何减少偶然误差?如何减少系统误差?
答:增加平行测定次数,进行数据处理可以减少偶然误差。通过对照实验、空白实验、校正仪器、提纯试剂等方法可消除系统误差。
5 某铁矿石中含铁39.16%,若甲分析结果为39.12%,39.15%,39.18%,乙分析得39.19%,39.24%,39.28%。试比较甲、乙两人分析结果的准确度和精密度。
答:通过误差和标准偏差计算可得出甲的准确度高,精密度好的结论。

 x1= (39.12+39.15+39.18)÷3 =39.15(%) x2 = (39.19+39.24+39.28) ÷3 = 39.24(%)
x1= (39.12+39.15+39.18)÷3 =39.15(%) x2 = (39.19+39.24+39.28) ÷3 = 39.24(%)
E1=39.15-39.16 =-0.01(%) E2=39.24-39.16 = 0.08(%)
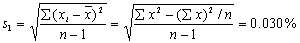
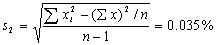
6 甲、乙两人同时分析同一矿物中的含硫量。每次取样3.5 g,分析结果分别报告为
甲:0.042%,0.041% 乙:0.04199%,0.04201% 哪一份报告是合理的?为什么?
答:甲的分析报告是合理的。因为题上给的有效数字是两位,回答也应该是两位。
第三章 滴定分析
思考题答
1. 什么叫滴定分析?它的主要分析方法有哪些?
答: 将已知准确浓度的标准溶液滴加到待测溶液中,直至所加溶液的物质的量与待测溶液的物质的量按化学计量关系恰好反应完全,达到化学计量点;再根据标准溶液的浓度和所消耗的体积,计算出待测物质含量的分析方法叫滴定分析。主要有酸碱滴定法、沉淀滴定法、配位滴定法和氧化还原滴定法。
2. 能用于滴定分析的化学反应必须符合哪些条件?
答: 反应定量进行(>99.9%);反应速率快;能用比较简便的方法如指示剂确定滴定的终点。
3.什么是化学计量点?什么是终点?
答:滴加的标准溶液与待测组分恰好反应完全的这一点称为化学计量点(stoichiometric point, sp)。指示剂变色时停止滴定的这一点为终点(end point, ed )。
4.下列物质中哪些可以用直接法配制标准溶液?哪些只能用间接法配制?
H2SO4, KOH, KMnO4, K2Cr2O7, KIO3, Na2S2O3?5H2O
答: K2Cr2O7, KIO3 用直接法配制标准溶液,其他用间接法(标定法)配制标准溶液。
5.表示标准溶液浓度的方法有几种?各有何优缺点?
答: 主要有物质的量浓度、滴定度,百分浓度等.其余略。滴定度一般用在基层实验室,便于直接用滴定毫升数计算样品的含量(克或百分数)。
6.基准物条件之一是要具有较大的摩尔质量,对这个条件如何理解?
答: 因为分析天平的绝对误差是一定的,称量的质量较大,称量的相对误差就较小。
7.若将H2C2O4?2H2O基准物长期放在有硅胶的干燥器中,当用它标定NaOH溶液的浓度时,结果是偏低还是偏高?
答:偏低。因为H2C2O4?2H2O会失去结晶水,导致称量的草酸比理论计算的多,多消耗NaOH溶液,使计算的NaOH溶液浓度偏低。
8.什么叫滴定度?滴定度与物质的量浓度如何换算?试举例说明。
答:滴定度是指与每毫升标准溶液相当的被测组分的质量或百分数。换算见公式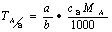
例 求0.1000mol?L-1NaOH标准溶液对H2C2O4的滴定度.
解: H2C2O4 + 2NaOH = Na2C2O4 + 2H2O
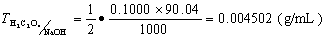
第四章 酸碱滴定法
思考题答案4—1
1. 质子理论和电离理论的最主要不同点是什么?
答:质子理论和电离理论对酸碱的定义不同;电离理论只适用于水溶液,不适用于非水溶液,而质子理论适用于水溶液和非水溶液。
2. 写出下列酸的共轭碱:H2PO4-,NH4+,HPO42-,HCO3-,H2O,苯酚。
答:HPO42-, NH3 , PO43- , CO32- , OH- , C6H5O-
3. 写出下列碱的共轭酸:H2PO4-,HC2O4-,HPO42-,HCO3-,H2O,C2H5OH。
答:H3PO4,H2C2O4,H2PO4-,H2CO3,H3O+,C2H5OH2+
4.从下列物质中,找出共轭酸碱对:
HOAc,NH4+,F-,(CH2)6N4H+,H2PO4-,CN-, OAc-,HCO3-,H3PO4,(CH2)6N4,NH3,HCN,HF,CO3-
答:HOAc-OAc-,NH4+-NH3,F--HF,(CH2)6N4H+-(CH2)6N4,H2PO4- -H3PO4,CN--HCN,,HCO3--CO3-
5. 上题的各种共轭酸和共轭碱中,哪个是最强的酸?哪个是最强的碱?试按强弱顺序把它们排列起来。
答:根据各个共扼酸的离解常数大小排列:H3PO4﹥HF﹥HOAc﹥(CH2)6N4H+﹥HCN﹥NH4+﹥HCO3-
根据各个相应共扼碱的离解常数大小排列:CO32- ﹥NH3﹥CN-﹥ (CH2)6N4﹥OAc-﹥F->H2PO4-
6. HCl要比HOAc强的多,在1mol?L-1HCl和1 mol?L-1HOAc溶液中, 那一个[H3O+]较高? 他们中和NaOH的能力哪一个较大?为什么?
答:1mol?L-1HCl溶液[H3O+]较高, 中和NaOH的能力一样大。因为HCl溶液为强酸, 完全电离, HOAc溶液为弱酸, 仅部分电离出[H3O+]; HOAc中和NaOH时, HOAc电离平衡移动到完全离解完全为止.。
7.写出下列物质在水溶液中的质子条件:(1) NH3·H2O; (2) NaHCO3;(3) Na2CO3。
答: NH3·H2O [H+]+[NH4+] = [OH-]
NaHCO3 [H+]+[H2CO3] = [CO3-]+[OH-]
Na2CO3 [HCO3-]+[H+]+2[H2CO3] = [OH-]
8. 写出下列物质在水溶液中的质子条件:
(1)NH4HCO3;(2) (NH4)2HPO4;(3) NH4H2PO4。
答:NH4HCO3 [H+]+[H2CO3] = [NH3]+[CO32-]+[OH-]
(NH4)2HPO4 [H+]+[H2PO4-]+2[ H3PO4] = [NH3]+[PO43-]+[OH-]
NH4H2PO4 [H+]+ [ H3PO4] = [NH3]+2[PO43-]+[OH-]+ [HPO42-]
9. 为什么弱酸及其共扼碱所组成的混合溶液具有控制溶液pH的能力?如果我们希望把溶液控制在(强酸性例如(pH≤2.0 或强碱性(例如pH>12.0).该怎么办?
答: 因为弱酸及其共扼碱所组成的混合溶液中有抗碱组分弱酸和抗酸组分共扼碱.所以该混合溶液在某种范围内具有控制溶液pH的能力. 如果我们希望把溶液控制在强酸性例如 (pH≤2.0 或强碱性(例如pH>12.0),可使用浓度0.01 mol?L-1以上强酸或浓度0.01 mol?L-1以上强碱.
10. 有三种缓冲溶液,他们的组成如下:
(1)1.0 mol?L-1的HOAc+ 1.0mol?L-1的NaOAc;
(2)1.0 mol?L-1的HOAc+ 0.01mol?L-1的NaOAc;
(3)0.0 1mol?L-1的HOAc+ 1.0mol?L-1的NaOAc.
这三种缓冲溶液的缓冲能力(或缓冲能量)有什么不同? 加入稍多的碱或稍多的酸时, 哪种溶液仍具有较好的缓冲作用?
答: (1)的缓冲溶液弱酸及其共扼碱浓度比为1, 且浓度大, 具有较大的缓冲能力, 当加入稍多的酸或碱时其pH变化较小; (2) 的缓冲溶液弱酸及其共扼碱浓度比为100, 其抗酸组分(NaOAc)浓度小, 当加入稍多的酸时, 缓冲能力小, 而(3) 的缓冲溶液弱酸及其共扼碱浓度比为0.01, 其抗碱组分(HOAc)浓度小, 当加入稍多的碱时, 缓冲能力小.
11.欲配制pH为3左右的缓冲溶液,应选下列何种酸及其共轭碱(括号内为pKa): HOAc(4.74),甲酸(3.74),一氯乙酸(2.86),二氯乙酸(1.30),苯酚(9.95)。
答:由应pH≈pKa可知,应选C2HClCOOH-C2HClCOO-配制pH为3左右的缓冲溶液。
12. 下列各种溶液pH=7.0,>7.0还是<7.0,为什么?
NH4NO3,NH4OAc,Na2SO4,处于大气中的H2O。
答:NH4NO3溶液pH<7.0,NH4+ 的pKa=10-9.26是弱酸; NH4OAc溶液pH=7.0,因为pKa(NH4+)≈pKb(OAc-); Na2SO4 溶液pH=7.0 , 强酸与强碱反应产物; 处于大气中的H2O的pH<7.0,因为处于大气中的H2O 中溶解有C02,饱和时pH=5.6。
思考题答案4-2
1. 可以采用哪些方法确定酸碱滴定的终点? 试简要地进行比较。
答:可以用酸碱指示剂法和电位滴定法确定酸碱滴定的终点。用酸碱指示剂法确定酸碱滴定的终点,操作简单,不需特殊设备,使用范围广泛;其不足之处是各人的眼睛辨别颜色的能力有差别,不能适用于有色溶液的滴定,对于较弱的酸碱,终点变色不敏锐。用电位滴定法确定酸碱滴定的终点,需要特殊成套设备,操作过程较麻烦,但适用于有色溶液的滴定,克服了人为的因素,且准确度较高。
2.酸碱滴定中指示剂的选择原则是什么?
答:酸碱滴定中指示剂的选择原则是使指示剂的变色范围处于或部分处于滴定的pH突跃范围内;使指示剂的变色点等于或接近化学计量点的pH。
3.根据推算,各种指示剂的变色范围应为几个pH单位? 表4—3所列各种指示剂的变色范围是否与推算结果相符? 为什么? 举二例说明之。
答:根据指示剂变色范围公式,pH=pKHin±1,各种指示剂的变色范围应为2个pH单位,表4—3所列各种指示剂的变色范围与推算结果不相符,其原因是人眼辨别各种颜色的敏锐程度不同。例如,甲基橙理论变色范围是pH在2.4~4.4,实际为3.1~4.4(红-黄);中性红理论变色范围是pH在6.4~8.4(红-黄橙),实际为6.8~8.0,是因为人眼对红色比较敏感的缘故。
4.下列各种弱酸、弱碱,能否用酸碱滴定法直接测定?如果可以,应选用哪种指示剂?为什么?
(1) CH2ClCOOH,HF,苯酚,羟胺,苯胺。(2) CCl3COOH,苯甲酸,吡啶,六亚甲基四胺。
答:(1)CH2ClCOOH,HF,苯酚为酸,其pKa分别为2.86,3.46,9.95。
CH2ClCOOH,HF很容易满足cKa≥10-8的准确滴定条件,故可用NaOH标准溶液直接滴定,以酚酞为指示剂。苯酚的酸性太弱,cKa<10-8不能用酸碱滴定法直接测定。
羟胺,苯胺为碱,其pKb分别为8.04, 9.34, 羟胺只要浓度不是太稀,可以满足cKb≥10-8的准确滴定条件,故可用HCl标准溶液直接滴定,以甲基橙为指示剂。苯胺的碱性太弱,不能用酸碱滴定法直接测定。(2)CCl3COOH,苯甲酸为酸,其pKa分别为0.64和4.21,很容易满足cKa≥10-8的准确滴定条件,故可用NaOH标准溶液直接滴定,以酚酞为指示剂。
吡啶,六亚甲基四胺为碱,其pKb分别为8.77和8.85,不能满足cKb≥10-8的准确滴定条件,故不能用酸碱滴定法直接测定。
5. 下列各物质能否用酸碱滴定法直接滴定? 如果能够,应选用什么指示剂?
NaF. NaOAc, 苯甲酸钠, 酚钠(C6H5ONa), 盐酸羟胺(NH2OH·HCl)
答: 设各溶液的浓度均为0.1 mol?L-1, NaF 的Kb=10-14/(3.2×10-4) =3.1×10-11, cKb<10-8,不能用酸碱滴定法直接滴定; NaOAc的 Kb=10-14/(1.8×10-5) = 5.6×10-10, cKb<10-8,不能用酸碱滴定法直接滴定; 酚钠(C6H5ONa) Kb=10-14/(1.1×10-10) = 9.1×10-5, cKb>10-8, 能用酸碱滴定法直接滴定, 用甲基橙指示剂; 盐酸羟胺(NH2OH·HCl) 的 Ka=10-14/(9.1×10-9) =1.1×10-6, cKa>10-8, 能用酸碱滴定法直接滴定, 用酚酞指示剂.
6.用NaOH溶液滴定下列各种多元酸时会出现几个滴定突跃? 分别应采用何种指示剂指示终点?
H2S04,H2S03,H2C204,H2C03,H3P04
答:根据是否符合cKa≥10-8和cKa1/cKa2≥104能够进行准确滴定和分别滴定的条件进行判断, 其中H2S03和H3P04当浓度不低于0.1mol/L时符合前述准确滴定和分别滴定条件,结论见下表:
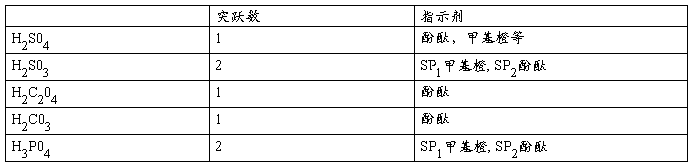
7. 根据分布曲线并联系Ka1/Ka2的比值说明下列二元酸能否分步滴定:H2C2O4, 丙二酸, 顺丁烯二酸,琥王白酸。
答: H2C2O4的Ka1/Ka2=5.9×10-2/ 6.4×10-5= 9.2×102<104, 不能分步滴定; 丙二酸ΔpKa=2.36<4,不能分步滴定; 顺丁烯二酸,ΔpKa= 4.08>4(见P80),从表4-7看出在pH2.86~4.72范围内是三种组分共存,从图4-8看出出现二个滴定突跃;琥王白酸,Ka1/Ka2=6.4×10-5/ 2.7×10-6 = 2.4×101<104, 不能分步滴定.
8.为什么NaOH标准溶液能直接滴定醋酸,而不能直接滴定硼酸? 试加以说明。
答:因为醋酸的pKa为4.74,可满足cKa≥10-8的准确滴定条件,故可用NaOH标准溶液直接滴定;硼酸的pKa为9.24,不能满足cKa≥10-8的准确滴定条件,故不能用NaOH标准溶液直接滴定。
9.为什么HCI标准溶液可直接滴定硼砂,而不能直接滴定蚁酸钠? 试加以说明。
答:硼砂溶于水的反应为:B4O72- + 5H2O = 2H2BO3- + 2H3BO3 H2BO3-是H3BO3的共轭碱,故H2BO3-的pKb=14-9.24 = 4.76,它是一个中强碱,可以满足cKb≥10-8的准确滴定条件,故可用HCl标准溶液直接滴定。蚁酸钠是蚁酸的共轭碱,pKb=14-3.74=10.26,Kb很小,不能满足cKb≥10-8的准确滴定条件,故不可用HCl标准溶液直接滴定。
10.下列混合酸中的各组分能否分别直接滴定?如果能够,应选用何种指示剂指示终点.
(1) 0.1mol·L-1HCl + 0.1 mol·L-1H3BO3; (2) 0.5 mol·L-1H3PO4 + 0.5 mol·L-1H2SO4
答: (1) 中硼酸的pKa为9.24, 太弱, 只能滴定其中HCl. (2) 中H3PO4的pKa1= 2.12, pKa2 =7.20, Ka1/Ka2>104, H2SO4的pKa2 = 1.99, 可分步滴定, 第一步滴定的是磷酸第一级离解的氢离子和硫酸离解的全部氢离子, 第二步滴定的是磷酸第二级离解的氢离子, 第一计量点可用溴甲酚绿和甲基橙混合指示剂, 第二计量点使用酚酞和百里酚酞混合指示剂.
11. 下列混合碱能否直接滴定?如果能够,应如何确定终点?并写出各组分含量的计算式(以g·mL-1表示)。 (1)NaOH + NH3·H2O;(2)NaOH + Na2CO3.
答:(1)NaOH为强碱,KNH3·H2O=1.8×10-5,能用HCl标准溶液分别滴定,第一计量点使用酚酞指示剂,消耗体积为V1,第二计量点用甲基橙指示剂,消耗体积为V2,计算式如下:
w(NaOH) = c(HCl)V1(HCl)M(NaOH) ×10-3/V(样)
w(NH3·H2O) = c(HCl)V2(HCl)M(NH3·H2O) ×10-3/V(样)
(2) NaOH为强碱,K CO32 -=1.8×10-4, 能用HCl标准溶液分别滴定,但误差较(1)大,第一计量点使用酚酞指示剂,消耗体积为V1,第二计量点用甲基橙指示剂,消耗体积为V2,计算式同上。
思考题答案4-3
1.NaOH标准溶液如吸收了空气中的CO2,当以其测定某一强酸的浓度,分别用甲基橙或酚酞指示终点时,对测定结果的准确度各有何影响?
答:NaOH标准溶液如吸收了空气中的CO2,会变为Na2CO3, 当用酚酞指示终点时,Na2CO3与强酸只能反应到NaHCO3, 相当于多消耗了NaOH标准溶液,此时,测定强酸的浓度偏高。
如用甲基橙指示终点时,NaOH标准溶液中的Na2CO3可与强酸反应生成CO2和水,此时对测定结果的准确度无影响。
2.当用上题所述的NaOH标准溶液测定某一弱酸浓度时,对测定结果有何影响?
答:当测定某一弱酸浓度时,因SP在碱性范围,只能使用酚酞指示终点,故测定弱酸的浓度偏高。
3.标定NaOH溶液的浓度时,若采用:〈1)部分风化的H2C204·2H2O;(2)含有少量中性杂质的H2C204·2H2O;则标定所得的浓度偏高,偏低,还是准确? 为什么?
答:(1)因为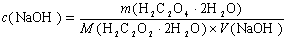
当H2C204·2H2O有部分风化时,V(NaOH)增大,使标定所得NaOH的浓度偏低。
(2)当H2C204·2H2O含有少量中性杂质时,V(NaOH)减少,使标定所得NaOH的浓度偏高。
4.用下列物质标定HCl溶液浓度:
(1)在110℃烘过的Na2C03;(2)在相对湿度为30%的容器中保存的硼砂,则标定所得的浓度偏高,偏低,还是准确? 为什么?
答:(1)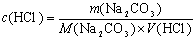
Na2C03应在270℃烘干,当用110℃烘过的Na2C03作基准物时,Na2C03中可能有一些水分,滴定时消耗HCl溶液减少,使标定HCl溶液浓度偏高。
(2)当空气相对湿度小于30%时,硼砂容易失去结晶水,故用在相对湿度为30%的容器中保存的硼砂标定HCl溶液浓度时,会使标定HCl溶液浓度偏低。
5.用蒸馏法测定NH3含量,可用过量H2SO4吸收,也可用H3B03吸收,试对这两种分析方法进行比较。
答:在用过量H2SO4吸收NH3时,要用H2SO4标准溶液,H2SO4的量要准确计量,需用NaOH标准溶液滴定过量H2SO4,用甲基红作指示剂;用H3B03吸收NH3时,H3B03的量无须准确计量,只要过量即可。生成的H2B03- 要用HCl标准溶液滴定,而过量的H3B03不会被HCl标准溶液滴定。
6.今欲分别测定下列混合物中的各个组分,试拟出测定方案(包括主要步骤、标准溶液、指示剂和含量计算式,以g·mL-1表示)。
(1) H3B03 + 硼砂; (2) HCI + NH4C1;
(3) NH3·H20 + NH4Cl; (4) NaH2P04 + Na2HP04;
(5) NaH2P04 + H3P04; (6) NaOH + Na3P04。
答:(1)硼酸 + 硼砂
用HCl标准溶液滴定,以MR(甲基红)为指示剂,滴定其中的硼砂,消耗体积为V1,再加入甘露醇,使H3BO3强化,用NaOH滴定,以PP(酚酞)为指示剂,消耗体积为V2。
w硼砂 = 1/2·c (HCl)V1(HCl)M(硼砂) ×10-3/V(样),
w硼酸 = c (HCl)V2(HCl)M(硼酸) ×10-3/V(样),
(2)HCl + NH4Cl
用NaOH标准溶液滴定,以MR为指示剂,滴定其中的HCl,消耗体积为V1。再用甲醛法测定NH4Cl,以PP为指示剂,消耗NaOH标准溶液体积为V2。
W HCl = c(NaOH)V1(NaOH)M(HCl) ×10-3/V(样),
W NH4Cl = c(NaOH)V2(NaOH)M(NH4Cl) ×10-3/V(样),
(3)NH3·H20 + NH4Cl;
用HCI标准溶液滴定NH3·H20,以甲基红为指示剂,测NH3·H20量,消耗体积为V1;再继续加过量甲醛后用NaOH滴定,用酚酞作指示剂,消耗NaOH体积为V2,测得二者总量。
w (NH3·H20)= c(HCl)V1(HCl)M(NH3·H20) ×10-3/V(样),
w (NH4Cl) =[c(NaOH)V2(NaOH)M(NH4Cl)-c (HCl)V1(HCl)M(NH3·H20)] ×10-3/V(样),
(4) NaH2P04 + Na2HP04
用NaOH标准溶液滴定NaH2P04,以酚酞和百里酚酞为指示剂,测NaH2P04量,消耗体积为V1;再加入氯化钙溶液继续用NaOH标准溶液滴定释放出的氢离子,消耗NaOH体积为V2,
w (NaH2P04)= c (NaOH)V1 (NaOH)M(NaH2P04) ×10-3/V(样),
w (Na2HP04)= [c(NaOH)V2 (NaOH)]M(NaHP04)-c (NaOH)V1 (NaOH)]M(NaH2P04)] ×10-3/V(样),
(5) NaH2P04 + H3P04
用NaOH标准溶液滴定H3P04,以溴甲酚绿和甲基橙为指示剂,测H3P04量,消耗体积为V1;以酚酞和百里酚酞为指示剂,测NaH2P04量,消耗NaOH体积为V2;
w (H3P04) = c (NaOH)V1 (NaOH)M(H3P04) ×10-3/V(样),
w NaH2P04= [c (NaOH)V2 (NaOH)]M(NaH2P04)-c (NaOH)V1 (NaOH)]M(H3P04)] ×10-3/V(样),
(6) NaOH+Na3P04
一份用HCl标准溶液滴定,以酚酞和百里酚酞为指示剂,滴定NaOH+Na3P04的总量,消耗体积为V1,另一份加入氯化钙溶液,滤去磷酸钙沉淀,用HCl标准溶液滴定,以酚酞为指示剂,滴定NaOH的量,消耗体积为V2,
w(NaOH) = c (HCl)V2(HCl)M(NaOH) ×10-3/V(样),
w(Na3P04) = c (HCl)(V1-V2)(HCl)M(Na3P04) ×10-3/V(样),
7.有一碱液,可能是NaOH、Na2C03、NaHC03或它们的混合物,如何判断其组分,并测
定各组分的浓度?说明理由。
答:移取碱液25.00mL,加1~2滴酚酞,用HCl标准溶液滴定至红色变为无色,记下消耗的HCl标准溶液的体积V1 mL,在上述溶液中再加1~2滴甲基橙指示剂,继续用HCl溶液滴定,滴定至溶液由黄色变橙色,即为终点,记下消耗的HCl溶液的体积V2 mL。根据V1与V2的大小可判断混合碱的组成。
(1) V1 = V2时,组成为Na2C03 c(Na2C03) =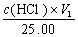
(2)V1 = 0,V2≠ 0时,组成为NaHC03, c (NaHC03) =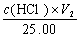
(3)V2 = 0,V1≠ 0时,组成为Na0H c (Na0H)=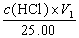
(4 ) V1>V2时,组成为Na2C03和Na0H c (Na0H) =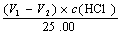 c (Na2C03)=
c (Na2C03)=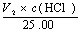
(5)V1<V2时,组成为Na2C03和NaHC03,
c (NaHC03)=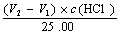 c (Na2C03) =
c (Na2C03) =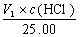
8.有一溶液,可能是Na3P04、Na2HP04、NaH2P04、或他们的混合物,如何判断其组分,并测定各组分的含连量?说明理由。
答:用双指示剂法:称取样品G克,溶解后稀至250.0毫升,移取溶液25.00mL,加1~2滴酚酞和百里酚酞混合指示剂,用HCl标准溶液滴定至由紫色变为无色,记下消耗的HCl标准溶液的体积V1mL,在上述溶液中再加1~2滴溴甲酚绿和甲基橙混合指示剂,继续用HCl溶液滴定,滴定至溶液由蓝绿色变为橙色,即为终点,记下消耗的HCl溶液的体积V2 mL。根据V1与V2的大小可判断混合碱的组成。
( 1 ) V1= V2时,组成为Na3P04
w(Na3P04)= [c (HCl)V1(HCl)M(Na3P04) ×10-3/(G × 25.00/250.0)] ×100%
(2) V1= 0,V2 ≠ 0时,组成为Na2HP04,
w(Na2HP04)= [c (HCl)V2(HCl)M(Na2HP04) ×10-3/(G ×25.00/250.0)] ×100%
(3) V1= 0,V2 = 0时,不被滴定,组成为NaH2P04
(4) V1<V2时,组成为Na3P04和Na2HP04,
w(Na3P04) = [c (HCl)V1(HCl)M(Na3P04) ×10-3/(G ×25.00/250.0)] ×100%
w(Na2HP04) = [c (HCl)(V2-V1)(HCl)M(Na2HP04) ×10-3/(G ×25.00/250.0)] ×100%
第五章 配位滴定法
思考题答案
1.EDTA与金属离子的配合物有哪些特点?
答:(1)EDTA与多数金属离子形成1︰1配合物;(2)多数EDTA-金属离子配合物稳定性较强(可形成五个五原子环); (3)EDTA与金属配合物大多数带有电荷,水溶性好,反应速率快;(4)EDTA与无色金属离子形成的配合物仍为无色,与有色金属离子形成的配合物颜色加深。
2.配合物的稳定常数与条件稳定常数有何不同?为什么要引用条件稳定常数?
答:配合物的稳定常数只与温度有关,不受其它反应条件如介质浓度、溶液pH值等的影响;条件稳定常数是以各物质总浓度表示的稳定常数,受具体反应条件的影响,其大小反映了金属离子,配位体和产物等发生副反应因素对配合物实际稳定程度的影响。
3.在配位滴定中控制适当的酸度有什么重要意义?实际应用时应如何全面考虑选择滴定时的pH?
答:在配位滴定中控制适当的酸度可以有效消除干扰离子的影响,防止被测离子水解,提高滴定准确度。具体控制溶液pH值范围时主要考虑两点:(1)溶液酸度应足够强以消去干扰离子的影响,并能准确滴定的最低pH值;(2)pH值不能太大以防被滴定离子产生沉淀的最高pH值。
4.金属指示剂的作用原理如何?它应该具备那些条件?
答:金属指示剂是一类有机配位剂,能与金属形成有色配合物,当被EDTA等滴定剂置换出来时,颜色发生变化,指示终点。金属指示剂应具备如下条件:(1)在滴定的pH范围内,指示剂游离状态的颜色与配位状态的颜色有较明显的区别;(2)指示剂与金属离子配合物的稳定性适中,既要有一定的稳定性K’MIn>104,又要容易被滴定剂置换出来,要求K’MY/K’MIn ≥104(个别102);(3)指示剂与金属离子生成的配合物应易溶于水;(4)指示剂与金属离子的显色反应要灵敏、迅速,有良好的可逆性。
5.为什么使用金属指示剂时要限定适宜的pH?为什么同一种指示剂用于不同金属离子滴定时,适宜的pH条件不一定相同?
答:金属指示剂是一类有机弱酸碱,存在着酸效应,不同pH时指示剂颜色可能不同,K’MIn不同,所以需要控制一定的pH值范围。指示剂变色点的lgK’Min应大致等于pMep, 不同的金属离子由于其稳定常数不同,其pMep也不同。金属指示剂不象酸碱指示剂那样有一个确定的变色点。所以,同一种指示剂用于不同金属离子滴定时,适宜的pH条件不一定相同。
6.什么是金属指示剂的封闭和僵化?如何避免?
答:指示剂-金属离子配合物稳定常数比EDTA与金属离子稳定常数大,虽加入大量EDTA也不能置换,无法达到终点,称为指示剂的封闭,产生封闭的离子多为干扰离子。消除方法:可加入掩蔽剂来掩蔽能封闭指示剂的离子或更换指示剂。指示剂或指示剂-金属离子配合物溶解度较小, 使得指示剂与滴定剂的置换速率缓慢,使终点拖长,称为指示剂的僵化。消除方法:可加入适当有机溶剂或加热以增大溶解度。
7.两种金属离子M和N共存时,什么条件下才可用控制酸度的方法进行分别滴定?
答:当 cM= cN 时,lgcM K’MY= ΔlgK。若ΔpM=±0.3,Et≤±0.1%,则lgcMK’MY≥6,ΔlgK≥6;ΔpM=±0.3,Et ≤±0.5%, 则lgcMK’MY≥5, ΔlgK≥5;ΔpM=±0.3,Et≤±1%,则lgcM K’MY≥4, ΔlgK≥4;才可用控制酸度的方法进行分别滴定。
8.掩蔽的方法有哪些?各运用于什么场合?为防止干扰,是否在任何情况下都能使用掩蔽方法?
答:配位掩蔽法、沉淀掩蔽法、氧化还原掩蔽法。有时用掩蔽法亦无法解决问题,可用预先分离法。配位掩蔽法用于干扰离子与掩蔽剂形成很稳定配合物时,沉淀掩蔽法用于沉淀剂能和干扰离子形成溶解度很小的沉淀时,氧化还原掩蔽法用于氧化还原反应能使干扰离子变更价态以消除其干扰时。当存在干扰离子不能使用控制酸度方法进行滴定时才使用掩蔽方法。
9.用EDTA滴定含有少量Fe3+的Ca2+和Mg2+试液时,用三乙醇胺、KCN都可以掩蔽Fe3+,抗坏血酸则不能掩蔽;在滴定有少量Fe3+存在的Bi3+时,恰恰相反,即抗坏血酸可以掩蔽Fe3+,而三乙醇胺、KCN则不能掩蔽?请说明理由?
答: Ca2+、Mg2+滴定条件为碱性, Bi3+滴定条件为强酸性;KCN仅能用于碱性条件掩蔽Fe3+,若在酸性溶液中加入将产生剧毒的HCN,对环境和人有严重危害,三乙醇胺须在酸性溶液中加入,然后再碱化掩蔽Fe3+,否则Fe3+将生成氢氧化物沉淀而不能被配位掩蔽;抗坏血酸只能在酸性条件掩蔽Fe3+。
10.如何利用掩蔽和解蔽作用来测定Ni2+、Zn2+、Mg2+混合溶液中各组分的含量?
答:在碱性条件下,加入过量KCN掩蔽,控制溶液pH=10.0,EBT指示剂,可用EDTA标准溶液滴定Mg2+;加入HCHO解蔽出Zn2+离子,pH=5.0,XO指示剂,可用EDTA标准溶液滴定Zn2+;另取一份溶液,调节溶液pH值在5~6,XO指示剂,滴定出Ni2+、Zn2+总量,扣除Zn2+含量,即得Ni2+含量。
11.配位滴定中,在什么情况下不能采用直接滴定方式? 试举例说明之?
答:不能直接滴定的条件主要有三种:(1)待测离子与EDTA配位反应速率较慢,或本身易水解,或能封闭指示剂,如Al3+、Cr3+等;(2)滴定反应缺乏变色敏锐的指示剂,如Ba2+、Sr2+等的滴定;(3)待测离子与EDTA不能形成配合物或形成的配合物不稳定,如碱金属。
12.欲测定含Pb2+、Al3+和Mg2+试液中的Pb2+含量,共存的二种离子是否有干扰?应如何测定Pb2+含量?试拟出简要方案。
答:logKMgY=8.69, logKPbY=18.04, logKAlY=16.3, Mg2+与Pb2+稳定常数对数相差较大,大于5, Mg2+ 不干扰;但Al3+与Pb2+ 稳定常数相差较小,有干扰作用。
测定方法:调溶液pH=5~6,加入过量NH4F掩蔽Al3+,以二甲酚橙为指示剂,用EDTA标准溶液滴定Pb2+。
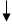 EDTA
EDTA
Al3+ pH=5~6 AlF63- 二甲酚橙 PbY

 Pb2+ Pb2+ Mg2+
Pb2+ Pb2+ Mg2+
Mg2+ 过量NH4F Mg2+ AlF63-
13.若配制EDTA溶液时所用的水中含有Ca2+,则下列情况对测定结果有何影响?
(1) 以CaCO3为基准物质标定EDTA溶液,用所得EDTA标准溶液滴定试液中的Zn2+,以二甲酚橙为指示剂;
(2) 以金属锌为基准物质,二甲酚橙为指示剂标定EDTA溶液。用所得EDTA标准溶液滴定试液中Ca2+的含量;
(3)以金属锌为基准物质,铬黑T为指示剂标定EDTA溶液。用所得EDTA标准溶液滴定试液中Ca2+的含量。
答:(1)以CaCO3为基准物质标定EDTA溶液时pH≥12.0,水中钙离子与EDTA络合, 消耗部分EDTA, 从公式c (EDTA) = [m/M(CaCO3)] ×10-3/V (EDTA)看出,使标定EDTD浓度偏低, 而以二甲酚橙为指示剂,用所得EDTA标准溶液滴定试液中的Zn2+时,pH=5~6,此时EDTA不与钙离子反应,因此用所得EDTA标准溶液滴定试液中的Zn2+时使测定结果偏低;(2)以金属锌为基准物质,二甲酚橙为指示剂标定EDTA溶液时pH≈5.0~6.0, 水中含有的Ca2+不与EDTA反应, 标定的EDTA浓度准确, 用所得EDTA标准溶液滴定试液中Ca2+的含量时pH≥12.0, 此时水中钙离子与EDTA络合, 消耗部分EDTA, 因此用所得EDTA标准溶液滴定试液中Ca2+的含量时使测定结果偏高;(3)以金属锌为基准物质,铬黑T为指示剂标定EDTA溶液时pH≈10.0 (NH3-NH4缓冲液), 水中钙离子与EDTA络合, 消耗部分EDTA, 使标定EDTD浓度偏低, 用所得EDTA标准溶液滴定试液中Ca2+的含量时pH≥12.0, 此时EDTA也能与水中钙离子配位,使测定结果与所需用的EDTA的量有关,因此对测定结果影响不确定。
14.用返滴定法测定Al3+含量时,首先在pH 3.0左右加入过量EDTA并加热,使Al3+配位。试说明选择此pH的理由。
答:Al(OH)3的Ksp = 2×10-32,非常小,当pH值接近4时即可产生Al(OH)3沉淀,所以选择溶液pH=3.0左右加入过量EDTA并加热,使Al3+配位完全,然后再调节合适的pH用金属离子的标准溶液返滴定加入过量的未与Al3+反应的EDTA标准溶液。
15. 今欲不经分离用配位滴定法测定下列混合溶液中各组分的含量,试设计简要方案(包括滴定剂、酸度、指示剂、所需其他试剂以及滴定方式)。
(1)Zn2+、Mg2+混合液中两者含量的测定;
(2)含有Fe3+的试液中测定Bi3+;
(3)Fe3+、Cu2+、Ni2+混合液中各含量的测定;
(4)水泥中Fe3+、Al3+、Ca2+和Mg2+的分别测定。
答:(1)logKMgY=8.69, logKZnY=16.50, ΔlogK>5, 可控制酸度分别滴定.
EDTA EDTA
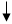
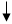 Zn2+pH≈5~6,六次甲基四胺 ZnY p H=10.0 NH3-NH4 Cl MgY
Zn2+pH≈5~6,六次甲基四胺 ZnY p H=10.0 NH3-NH4 Cl MgY

 Mg2+ XO Mg2+ EBT ZnY
Mg2+ XO Mg2+ EBT ZnY
(2)logK Fe3+Y=25.10, logK Fe2+Y=14.33, logKBiY=27.94, 把Fe3+转化为Fe2+, 则ΔlogK>5,
EDTA EDTA

Bi3+ Vc Bi3+ XO BiY HNO3 Fe3+ Ssal FeY



 Fe3+ pH=1~2 Fe2+ pH=1~2 Fe2+ BiY pH=1.5~2.2 BiY
Fe3+ pH=1~2 Fe2+ pH=1~2 Fe2+ BiY pH=1.5~2.2 BiY
(3)logKFe3+Y = 25.10, logK CuY=18.80, logK NiY=18.60, Ni2+和Cu2+ 的ΔlogK<5, Fe3+和Cu2+的ΔlogK>5, 可控制酸度滴定Fe3+.,Ni2+和Cu2+ 的测定须使用掩蔽和解蔽法。
EDTA EDTA

Fe3+ FeY CuY
Cu2+ Ssal Cu2+ XO NiY

 Ni2+ pH =1.5~2 Ni2+ pH =5.0~6.0 FeY
Ni2+ pH =1.5~2 Ni2+ pH =5.0~6.0 FeY
测铁 测Ni、Cu总量
EDTA标液
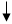
Fe3+ FeF63- FeF63- Ni2+ NiY
Cu2+ NH4F Cu2+ KCN Ni(CN)42- AgNO3 Cu(CN)42- XO Cu(CN)42-



 Ni2+ pH =8.0~9.0 Ni2+ pH =8.0~9.0 Cu(CN)42- pH =8.0~9.0 FeF63- pH =5.0~6..0 FeF63-
Ni2+ pH =8.0~9.0 Ni2+ pH =8.0~9.0 Cu(CN)42- pH =8.0~9.0 FeF63- pH =5.0~6..0 FeF63-
测Ni量
Cu2+、Ni2+总量,减去Ni2+含量,即得Cu2+含量。
(4)在pH1.5~2.0之间,以磺基水杨酸为指示剂,EDTA标准溶液为滴定剂测定Fe3+离子;然后加入过量EDTA标准溶液,煮沸,调节溶液pH4.5,以PAN为指示剂,用Cu2+标准溶液返滴定,可测得Al3+含量;另取一份,加入三乙醇胺掩蔽Fe3+和Al3+,调节溶液pH=10.0,以NH3-NH4Cl为缓冲溶液,铬黑T为指示剂,EDTA标准溶液为滴定剂测定Mg2+、Ca2+总量;再取一份,加入三乙醇胺掩蔽铁离子和铝离子,调节溶液pH≥12.0,加入钙指示剂,以EDTA标准溶液为滴定剂测定Ca2+含量,用Mg2+、Ca2+总量减去Ca2+含量, 可得Mg2+含量。
第六章 氧化还原滴定法
思考题答案
1. 处理氧化还原平衡时,为什么引入条件电极电位?外界条件对条件电极电位有何影响?
答:(1) 在能斯特方程中,是用离子的活度而非离子的浓度计算可逆氧化还原电对的电位。实际上通常知道的是离子的浓度而不是活度,往往忽略溶液中离子强度的影响,以浓度代替活度进行计算。但实际上,溶液浓度较大时,溶液中离子强度不可忽略,且溶液组成的改变(即有副反应发生)也会影响电极的电对电位,为考虑此两种因素的影响,引入了条件电极电位。
(2) 副反应:加入和氧化态产生副反应(配位反应或沉淀反应)的物质,使电对电极电位减小;加入和还原态产生副反应(配位反应或沉淀反应)的物质,使电对电极电位增加。另外有H+或OH-参加的氧化还原半反应,酸度影响电极电位,影响结果视具体情况而定。离子强度的影响与副反应相比一般可忽略。
2. 为什么银还原器(金属银浸于1 mol.L-1 HCl溶液中)只能还原Fe3+而不能还原Ti(Ⅳ)?试由条件电极电位的大小加以说明。
答:金属银浸于1 mol.L-1 HCl溶液中产生AgCl沉淀。
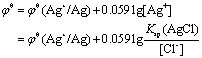
在1 mol.L-1 HCl溶液中
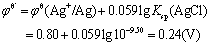

在1mol·L-1 HCl中,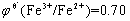 ,
, 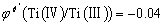 ,故银还原器(金属银浸于1 mol.L-1 HCl溶液中)只能还原Fe3+而不能还原Ti(Ⅳ)。
,故银还原器(金属银浸于1 mol.L-1 HCl溶液中)只能还原Fe3+而不能还原Ti(Ⅳ)。
3. 如何判断氧化还原反应进行的完全程度?是否平衡常数大的氧化还原反应都能用于氧化还原滴定中?为什么?
答:(1) 根据条件平衡常数判断,若滴定允许误差为0.1%,要求lgK≥3(n1+ n2),即
(E10,-E20,)n/ 0.059≥3(n1+ n2),n为n1,n2的最小公倍,则
n1 = n2 =1, lgK≥3(1+1)≥6, E10’-E20’≥0.35V
n1 =1, n2 =2,lgK ≥3(1+2)≥9, E10’-E20’≥0.27V;
n1= n2 =2, lgK≥3(1+1)≥6, E10’- E20’≥0.18V (E0’=jq¢)
(2) 不一定。虽然K’很大,但如果反应不能以一定的化学计量关系或反应的速率很慢,都不能用于氧化还原滴定中。
4. 影响氧化还原反应速率的主要因素有哪些?如何加速反应的进行?
答:影响氧化还原反应速率的主要因素有反应物的浓度, 温度, 催化剂, 诱导作用; 增加反应物的浓度,或升高溶液的温度,或加入正催化剂,或有诱导反应存在等都可加速反应的完成。
5. 解释下列现象:
(1) 将氯水慢慢加入到含有Br-和I-的酸性溶液中,以CCl4萃取,CCl4层变为紫色,如继续加氯水,CCl4层的紫色消失而呈红褐色。
答:jq¢(Cl2/Cl-)=1.358 V,jq¢(Br2/Br-) =1.08 V,jq¢(I2/I-)=0.535 V,
(1) 滴加氯水,I2先析出,故CCl4层为紫色;若继续滴加氯水,I-浓度逐渐减小, I2/I- 电对的电极电位增加,当增加到与Br2 /Br- 电对电极电位相等时,Cl2同时氧化Br-和I-,Br2和I2一起析出,CCl4层呈红褐色。
(2) 虽然jq(I2/2I-)> jq( Cu2+/Cu+),从电位的大小看,应该I2氧化Cu+,但是Cu+却能将I-氧化为I2。
答:当I-浓度较大时, 2 Cu + 4 I- = 2 CuI¯ + I2 反应生成沉淀,使[Cu+]降低,则jq( Cu2+/Cu+)增加,使jq (I2/2I-) < jq (Cu2+/Cu+),反应向右进行。
(3) 用KMnO4溶液滴定C2O42-时,滴入KMnO4溶液的红色褪去的速度由慢到快。
答:在反应MnO42- + 5 C2O42-+ 16 H+ = 2 Mn2+ +10 CO2 + 8 H2O中,Mn2+起催化作用,反应刚开始,[Mn2+]少,随着Mn2+浓度的增加,使反应速度加快,故KMnO4溶液的红色褪去的速度由慢到快。
(4) Fe2+的存在加速KMnO4氧化Cl-的反应。
答:在反应5 Fe2+ + MnO4- + 8 H+ = 5 Fe3+ + Mn2+ + 4 H2O中,有Mn(Ⅵ) 、Mn(Ⅴ)、Mn(Ⅳ)、Mn(Ⅲ)等不稳定的中间价态离子,它们均能与Cl-起反应,从而加速KMnO4氧化Cl-的反应。
(5) 以K2Cr2O7标定Na2S2O3溶液浓度时,是使用间接碘量法。能否用K2Cr2O7溶液直接滴定Na2S2O3溶液?为什么?
答:因Cr2O72- 与 S2O3-反应产物不单一,无定量关系, 反应不能定量地进行,故不能用K2Cr2O7溶液直接滴定Na2S2O3溶液。
6. 哪些因素影响氧化还原滴定的突跃范围的大小?如何确定化学计量点时的电极电位?
答:(1) 对于反应 n2Ox1 + n1Red2 = n2 Red1 + n1 Ox2
化学计量点前0.1%: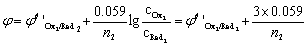
化学计量点后0.1%: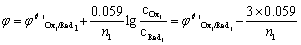
所以凡能影响两条件电极电位的因素(如滴定时的介质)都将影响滴定突跃范围,此外与n1, n2有关,但与滴定剂及被测溶液的浓度无关。
(2) 对于可逆对称氧化还原反应: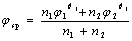 , 与氧化剂和还原剂的浓度无关;
, 与氧化剂和还原剂的浓度无关;
对可逆不对称氧化还原反应n2Ox1 + n1Red2 = a n2 Red1 + b n1 Ox2
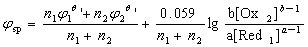 与氧化剂和还原剂的浓度有关
与氧化剂和还原剂的浓度有关
对有H+ 参加的氧化还原反应,还与[H+]有关。
7. 氧化还原滴定中,可用哪些方法检测终点?氧化还原指示剂为什么能指示滴定终点?
答:(1) 电位滴定法可用指示剂(自身指示剂、专属指示剂和氧化还原指示剂)确定终点。
(2) 氧化还原指示剂本身具有氧化还原性质,其氧化态和还原态具有不同颜色,可利用其氧化或还原反应发生颜色变化以指示终点。
8. 氧化还原滴定之前,为什么要进行预处理?对预处理所用的氧化剂或还原剂有哪些要求?
答:(1) 将被测物处理成能与滴定剂迅速、完全,并按照一定化学计量关系起反应的价态,或处理成高价态后用还原剂滴定,或处理成低价态后用氧化剂滴定。
(2) 反应能定量完成且反应速率要快;反应具有一定的选择性;过量的氧化剂或还原剂要易于除去。
9. 某溶液含有FeCl3及H2O2。写出用KMnO4法测定其中H2O2及Fe3+的步骤,并说明测定中应注意哪些问题?
 答:
答:
(1) Hg2Cl2+ SnCl4
Fe2+ 滴定铁
(2) 测H2O2及Fe2+时,加滴定剂的速度先慢(滴第一滴溶液待溶液褪色后再滴第二滴, 中间稍快,接近终点时慢;测Fe2+时,需加MnSO4-H2SO4-H3PO4混合液,使滴定突跃增加,终点易于观察,也避免Cl- 存在下发生诱导反应。
10. 测定软锰矿中MnO2含量时,在HCl溶液中MnO2能氧化I- 析出I2, 可以用碘量法测定MnO2的含量,但Fe3+有干扰。实验说明,用磷酸代替HCl时, Fe3+无干扰,何故?
答:磷酸代替HCl时: Fe3+ + 2 PO43- = [Fe (PO4)2]3- 生成无色配合物[Fe(PO4)2]3-,使[Fe3+]降低,导致j( Fe3+/Fe2+)降低,致使Fe3+ 不能氧化I- ,所以Fe3+对测定无干扰。
11. 用间接碘量法测定铜时,Fe3+和AsO43-都能氧化I- 而干扰铜的测定。实验说明,加入NH4HF2,以使溶液的pH≈3.3,此时铁和砷的干扰都消除,为什么?
答:jq (I2/I-)=0.535 V, jq (Fe3+/ Fe2+)= 0.77 V,jq ( H3AsO4/ HAsO2)=0.56 V
(1) 加入NH4HF2,使Fe3+生成稳定的FeF6- 配离子,由于FeF6- 配离子稳定性很强,使Fe3+/ Fe2+电对的电极电位降低到低于碘电对的电极电位,从而可防止Fe3+氧化I-。
(2) 酸度影响H3AsO4/ HAsO2电对的电极电位,从半反应
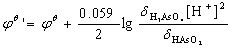
计算溶液pH≈3.3时(计算略),jq’ ( H3AsO4/ HAsO2)= 0.44 V< jq (I2/I-)=0.535 V,故可防止AsO43-氧化I-。
12. 拟定分别测定一混合试液中Cr3+及Fe3+的分析方案。
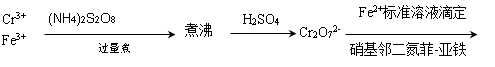 答:
答:

