实验报告用统一的实验报告纸写:宁波大学实验报告P,。
学院:阳明学院 学号:13XXXXXXX 类别:工程技术类 姓名: 班级:工程技术3班
实验名称:化学实验安全常识与容量器皿认领洗涤与干燥
实验目的:了解化学实验安全常识并掌握基本的安全操作;熟悉常用玻璃仪器。
实验仪器:量筒,烧杯,锥形瓶,容量瓶,玻璃漏斗,热滤漏斗,酒精灯,移液管,吸量管,蒸发皿,点滴板,试管夹,试管,称量瓶,玻璃棒,温度计等
实验内容:
(一) 化学实验安全常识
实验室安全守则是保持正常从事实验的环境和工作秩序,防止意外事故发生,做好实验的重要前提,人人做到,人人遵守。
1、进行化学实验时,要严格遵守关于水、电、气和各种仪器、药品的使用规定。
2、不要用湿的手、物接触电源。
3、应配备必要的防护物品,保护人身安全。
4、危险品和剧毒物品必须有严格的管理、使用制度,领用时要登记,使用完要回收或销毁。
5、绝对不允许随意混合各种化学药品,以免发生意外事故。
6、浓碱和浓酸具有强腐蚀性,切勿使其溅在皮肤或衣服上,眼睛更应注意保护。
7、能产生有刺激性气体或有毒气体(如H2S、HF、Cl2、CO、NO2、SO2、Br2、NH3、HCl)的实验必须在通风橱内进行。
8、稀释酸、碱时(特别是浓硫酸),应将酸或碱慢慢倒入水中,并用玻璃棒搅拌,以避免迸溅。
9、加热试管时,切记不要使试管口向着自己或别人。
10、移取药品时,应使用药勺或镊子移取,禁止直接用手拿取。
11、使用贵重仪器设备时,必须严格按照操作规程进行操作。如出现异常或故障,应停止使用,并报告相关人员或上级主管,及时排除故障。
12、加强环境保护意识,采取积极措施,减少有毒气体和废液对大气、水、和周围环境的污染。
13、严禁在实验室内饮食或把食具带进实验室。实验完毕,必须清洗双手。
14、不要俯向容器去嗅放出的气体。面部应远离容器,用手把逸出的气体慢慢的煽向自己的鼻孔。
15、实验后,应将所用仪器洗净并整齐地放回实验柜内。实验台必须揩净。实验室所有药品不得携出室外。
(二)常用玻璃仪器的认领
画图:
画出量筒、烧杯、漏斗、锥形瓶、容量瓶、移液管、洗气瓶、吸量管、
圆底烧瓶、称量瓶、玻璃棒、温度计等,至少画8个。
实验结果与讨论:
一.玻璃仪器的干燥方法有哪几种?
玻璃仪器的干燥方法有以下几种:
a.倒置晾干:将洗净的仪器倒置在干净的仪器架上或仪器柜内自然晾干。
b.热(或冷)风吹干:仪器如急需干燥,则可用吹风机吹干。对一些不能受热的容量器皿可用吹风干燥。如果吹风前用乙醇、乙醚、丙酮等易挥发的水溶性有机溶剂冲洗一下,则干得更快。
c.加热烘干洗净的仪器可放在烘箱内烘干。烘干温度一般控制在105℃左右,仪器放进烘箱前应尽量把水倒净。能加热的仪器如烧杯、试管也可直接用小火加热烘干。加热前,要把仪器外壁的水擦干,加热时,仪器口要略向下倾斜。
二.容量瓶在使用时应注意什么?
答:使用容量瓶时应注意:
1.热溶液应冷却至室温后,才能稀释至标线,否则可造成体积误差;
2.需避光的溶液应以棕色容量瓶配制。容量瓶不宜长期存放溶液,应转移到磨口试剂瓶中保存;
3.容量瓶及移液管等有刻度的精确玻璃量器,均不宜放在烘箱中烘烤;
4.容量瓶如长期不用,磨口处应洗净擦干,并用纸片将磨口隔开。
第二篇:实验报告1
Bi3+—Fe3+混合溶液中各组分含量的测定
摘要 设计实验要求学生独立查阅资料,独立设计方案,独立进行实验,本实验是为了培养学生查阅相关资料的能力和运用所学知识及有关参考资料对实际试样进行实验方案设计的能力。运用络合滴定的原理设计Bi3+和Fe3+混合液各组分含量的测定方案并具体实施。掌握酸度对EDTA选择性的影响和EDTA进行连续滴定的方法;掌握配制EDTA标准溶液的方法,学会用氧化还原掩蔽法进行掩蔽某种离子的办法,掌握连续滴定、分步滴定的原理与条件。Bi3+和Fe3+均能与EDTA形成稳定络合物,它们的㏒K分别为27.94,25.1.由于两者的㏒K相差不大,故不能直接利用EDTA的酸效应来滴定,而Fe2+的㏒K =14.33,故可考虑使用还原剂来还原Fe3+,再在不同酸度下用EDTA分别滴定。通过两次滴定可分别求出Bi3+和Fe3+的浓度。该方法简便易行且准确度高,基本符合实验要求。
关键词 Bi3+和Fe3+混合溶液,氧化还原掩蔽法,络合滴定法,指示剂,(CH2)6N4H+-(CH2)6N4形成的缓冲溶液
1 引言
测定混合溶液中Bi3+和Fe3+含量的方法有四种:
方法一:1、Fe3+—Bi3+混合溶液中总含量的滴定
用移液管移取25.00mlFe3+—Bi3+混合液于250ml锥形瓶中,加入2滴二甲酚橙,微热,用EDTA 滴定,溶液由红色变为黄色时,记下消耗 EDTA 的体积,平行滴定三份。
2、混合溶液中Bi3+含量的滴定
重新移取25.00mlFe3+—Bi3+混合液于250ml锥形瓶中,加入4片Vc片,加热,待完全溶解后滴加2滴甲基百里酚蓝,用 EDTA 滴定,溶液由蓝色变为黄色时,记下消耗 EDTA 的体积,平行滴定三份。
方法二:1、 Fe3+还原成 Fe2+
用移液管移取25.00mlFe3+—Bi3+混合液于250ml锥形瓶中,摇匀,加入抗坏血酸,当溶液转变为浅黄绿色,Fe3+充分还原为 Fe2+时,取下静置片刻,加入二甲酚橙指示剂,生成紫红色络合物。
2、 Fe2+—Bi3+混合溶液滴定
直接用 EDTA 滴定,溶液变为黄色时即为 Bi3+的滴定终点。再加入六亚甲基四胺至溶液再变为稳定的紫红色,再加入5ml六亚甲基四胺,用 EDTA 滴定,当溶液变为黄色时,即为 Fe2+的滴定终点。
方法三:1、 Bi3+、Fe3+混合液的测定
用移液管移取25.00mLBi3+—Fe3+混合液溶液3份于250mL锥形瓶中,加入 1~2 滴二甲酚橙指示剂,用 EDTA 标液滴定,当溶液由紫红色恰变为黄色,即为Bi3+、Fe3+的终点。根据消耗 EDTA 的体积,计算混合液中 Bi3+、Fe3+的总含量。
2、 另用移液管移取25.00mLBi3+—Fe3+混合液溶液3份于250mL 锥形瓶中,加入 5mL0.2 mol/ L盐酸羟胺, 将 Fe3+还原为 Fe2+, 再加入 1~2 滴邻苯二酚紫指示剂,用 EDTA 标液滴定,当溶液由紫红色恰变为黄色,即为 Bi3+的终点。根据消耗 EDTA 的体积,计算混合液中Bi3+的含量。
方法四:1、 Fe3+—Bi3+混合溶液中总含量的滴定
用移液管移取25.00ml于250ml 锥形瓶中,加入2滴二甲酚橙,微热,用 EDTA 滴定,溶液由红色变为黄色时,记下消耗 EDTA 的体积,平行滴定三份。
2、 混合溶液中 Bi3+的含量的滴定
重新移取25.00mlFe3+—Bi3+混合液于250ml锥形瓶中,加入4片Vc片,加热,待完全溶解后滴加2滴二甲酚橙,用 EDTA 滴定,溶液由红色变为黄色时,记下消耗 EDTA 的体积,平行滴定三份。[1]
第二种方案操作简便易行且准确度较高,所以本实验选用第二种方法进行实验。
2 实验目的
2.1 培养络合滴定理论及实验中解决实际问题的能力。
2.2 对分离掩蔽等理论和实验内容有初步的掌握。
2.3 学会用氧化还原掩蔽法进行掩蔽某种离子的办法,掌握连续滴定、分步滴定的原理与条件。
2. 4 进一步掌握标准溶液的配制与标定方法,掌握指示剂的使用方法。
2. 5 掌握酸度对EDTA选择性的影响和EDTA进行连续滴定的方法。
3 实验原理
3.1 EDTA标准溶液的配制与标定
EDTA是一种很好的氨羧络合剂,它能和许多种金属离子生成很稳定的1:1络合物,所以广泛用来滴定金属离子。EDTA难溶于水,常含有少量水分和其他杂志,因此不能作为基准物质直接配制标准溶液。
通常先将EDTA配成接近所需浓度的溶液,然后用基准物质进行标定。
标定EDTA溶液常用的基准物有金属Zn、Cu、Ni、Pb、ZnO、CuO、CaCO3、ZnSO4·7H2O、MgSO4×7H2O等。
当用EDTA标准溶液滴定时,Zn2+与EDTA生成无色的络合物,当接近化学计算点时,已与指示剂络合的金属离子被EDTA夺出,释放出指示剂,溶液即显示出指示剂的游离颜色,当溶液从紫红色变为亮黄色,即为滴定终点。反应式如下:
ZnIn + Y = ZnY + In
(紫红色) (无色)(无色)(亮黄色)
3.2 混合溶液中Bi3+和Fe3+含量的测定
EDTA 与 Bi3+、Fe3+这两种离子所形成络合物的稳定程度相当,不能用控制酸度的方法对它们进行分别测定。查资料得:lgK Fe3+Y =25.1, lgK Fe2+Y =14.33,lgKBi3+Y =27.94 lgKFe2+Y,lgKBi3+Y相差较大,可考虑用适当的还原剂将Fe3+还原为 Fe2+,增大△logK,再进行滴定。
3.1.1 Fe2+被滴定时:
最高酸度:lgaY(H)=lgKFeY-8=14.32-8=6.32,即pH低=5.1;
最低酸度:[OH-]=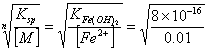
∴[OH-]=2.83×10-7
pH=14-pOH=14-6.54=7.46 ∴pH=5.1—7.46
3.1.2 Bi3+被滴定时:
最高酸度:lgaY(H)= lgKBiY-8=27.94-8=19.94 ,即pH低=0.7
最低酸度:[OH-]=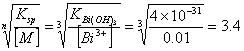 ×10-10
×10-10
pH=14-pOH=14-9.47=4.53 ∴pH=0.7—4.53
3.1.3 Fe3+被滴定时:
最高酸度:lgaY(H)= lgKFeY-8=25.1-8=17.1 即pH低=1.2
最低酸度:[OH-]=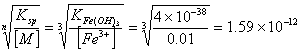
pH=14-pOH=14-11.80=2.2 ∴pH=1.2—2.2
3.3 二甲酚橙指示剂适用的范围pH<6
若(KMYCM)/(KNYCN)>105时,可分步滴定;
KBiY 1027.94
即───── = ───── >105 即Bi3+与Fe2+可分步滴定;
KFeⅡY 1014.23
KBiY 1027.94
即───── = ───── <105 即Bi3+与Fe3+不可分步滴定;
KFeⅢY 1025.1
当pH=1时, lgK(BiY)=lgK'(BiY)-lgaY(H)=27.94-18.01=9.93>8,
lgK(FeY)=lgK'(FeY)-lgaY(H)=14.23-18.01<8,
Bi3+能被准确滴定而不受Fe2+的影响;
当pH=5.5时,Bi3+滴定的适宜范围为0.7到4.53;Fe2+的适宜范围为5.1到7.46;Fe2+能被准确滴定而不受Bi3+的影响;
取一份混合溶液往其中加入适量的抗坏血酸是Fe3+全部转化为Fe2+,调pH=1左右,加入二甲酚橙指示剂,用EDTA标准溶液进行滴定,溶液刚好变为亮黄色时即为Bi3+的终点;
向溶液中加入适量的六亚甲基四胺使溶液由亮黄色变为紫红色,使溶液pH=5.5左右,再加入一定量的六亚甲基四胺,用EDTA标准溶液进行滴定,溶液刚好变为亮黄色时即为Fe2+的终点。
3.4 各组分含量的计算:
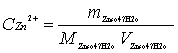

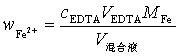
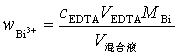
4 实验试剂与仪器
4.1 仪器
全自动电光分析天平 电子台秤 称量瓶 酸式滴定管(50mL) 移液管(25mL) 锥形瓶(250mL3个) 容量瓶(250mL) 烧杯(100 mL、500 mL各一个) 玻璃棒
洗耳球 量筒(10 mL)
胶头滴管
4.2 试剂
Bi3+和Fe3+混合溶液 EDTA二钠盐(s) ZnSO4·7H2O(s) HCl(1:5)
六亚甲基四胺溶液(200g/L) 二甲酚橙指示剂(2g∕L) 抗坏血酸(5%)
5 实验步骤
5.1 Zn2+标准溶液的配制
差减法准确称取基准物ZnSO4·7H2O0.6~0.8g于100mL小烧杯中,加适量水溶解,然后定量转移至250mL容量瓶中,稀释至刻度并摇匀,计算浓度。
5.2 EDTA标准溶液的配制
在台秤上粗秤2.0g乙二胺四乙酸二钠盐于500mL的大烧杯中,加蒸馏水溶解,稀释至500ml,用玻璃棒搅拌均匀。
5.3 EDTA标准溶液的标定
移液管移取25.00mLZn2+溶液于锥形瓶中,加入2mLHCl(1:5),然后再加入10mL六亚甲基四胺溶液,再滴入2滴二甲酚橙指示剂,摇匀。用待标定的EDTA标准溶液滴定至溶液由紫红色变为亮黄色,且30s不褪色,即为滴定终点。记下消耗EDTA溶液的体积,平行三次,计算EDTA溶液的浓度。(≤0.2%)
5.4 混合溶液中各组分含量的测定
5.4.1 Bi3+含量的测定
用移液管准确平行移取三份25.00mL Bi3+和Fe3+混合溶液分别置于250mL锥形瓶中,加入5mL抗坏血酸(5%)溶液,等两分钟以上,保证Fe3+完全被还原为Fe2+。然后加入2滴二甲酚橙指示剂,用已标定的EDTA标准溶液滴定至溶液由紫红色变为亮黄色,并保持半分钟不褪色即为终点。记录消耗的EDTA溶液的体积,并计算Bi3+含量和相对平均偏差。(≤0.2%)
5.4.2 Fe3+含量的测定
在上述溶液中,继续加入六亚甲基四胺溶液至溶液呈现稳定的紫红色,再多加入5mL六亚甲基四胺溶液,滴加2滴二甲酚橙指示剂,充分摇匀,用已标定的EDTA标准溶液滴定至溶液由紫红色变为亮黄色,并保持半分钟不褪色即为终点。记录消耗的EDTA溶液的体积,并计算Fe3+含量和相对平均偏差。(≤0.2%)
5.5 实验完毕后,将仪器洗涤干净并放回原处,废液回收到废液桶中,实验台收拾干净。
6 实验数据记录与处理
6.1 EDTA溶液标定的数据处理
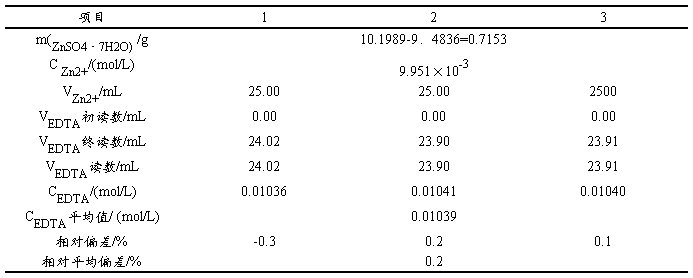
6.2 混合溶液中Bi3+含量的测定
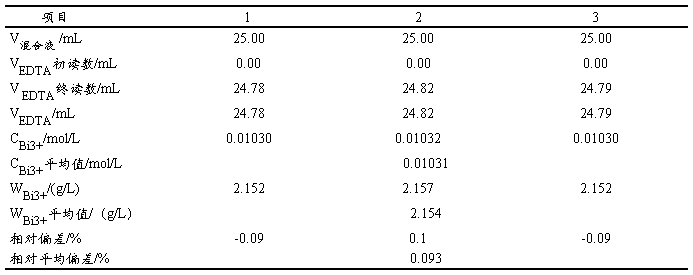
6.3 混合溶液中Fe3+含量的测定

7 实验结果与讨论
7.1 测定结果
本实验采用络合滴定法测定Bi3+—Fe3+混合液中各组分的含量,其中所标定EDTA溶液的标准浓度 0.01039mol/L ;滴定得Bi3+的浓度为 0.01031 mol/L ,含量为 2.154g/L ;Fe3+的浓度为 0.01030 mol/L ,含量为0.5754g/L 。实验所得结果的准确度较高,说明此实验方法较好。
7.2 误差分析
7.2.1 仪器本身不够精确,存在系统误差,使实验出现误差。
7.2.2 滴定过程中对颜色的变化不敏感,导致终点把握不准,出现误差。
7.2.3 实验过程中操作不是十分规范,导致误差的出现。
7.2.4 实验后的读数上存在误差,使实验结果有误差。
7.2.5 标定EDTA时有误差,由于误差的传递,滴定Bi3+和Fe3+混合溶液时存在误差。
7.2.6 试剂纯度可能不够和蒸馏水中可能含有微量杂质从而引起系统误差。
8 实验注意事项
8.1 注意滴定时指示剂的用量以及终点的判断。
8.2 注意滴定时的正确操作:见滴成线,逐滴滴入,半滴滴入。
8.3 注意操作的细节问题,尽可能做到规范。
8.4 处理数据时注意有效数字的保留。
8.5 在测Fe3+时,加入抗坏血酸后要等两分钟以上,以保证Fe3+完全被还原为Fe2+。
9 收获体会
分析化学是一门严密的分析课程,对于其每一步,我们都要认真操作好,认真读取数据并按照其规则准确计算。对待这样一门学科,我们必须严谨认真。通过本次实验,我学会了连续滴定法测定混合金属离子的相关含量的方法,以及滴定终点的判断、滴定剂的选择、计量点的计算、指示剂的选择等;掌握了氧化还原掩蔽法的基本原理,明白了利用EDTA的酸效应在不同酸度下进行分别滴定的条件和原理;了解了连续滴定中的注意事项,了解了如何用间接法配制标准溶液及其浓度的标定。我相信,通过本次设计性实验,不仅可以熟练分析天平、移液管、滴定管等的使用,还能锻炼我们学会运用已学知识、提高解决问题的综合能力,提高我们独立查阅资料,独立完成实验的能力。
参考文献
[1]第二自然化学信息港[http://www.d2zr.com] 链接地址http://www.d2zr.com/20##/11/2901.html
