20##年普通高中毕业班综合测试(三)
化学
2013.5
本试卷分选择题和非选择题两部分,共12页,满分300分,考试用时150分钟.
注意事项:
1.答卷前,考生务必用黑色字迹的钢笔或签字笔将自己的姓名、考号填写在答题卡上.
2.选择题每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑;如需改动,用橡皮擦干净后,再选涂其它答案;不能答在试卷上.
3.非选择题必须用黑色字迹的钢笔或签字笔作答,答案必须写在非选择题答题卷上指定的区域内;如需改动,先划掉原来的答案,然后再写上新的答案;不准使用铅笔和涂改液.不按以上要求作答的答案无效.
4.考生必须保持答题卡的整洁,考试结束后,将答题卷和答题卡一并收回.
第一部分 选择题(共118分)
一、单项选择题:本大题共16小题,每小题4分,共64分;在每小题给出的四个选项中,只有一个选项符合题目要求,选对得4分,选错或不答的得0分.
7.化学源于生活又用于生活,下列有关应用不正确的是
A.用浸泡高锰酸钾溶液的硅土来吸收水果或花朵产生的乙烯以达到保鲜效果
B.淀粉、豆油、蛋白质都是天然高分子化合物
C.船身上附装金属Zn是利用了金属活泼性
D.含硫化石燃料的大量燃烧是酸雨形成的主要原因之一
8.设NA为阿伏加德罗常数的数值,下列叙述正确的是(相对原子量:H—1 C—12)
A.1 mol/L氯化铜溶液中的Cu2+数小于NA
B.标准状况下,22.4 L Cl2参加任何化学反应转移的电子数都是2NA
C.28 g聚乙烯含有的碳原子数为2NA
D.1 mol CH5+所含电子数为8NA
9.下列各组离子在通入SO2前后均能大量共存的是
A.Ba2+、K+、Br-、Cl- B.Na+、Cu2+、OH-、SiO32-
C.NH4+、Al3+、Br-、AlO2- D.Li+、H+、NO3-、SO42-
10.如下实验操作正确且能达到实验目的的是
A.将十水碳酸钠置于蒸发皿中,加热脱去结晶水
B.用分液漏斗分离溴乙烷与氢氧化钠溶液发生反应后的生成物
C.用铁粉与稀硝酸反应,制取少量氢气,用排水法收集
D.用酸式滴定管量取6.55 mL的KMnO4溶液
11.元素及其化合物丰富了物质世界,下列说法正确的是
A.铜在冷的浓硫酸中会钝化,所以把铜放入冷的浓硫酸中无明显现象
B.NaOH溶液和AlCl3溶液相互滴加的现象不同
C.金属比非金属易失电子,所以金属可以置换非金属,而非金属不能置换金属
D.Al与热水反应困难,故活泼性不及Al的金属在任何条件下均不能与H2O发生反应
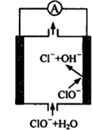 12.镁—次氯酸盐燃料电池具有比能量高、安全方便等优点,该电池主要工作原理如右图所示,其正极反应为:ClO-+ H2O + 2e-== Cl-+ 2OH-,关于该电池的叙述正确的是
12.镁—次氯酸盐燃料电池具有比能量高、安全方便等优点,该电池主要工作原理如右图所示,其正极反应为:ClO-+ H2O + 2e-== Cl-+ 2OH-,关于该电池的叙述正确的是
A.该电池中镁为负极,发生还原反应
B.电池工作时,OH-向正极移动
C.电池工作时,正极周围溶液的pH将不断变小
D.该电池的总反应为:Mg + ClO-+ H2O == Mg(OH)2↓+ Cl-
二、双项选择题:本大题共9小题,每小题6分,共54分;在每小题给出的四个选项中,有两个选项符合题目要求.全部选对的得6分,只选一个且正确的得3分,有选错或不答的得0分.
22.25℃时,某浓度的NH4Cl溶液pH = 4,下列叙述正确的是
A.溶液中的 c(OH-) = 1×10-10 mol·L-1 B.溶液中的c(NH4+)>c(Cl-)>c(H+)>c(OH-)
C.溶液中的c(H+) + c(NH4+) = c(Cl-) + c(OH-) D.溶液中的c(NH3·H2O) = c(NH4+)
23.下图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是
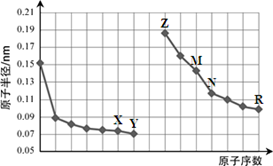 A.Y、R两种元素的气态氢化物及其最高价氧化物的水化物均为强酸
A.Y、R两种元素的气态氢化物及其最高价氧化物的水化物均为强酸
B.简单离子的半径:X > Z > M
C.由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应
D.Z单质不能从M与R元素构成的盐溶液中置换出单质M
第二部分 非选择题(共182分)
三、非选择题:本大题共11小题,共182分.按题目要求作答.解答题应写出必要的文字说明、方程式和重要演算步骤.只写出最后答案的不能得分.有数值计算的题,答案中必须明确写出数值和单位
30.(16分)氯吡格雷是一种用于抑制血小板聚集的新型药物,以2–氯苯甲醛为原料合成氯吡格雷(F)的路线如下:

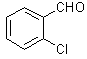

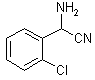

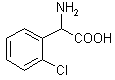

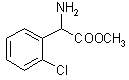
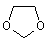
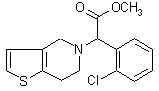

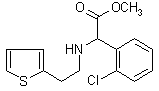

(1)C → D的反应类型为___________________。
(2)1 mol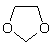 完全燃烧时,消耗O2的物质的量为_____________。
完全燃烧时,消耗O2的物质的量为_____________。
(3)D → E反应的方程式为____________________________________________________。
(4)写出满足下列条件的A的同分异构体的结构简式_____________________。
① 芳香族化合物; ② 核磁共振氢谱有5个吸收峰。
(5)下列有关化合物A~F的说法,正确的是(双选)_____________。
A.1 mol A 和足量的银氨溶液在一定条件下反应,最多能产生1 mol Ag
B.化合物D在一定条件下可以发生还原反应和取代反应
C.化合物E能使酸性KMnO4溶液褪色
D.1 mol F最多能和6 mol H2加成
(6)与A类似,化合物G经①②两步反应可得到苯丙氨酸(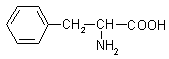 ),
),
则G的结构简式为__________________________。
31.(16分)工业上采用乙苯脱氢制备苯乙烯,反应体系同时发生两步可逆反应,其能量变化情况如下:
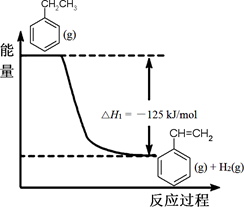
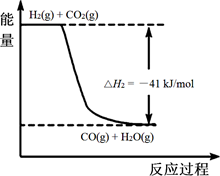
反应① 反应②
 (1)总反应
(1)总反应 + CO2(g)
+ CO2(g)
 + CO(g) + H2O(g) △H = _________。
+ CO(g) + H2O(g) △H = _________。
(2)下列叙述不能说明反应体系已达到平衡状态的是___________。
a.v正(CO) = v逆(CO) b.c(CO2) = c(CO)
c.消耗1 mol CO2同时生成1 mol H2O d.混合气体的平均相对分子质量保持不变
(3)某化学兴趣小组欲探究在相同压强条件下,CO2用量和温度条件对乙苯脱氢反应的影响,并设计了如下实验:

 ① 表中a = _____ mol,理由是________________________。
① 表中a = _____ mol,理由是________________________。
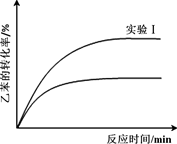
② 经实验测得,三组实验中乙苯的转化随时间变化如右图所示。其中未知曲线代表的是实验______(填“Ⅱ”或“Ⅲ”)。请用平衡移动原理解释该条件改变对乙苯转化率产生影响的原因:______________________________________________。
③ 在右图中补画剩余实验的变化曲线,并进行必要的标注。
32.(16分)锶(Sr)为第五周期ⅡA族元素,其化合物六水氯化锶(SrCl2·6H2O)是实验室重要的分析试剂,工业上常以天青石(主要成分为SrSO4)为原料制备,生产流程如下:
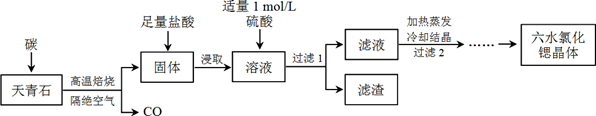
已知:① 经盐酸浸取后,溶液中除含有Sr2+和Cl-外,还含有少量Ba2+杂质;
② SrSO4、BaSO4的溶度积常数分别为3.3×10-7、1.1×10-10;
③ SrCl2·6H2O的摩尔质量为:267 g/mol。
(1)天青石焙烧前先研磨粉碎,其目的是_________________________________________。
(2)隔绝空气高温焙烧,若0.5 mol SrSO4中只有S被还原,转移了4 mol电子。写出该反应的化学方程式:_____________________________________________。
(3)为了得到较纯的六水氯化锶晶体,过滤2后还需进行的两步操作是_______________。
(4)加入硫酸的目的是______________________。为了提高原料的利用率,滤液中Sr2+的浓度应不高于_________ mol/L(注:此时滤液中Ba2+浓度为1×10-5 mol/L)。
(5)产品纯度检测:称取1.000 g产品溶解于适量水中,向其中加入含AgNO3 1.100×10-2 mol的AgNO3溶液(溶液中除Cl—外,不含其它与Ag+反应的离子),待Cl—完全沉淀后,用含Fe3+的溶液作指示剂,用0.2000 mol/L的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+ 以AgSCN白色沉淀的形式析出。
① 滴定反应达到终点的现象是_________________________________________。
② 若滴定过程用去上述浓度的NH4SCN溶液20.00 mL,则产品中SrCl2·6H2O的质量百分含量为______________(保留4位有效数字)。
33.(16分)碳酸锰(MnCO3,摩尔质量:115 g/mol)常用制造铁氧磁体,也用于化肥添加剂。某化学课题组拟从废旧干电池回收制取碳酸锰。
① 将干电池剖切、分选得到黑色混合物(主要成分为MnO2)洗涤、过滤、烘干。
② 将上述固体按固液体积比1∶4.5加入浓盐酸,加热反应完全后过滤,浓缩。
③ 向上述溶液中加入Na2CO3溶液,边加边搅拌,再过滤即可得到碳酸锰。
(1)写出第②步反应的离子方程式_______________________________________________。
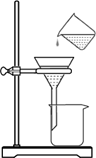 (2)右图在进行过滤时,操作有何错误:_________________________。
(2)右图在进行过滤时,操作有何错误:_________________________。
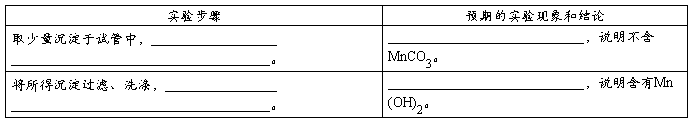
(3)查阅文献,发现上反应第③步中除了生成MnCO3之外还有可能生成Mn(OH)2,已知Mn(OH)2暴露在空气中时间稍长易被氧化成褐色的MnO(OH)2,MnCO3和MnO(OH)2受热分解、氧化,最终均生成MnO2。该课题组对上述沉淀的成分提出了以下假设,请帮助他完成假设:
假设一:_______________; 假设二:全部为Mn(OH)2;
假设三:既有MnCO3也有Mn(OH)2;
(4)为验证假设二是否正确,该课题组进行了以下研究:
① 定性研究:请你完成下表中的内容
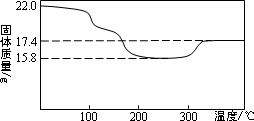 ② 定量研究:将所得沉淀过滤、洗涤,置于空气中充分氧化后,小心干燥,取22.0 g样品,加热,测得固体质量随温度的变化关系如右图。
② 定量研究:将所得沉淀过滤、洗涤,置于空气中充分氧化后,小心干燥,取22.0 g样品,加热,测得固体质量随温度的变化关系如右图。
根据图中数据判断假设_______成立,且试样中MnCO3的质量为___________ g。
化学部分

30.(16分)(1)取代反应(或酯化反应)(2分) (2)3.5 mol(2分)
(3) +
+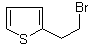

 + HBr(3分)
+ HBr(3分)
(4)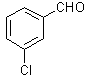 (2分) (5)BC(4分) (6)
(2分) (5)BC(4分) (6)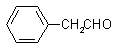 (3分)
(3分)
31.(16分)(1)-166 kJ/mol(2分) (2)bc(2分)
(3)① 9.0(2分) 在改变CO2用量的同时,保持反应体系的压强不变。(2分)
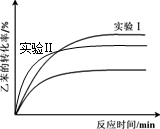 ② Ⅲ(2分) 对于平衡:
② Ⅲ(2分) 对于平衡:

 + H2,
+ H2,
通入CO2,CO2与H2反应,使c(H2)下降,平衡向正反应方向移动,乙苯的转化率提高。(2分)
③(起点、终点、斜率和标注各1分,共4分)
 32.(16分)(1)增加反应物的接触面积,提高反应速率,提高原料的转化率。(2分)
32.(16分)(1)增加反应物的接触面积,提高反应速率,提高原料的转化率。(2分)
(2)SrSO4 + 4C === SrS + 4CO(2分) (3)洗涤、干燥(或烘干)(2分)
(4)除去溶液中Ba2+杂质(2分) 0.03(3分)
 (5)溶液由无色变为血红色,且30 s不褪色(2分) 93.45%(3分)
(5)溶液由无色变为血红色,且30 s不褪色(2分) 93.45%(3分)
33.(16分)(1)MnO2 + 4H+ + 2Cl- === Mn2+ + Cl2↑+ 2H2O(2分)
(2)没有使用玻璃棒引流(2分) (3)全部为MnCO3(2分)
(4)①(操作各2分,现象各1分,共6分)

② 三(2分) 11.5(2分)
第二篇:高一化学单元测试(一)
高一化学单元测试(一)
2006.9.17
一、 不定项选择题 ( 23×3分=69分 )
1.下列关于化学反应类型的叙述中,正确的是 ( )
A、 凡是生成盐和水的反应都是中和反应
B、 复分解反应一定没有单质参加
C、 生成一种单质和一种化合物的反应一定是置换反应
D、 分解反应的生成物一定有单质
2.某物质经分析知,其中仅含一种元素,此物质
A.可能是纯净物也可能是混合物
B.可能是单质也可能是化合物
C.一定是纯净物
D.一定是一种单质
3.下列各组物质中,肯定全都属于纯净物的是
A.液氯和氯水 B.酒精溶液和乙醇
C.七水合硫酸亚铁和硫酸亚铁 D.干冰和混有冰的水
4.下列物质中,既能用单质间的化合反应又能由单质与盐酸反应而制得的是
A.NaCl B.FeCl3 C.CuCl2 D.FeCl2
5.下列说法正确的是
A.6.02×1023个碳原子就是阿伏加德罗常数 B.1mol氧就是6.02×1023个氧分子.
C.1molNa失去1mol电子生成1molNa+ D.摩尔是七个基本物理量之一
6.相等质量的Fe2O3和Fe3O4所含氧原子个数之比是
A.4:3 B.3:4 C.87:80 D.1:1
7.1gH2O中含m个氢原子,则阿伏加德罗常数为
A.m/9 B.9m C.2m D.m
8.某气体6g在标准状况下的体积为4.48升,该气体的摩尔质量是
A.12 B.12g·mol-1 C.30 D.30g·mol-1
9.若下列物质均为1g,则含分子数最多的是 ) ) ) ( ) ( ) ( ) ( ) ( ) (((
A.CO B.CH4 C.N2 D.NO
10.在下列各组物质中,所含分子数和原子数均相同的是 ( )
A.1mol二氧化碳和1mol氯化氢
C.1mol一氧化碳和34g硫化氢. B.1g氢气和16g氧气 D.18g水和28g一氧化碳
11.同温同压下,3体积A2气体跟1体积B2气体完全反应生成2体积C气体,则它的化学式是( ) A.A2B
B.AB2 C.BA3 D.B3A
12.下列各物质中所含原子数与1.8g水中所含原子数相等的是 ( )
A.2.24L硫化氢 B.0.1mol氨气 C.0.15mol氯化氢 D.0.4g甲烷
13.Na2SO4质量分数为10%的溶液中,Na+离子和水分子物质的量之比是 ( )
A.1:15 B.1:30 C.1:71 D.2:71
14.0.008molMn+的溶液,恰好能沉淀0.012molCO32-的溶液,则n值为 ( )
A.1 B.2 C.3 D.4
15.1mol氧气和36.5g氯化氢气体相比较,前者的体积与后者的体积的关系是 ( )
A.前者大 B.后者大 C.一样大 D.无法判断
16.有下列物质:①0.5mol NH3;②标准状况下 22.4LHe;③4℃时9mlH2O;④0.2molH3PO4。按所含的原子数由多到少的顺序排列: ( )
A. ①②④③ B. ④③①② C. ①④③② D. ②③④①
17.标准状况下有①6.72LCH4;②3.01×1023个HCl;③13.6gH2S(g);④0.2molNH3(g)。下列对四种气体的关系从小到大
表示不正确的是
A. 体积:④<①<②<③ B. 密度:①<④<③<②
C. 质量:④<①<③<② D. 氢原子数:④<②<③<①
18.等质量的SO2和SO3 ( )
A、所含氧原子的个数比为2∶3 B、所含硫原子个数比为1∶1
C、所含硫元素的质量比为5∶4 D、所含原子个数比为3∶4
19.与2molNaCl电离出的Cl-数目相同的是 ( )
A. 1molMgCl2 B. 2molKClO3 C. 0.5molAlCl3 D. 1.5molCaCl2
20.过量的稀硫酸与Zn、Al反应时,产生等物质的量的H2,则Zn、Al的质量之比为 ( )
A. 1:1 B. 65:27 C. 65:18 D. 2:3
21、mg某金属M与含nmolHCl的盐酸恰好完全反应生成MCl2和H2,则该金属的相对原子质量为 ( ) ( )
A. 2m B. 2n C. n D. m nm2n2m
22.今有H2和NO(体积比为1:2)的混合气体VL,当其完全燃烧时,所需O2的体积为(体积均在同温同压下测定) ( )
A. 3VL B. 0.5VL C. VL D. 无法确定
23.一项化学实验中所得数据为:①一只气密性良好的塑料袋的质量为1.23g,充满气体后在标准状况下的容积为0.45L;②该
塑料袋充满氧气后的总质量为 1.29g;③该塑料袋充满X气体后的总质量为1.53g 。根据上述实验数据判断,X的化学式可能为(以下物质在标准状况下均为气态) ( )
A. CO B. CO2 C. C3H8 D. C4H10
二、填空题 (每空 1分×17=17分)
24、以石灰石、水、纯碱为原料,如何制取烧碱?写出有关反应的化学方程式,并说明基本反应类型。
(1)__________________________________________,属于_____________反应。
(2)__________________________________________,属于_____________反应。
(3)__________________________________________,属于_____________反应
+2—25.483g Na2SO4·10H2O中所含的Na的物质的量是 和SO4的物质的量是 ,所含H2O分子的数目是
个
26.含有相同原子个数的SO2和SO3,其质量比为 ,摩尔质量比为 ,物质的量比为 ,其中所含氧原子个数比为 ,硫原子个数比为 .
27.同温同压下,若A容器中O2和B容器中O3所含分子总数相等,则A容器和B容器的容积之比是 ,若它们所含原子总数相等,则A容器和B容器的容积比是 .
28.如果a g某气体中含有的分子数为 b,则cg该气体在标准状况下的体积是
(式中可用NA 表示)
三、计算题 7分×2=14分
29、同温同压下,某容器充满O2重16g,若充满CO2重19g,现充满某气体重44g,则某气体的摩尔质量为多少?
30.现有镁、铝合金5.1g完全溶于稀硫酸中,在标准状况下共收集到氢气5.6L,计算这种合金的百分组成。
