实验一低温豆粕提取大豆分离蛋白
一、原理
大豆分离蛋白的提取是根据大豆中所含的蛋白质在不同的pH时有不同的溶解度的特性而实现的。大豆粕中所含的蛋白质大部分都能溶解在水中,在pH6.5的蒸馏水中有很高的溶解度,且都能溶解于0.2%的碱液中,相反,在pH4.5时,蛋白质的溶解度非常小。所以大豆分离蛋白的提取是先用水或稀碱液从低温豆粕中萃取可溶物,用离心机分离出不溶物(豆粕渣)然后在萃取液(豆乳)中加酸(盐酸、磷酸、醋酸等)调节pH到4.2-4.5,于是蛋白质即从萃取液中沉淀出来,倾除清夜(即乳清、主要是低分子糖类、蛋白质等),将下层的蛋白质凝聚物进行水洗、浓缩、干燥即可得到等电点分离蛋白。
二、试剂及仪器
1)氢氧化钠 AR级
2)盐酸 AR级
3)电热恒温水浴锅
4)电热恒温干燥箱
5)离心沉淀机
6)酸度计
7)多功能电动搅拌器
三、实验步骤
在1000ml烧杯中将50克豆粕按料液比1:10的比例与水混合,温度50℃,低速搅拌30-35rpm,用1N氢氧化钠pH调至7.5,继续搅拌30分钟。悬浮液在2000 rpm转速下离心15分钟,回收上清液,沉淀(豆渣)弃去。上清液边搅拌边加入1NHCl(30-35rpm),将pH调至4.5,温度30℃,继续搅拌10分钟。将悬浮液在2000 rpm离心15分钟,弃去上清液(大豆乳清),回收沉淀(凝乳)并称重。
称取5克(精确到0.001克)于表面皿中,在105℃烘箱内烘干至恒重,测定凝乳的水分含量,烘干后的凝乳存放于干燥器内保藏。其余湿凝乳置于-15℃下冷冻储藏备用。
习题
1.求凝乳分离蛋白产品的含水量、蛋白含量
2.求分离蛋白生产过程的提取率、蛋白回收率、蛋白纯度一般是多少
3.为了提高蛋白提取率,在萃取、浆渣分离等操作中可采取什么措施?
实验二凯氏定氮法测定大豆分离蛋白中蛋白质的含量
一、原理
浓硫酸和样品及催化剂一起加热沸腾,样品中蛋白质分解,其含的N 变成(NH4)2SO4,碱化并蒸馏使NH3放出,将NH3蒸入酸溶液,在以标准酸来滴定,测得样品中的含氮量,从而得出样品中蛋白质含量,其反应式如下:

二、仪器
1)万分之一分析天平
2)饱和氢氧化钠溶液
3)2%硼酸溶液
4)溴甲酚绿-甲基红混合指示剂
5)催化剂:CuSO4?5H2O―K2SO4(1:10)
6)浓硫酸:比重1.84、无氮
7)蔗糖:分析纯
8)双氧水硫酸混合溶液
9)大豆粕、大豆分离蛋白
四、实验步骤
1)称样:称取约0.1克试样(烘干凝乳)准确到0.0001克。
2)消煮:将试样置于50ml凯氏烧瓶中,加入催化剂粉末1克,双氧水混合液3ml,轻轻摇动凯氏烧瓶使试样被硫酸润湿,将凯氏烧瓶中的液体连续沸腾,沸腾在瓶颈中部冷凝回流,待溶液消煮到无微小的碳粒呈透明的蓝绿色时,在继续消煮30-60分钟,稍冷后加入少量蒸馏水,结束消煮,冷却后倾入50ml容量瓶中,再用水稀释到刻度,摇匀,备用。
3)蒸馏:以0.01N标准盐酸滴定锥形瓶中的溶液由蓝绿色变为灰紫色为终点。
5)空白:用0.1克蔗糖代替样品作空白测定,消耗盐酸溶液的体积不得超过0.3ml。
五、计算

式中: ―滴定试样时消耗标准盐酸的体积(ml)
―滴定试样时消耗标准盐酸的体积(ml)
 ―滴定空白时消耗标准盐酸的体积(ml)
―滴定空白时消耗标准盐酸的体积(ml)
N―标准盐酸的当量浓度
6.25―将氮换算成粗蛋白质的系数
0.014―每毫克当量氮的克数
W―试样重量(克)
M―试样水分含量
平行测定的结果可取算术平均值,保留小数后二位。
六、注意
1)加碱蒸馏时如有氧化铜棕色沉淀发生,说明加碱量已足够。
2NaOH+CuSO4→Cu(OH)2+Na2SO4
Cu(OH)2→CuO↓+H2O
2)把吸收瓶装好后再加碱免NH3,逃逸。
习题
1.如果用标准盐酸吸收,要完成实验,应增加什么步骤?
2.如何检查蒸馏是否完全?如果用标准盐酸吸收,定氮实验中要增加什么步骤?测定氨基酸时也要进行水解,与定氮实验中消化水解过程有什么区别?
3.整个实验过程中,下列那些操作要十分精确,那些可不十分严格?
样品称量,硼酸体积,饱和NaOH用量,蒸馏时间,硫酸消化液用量,蒸馏装置气密性
实验三 差示紫外光谱法测定大豆蛋白的构象稳定性
一、实验原理
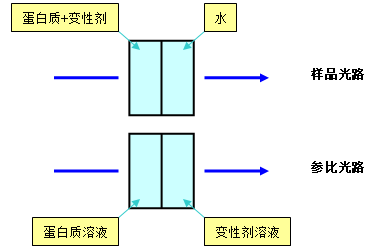
蛋白质变性使分子中酪氨酸、色氨酸和苯丙氨酸残基所处的微环境发生变化,从而引起紫外吸收波长改变。由于这种变化较小,直接测定时误差较大,而紫外差示光谱法则可以将光谱曲线的微小变化放大,减少测定的误差。本实验以盐酸胍作为变性剂,测定280nm处紫外差示吸收ΔA280随变性剂浓度的变化情况。从紫外差吸收可以计算出蛋白质在不同变性剂浓度下的变性的分数,再经过作图,将变性剂浓度外推到0即为蛋白质的构象稳定性。
二、实验材料
1. 盐酸胍(分析纯)
2. 大豆蛋白质凝乳
三、仪器设备
离心机、烧杯(250ml)、紫外分光光度计、0.5cm石英比色皿、旋涡混合器、具塞试管10ml、试管架、移液管、电磁搅拌器、pH计、台式离心机、水浴锅、塑料保鲜膜。
四、样品制备
1. 称取湿凝乳10克,置于250ml烧杯中,加入30ml水,待完全分散后用1N NaOH溶液将pH调至7.0,电磁搅拌10分钟。然后于3000 rpm离心10分钟,后所得上清液即为大豆蛋白储备液。
2.制备6.67mol/L盐酸胍储备溶液。
五、实验操作方法
1.取10ml试管1支,加入大豆蛋白储备溶液0.5ml,然后加入蒸馏水4.5ml。
2.取10ml试管10支,分别加入大豆蛋白储备溶液0.5ml,然后分别加入蒸馏水4.5、4.0、3.5、3.0、2.5、2.0、1.5、1.0、0.5、0.0ml,再分别加入盐酸胍储备溶液0.0、0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5ml,制备成变性剂浓度不同的蛋白质溶液。
3.另外取10ml试管10支,分别加入蒸馏水5.0、4.5、4.0、3.5、3.0、2.5、2.0、1.5、1.0、0.5ml,然后分别加入盐酸胍储备溶液0.0、0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5ml制备浓度不同的变性剂溶液。
4.将上述试管用保鲜膜将管口封住后在25℃水浴上保温30min。
5.按下图方法分别测定280nm处的紫外吸收ΔA
6.记录不同变性剂浓度时的紫外吸收。
0.023、0.023、0.021、0.024、0.019、0.027、0.014、0.011、0.011、0.008
7.计算fu = (ΔA6M—ΔA)/((ΔA6M —ΔA0),K = fu /(1-fu)与幻不同,ΔG = ―RT ln K
8. 以ΔG对变性剂浓度作图,将变性剂浓度外推到0,求出大豆蛋白的构象稳定性。
实验四 大豆分离蛋白亚基分子量的测定
SDS-聚丙烯酰胺凝胶电泳法
一、实验材料
低分子量标准蛋白试剂盒:分子量范围14000~97000。
湿凝乳。
二、仪器设备
电泳仪、垂直板电泳槽、微量进样器(70μl)、培养皿(12-14cm)、长滴管、移液管、酸度计、小烧杯(20ml)。
三、电泳试剂的配制
1.四甲基乙二胺(TEMED)原液;
2.10%(W/V)SDS溶液:称5克SDS,加重蒸水至50ml,微热使其溶解。
3. 10%(W/V)过硫酸铵(AP):称取AP1克,加重蒸水至10ml。临用前配制。
4.凝胶贮液
30%分离胶贮液:称取丙烯酰胺30克,甲叉双丙烯酰胺0.8克,溶于重蒸水中,最后定容至100ml,过滤后置于棕色瓶中备用。
10%浓缩胶贮液:称取丙烯酰胺10克,甲叉双丙烯酰胺0.5克,溶于重蒸水中,最后定容至100ml,过滤后置于棕色瓶中备用。
5.凝胶缓冲液
分离胶缓冲液(3.0mol/L pH8.9 Tris-HCL缓冲液):称Tris36.3g,加少许重蒸水使其溶解,再加1 mol/LHCL约48ml调pH至8.9,最后加重蒸水定容至100ml。
浓缩胶缓冲液(0.5mol/L pH6.7 Tris-HCL缓冲液):称Tris6.0g,加少许重蒸水使其溶解,再加1 mol/LHCL约48ml调pH至6.7,最后加重蒸水定容至100ml。
6.电极缓冲液(内含0.1%SDS,0.05 mol/L Tris-0.384 mol/L甘氨酸缓冲液pH8.3):称Tris6.0g, 甘氨酸28.8 g,加入10%SDS10ml,加重蒸水使其溶解后定容至1000ml。
7.1%琼脂糖溶液:称琼脂糖1克,加电极缓冲液100 ml,加热使其溶解。
8.固定液:取50%的甲醇454 ml,冰乙酸46 ml混匀。
9.染色液:称考马斯亮蓝R-250 0.125 g,加上述固定液250 ml,过滤后应用。
10.脱色液:冰乙酸75 ml,加蒸馏水定容至1000 ml。
五.样品制备
1.样品溶解液的配制:内含2%SDS,5%的巯基乙醇,10%甘油,0.02%溴酚蓝,0.01 mol/L pH8.0 Tris-HCL缓冲液。
先配制0.05 mol/L pH8.0 Tris-HCL缓冲液:称Tris0.6 g,加50 ml重蒸水使其溶解,再加1 mol/LHCL约3 ml调pH至8.0,最后加重蒸水定容至100 ml。
再按下表配制样品溶解液:

2.样品处理:
称取湿凝乳50mg,溶于10 ml样品溶解液中,搅拌提取30分钟,然后于3000转每分离心10分钟,取上清液上样。
六.实验操作方法
1.安装夹心式垂直板电泳槽:
(1)将长、短玻璃板分别插到橡胶框的凹形槽中。注意勿用手接触灌胶面的玻璃。
(2)将已插好玻璃板的橡胶模插入电泳槽中,双手以对角线的方式旋紧螺丝帽。
(3)竖直电泳槽,在长玻璃板下端与硅橡胶框交界的缝隙内加入已融化的1%琼脂糖。其目的是封住空隙,凝固后的琼脂糖中应避免有气泡。
2.配胶:
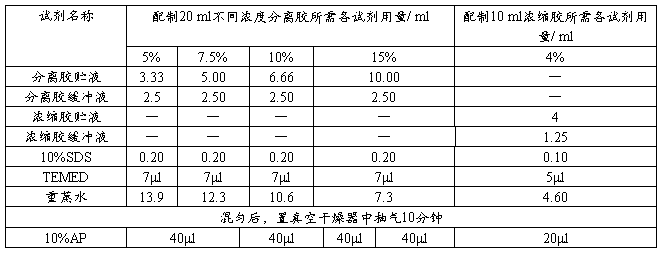
根据所测蛋白质分子量范围,选择适宜的分离胶浓度。入下表所示:
注:AP的用量根据室温酌量添加。
3.凝胶板的制备
(1)分离胶的制备:按上表配制20ml 10%的分离胶,加AP 混匀后用细长头滴管将凝胶液加至长、短玻璃板间的缝隙内,约8cm高,用1ml注射器取少许蒸馏水,沿长玻璃板板壁缓慢注入,约3-4mm高,以进行水封。约40min后,凝胶与水封层间出现折射率不同的界线,则表示凝胶完全聚合。倾去水封层的蒸馏水,再用滤纸条吸去多余水分。
(2)浓缩胶的制备:按上表配制10ml 4%的浓缩胶,用细长头滴管将浓缩胶加到已聚合的分离胶上方,直至距离短玻璃板上端约0.5cm处,轻轻将样品槽模板插入浓缩胶内,越30min后凝胶聚合,再过20-30min使凝胶“老化”。小心拔去样品槽模板,用窄条滤纸吸去槽内多余水分,将pH8.3的电极缓冲液倒入上、下贮槽中,应没过短板约0.5cm以上,即可准备加样。
3.加样
用微量注射器吸取10-15μl处理过的样品上清液,通过电极缓冲液伸入加样槽内,尽量接近底部,轻轻推动微量注射器,注意针头勿碰破凹形槽胶面。
4.电泳
将电泳槽的短板接负极,长板接正极,开始电泳。开始电流为10mA左右,待样品进入分离胶后改为20-30mA,当染料前沿距橡胶框底边1.5cm时,停止电泳。
5.凝胶板剥离与固定
电泳结束后,取下凝胶模,卸下橡胶框,用镊子撬开短玻璃板,在凝胶板上切下一角作为加样标志。在两侧溴酚蓝染料区带中心插入细铜丝作为前沿标记,将凝胶板放入大培养皿内,加入固定液,固定过夜。
6.染色与脱色
将染色液倒入培养皿内染色1小时左右,用蒸馏水漂洗数次,再用脱色液脱色,直至蛋白质区带清晰,即可计算相对迁移率。
七.结果计算
将大培养皿放在一张坐标纸上,量出加样端距细铜丝间的距离,以及各样品区带中心与加样端的距离。按下式计算相对迁移率mR:

以标准蛋白质的相对迁移率为横坐标,标准蛋白质分子量为纵坐标在半对数坐标纸上作图,得到一条标准曲线。根据未知蛋白质样品相对迁移率可直接在标准曲线上查出其分子量
习题
1.聚丙烯酰胺凝胶电泳分离蛋白质等生物大分子的基础是什么?
2.本实验中,缓冲体系是十分重要的,因为蛋白质电荷量的大小是由体系的PH决定,对否
3.聚丙烯酰胺凝胶电泳的另一个重要内容,是测定蛋白质的等电点,请叙述其原理。
实验五氨基酸自动分析仪测定大豆分离蛋白
一、原理
氨基酸的组成分析,现代广泛地采用离子交换法,并由自动化的仪器来完成。其原理是利用各种氨基酸的酸碱性、极性和分子量大小不同等性质,使用阳离子交换树脂在色谱柱上进行分离。当样液加入色谱柱顶端后,采用不同的pH值和离子浓度的缓冲液即将它们依次洗脱下来,即先是酸性氨基酸和极性较大的氨基酸,其次是非极性的和芳香性氨基酸,最后是碱性氨基酸;分子量小的比分离量大的先被洗脱下来,洗脱下来的氨基酸可用茚三酮显色,从而定量各种氨基酸。
定量测定的依据是氨基酸和茚三酮反应生成蓝紫色化合物的颜色深浅与各有关氨基酸的含量成正比。但辅氨酸和羟辅氨酸则生成黄棕色化合物,故需在另外波长处定量测定。
阳离子交换树脂是由聚苯乙烯与二乙烯苯经交联在磺化而车成,其交联度为8。
二、仪器
氨基酸自动分析仪
三、实验步骤
样品处理:测定蛋白质的氨基酸组成时样品必须经酸水解,使蛋白质完全变成氨基酸后才能上柱进行分析。
酸水解的方法:称取经干燥凝乳数毫克,加入2 ml 5.7 mol/L盐酸,置于110℃烘箱内水解24小时,然后除去过量的盐酸,加缓冲液稀释到一定体积,摇匀。取一定量的水解样品上柱进行分析。
样品分析:经过处理后的样品上柱进行分析。上柱的样品量视所用自动分析仪的灵敏度而定。一般为每种氨基酸0.1μmol左右(水解样品干重为0.3mg左右)。对于一些未知蛋白质含量的样品,水解后必须预先测定氨基酸的大致含量后才能分析,否则会出现过多或过少的现象。测定必须在pH5-5.5、100℃下进行,反应时间为10-15分钟,生成的紫色物质在570 nm波长下进行比色测定。而生成的黄色化合物在440nm波长下进行比色测定。做一个氨基酸全分析一般只需1小时左右,同时可将几十个样品一道装入仪器,自动按序分析,最后自动计算给出精确的数据。仪器精确度在±1-3%。
结果计算
带有数据机的仪器,各种氨基酸的定量结果能自动打印出来,否则,可用尺子测量峰高或峰高乘以半峰宽确定峰面积而计算出氨基酸的精确含量。另外,根据峰出现的时间可以确定氨基酸的种类。
习题
1.氨基酸分析仪内的色谱柱是阳离子交换树脂,请问该树脂带什么电荷?氨基酸的洗脱次序有什么规律?
2.如何用氨基酸分析图谱来定性氨基酸?从氨基酸分析图谱中可得到哪些信息?
3.氨基酸分析测定时的水解,与实验二中消化水解有什么区别?
实验六 大豆分离蛋白乳化性能的测定
一、试剂及仪器
1)色拉油
2)DS-1型高速组织均匀机
3)4×50ml离心机
4)带刻度50ml离心管2支
5)恒温水浴锅
6)酸度计
二、实验步骤
1.样品准备
在150ml烧杯中称取湿凝乳10.00克,加水40ml,用1 mol/LNaOH将pH调到7。
2.乳化性测定
取上述大豆蛋白溶液30ml,加30ml色拉油,在20000rpm速度下匀浆1分钟,再于1300离心5分钟,按下式计算乳化能力。

3.乳化稳定性
将上述测乳化性样品置于80℃水浴中加热30分钟,再于自来水中冷却15分钟,于1300rpm离心5分钟,计算公式:

习题
在乳化性实验中,经过1300 rmp,5分钟的离心,乳化液仍不能分层,您认为问题在哪里?
第二篇:化学实验报告
化学实验报告: 化学实验报告:淬火和回火 实验报告实验用品 步骤和方法1.淬火: 取两根缝 衣针, 用茄子夹住 放在火焰上烧纸 红热后, 立即放入 冷水中。现象缝衣针无法被弯曲分析和结论缝衣针 两根 镊子经淬火后的钢 韧性降低装 有 冷 水 的 2. 将 冷 却 后 的 针 碗一个 取出取其中的一 根, 试验能否将其 弯曲。缝衣针很容易被弯曲 甚至被折断 3. 用 镊 子 家 住 另 一根经淬火后的 针, 放在火焰上微 热 (不要使钢针烧 红) ,然后放在空 气中自然冷却, 试 验能否将其弯曲。经回火后的钢 韧性恢复被折断的针初三( 初三(4)班 寇俊
