实验报告
一、 实验名称:从牛奶中分离酪蛋白
二、 实验目的:
1. 学习从胶体中提取某一类物质的方法。
2. 学习蛋白质的各种颜色反应及其原理。
三、 实验原理:
1. 蛋白质是两性化合物,溶液的酸碱性直接影响蛋白质分子所带的电荷。当调节牛奶的pH值达到酪蛋白的等电点(pl)4.8左右时,蛋白质所带正、负电荷相等,呈电中性,此时酪蛋白的溶解度最小,会以沉淀形式从牛奶中析出。
2. 缩二脲反应原理:具有两个或两个以上肽键的化合物在碱性条件下与Cu2+反应,生成红紫色的络合物。所有的蛋白质均有此显色反应。
3. 蛋白黄色反应原理:硝酸将蛋白质分子中的苯环硝化,在加热状态下产生了黄色硝基苯衍生物,再加碱颜色加深呈橙黄色。这是含有芳香族氨基酸特别是含有酪氨酸和色氨酸的蛋白质所特有的颜色反应。
4. 茚三酮反应原理:蛋白质与茚三酮共热,产生蓝紫色的还原茚三酮、茚三酮和氨的缩合物。此反应为一切氨基酸及α-氨基酸所共有。
四、 实验步骤及现象:
1. 取50mL脱脂牛奶于150mL烧杯中,用热水浴加热至40℃,维持此温度,边搅拌边加稀醋酸(1:9)溶液约2mL——有白色沉淀析出。
2. 继续搅拌并使悬浊液冷却至室温,然后将混合物转入离心杯中,于3000r/min离心15min。
3. 离心完毕后,上清液倒入乳糖回收瓶中,沉淀用95%的乙醇(20ml)搅匀,然后用布氏漏斗减压过滤,用乙醇-乙醚(1:1)混合液洗涤沉淀2次,每次约10ml,最后用5ml乙醚洗涤沉淀一次,减压过滤至干——得到干燥的白色固体。
4. 将干粉铺于表面皿上,称量并计算牛奶中酪蛋白含量。
5. 称取0.5g酪蛋白,溶解于0.4M氢氧化钠溶液的生理盐水(5mL)中,然后滴加3-4滴1%硫酸铜溶液,振荡试管——溶液变成紫色。
五、 实验数据:
空表面皿的质量m0 =28.15g
表面皿与酪蛋白的总质量m1 =31.78g
牛奶中酪蛋白的质量m= m1 - m0 =3.63g
六、 讨论与感想:
1. 牛奶是一种胶体,在正常情况下是均一稳定的,要想分离出其中的某一成分,就应该想办法使这种成分变成沉淀析出。通过本次实验,我知道了可以通过调节胶体的酸碱性,来改变蛋白质分子所带电荷,使其达到等电点。此时蛋白质分子间的电荷作用力最小,分子间没有了间隙,浮力减小,蛋白质就会沉淀。而实验中50ml牛奶和2ml稀醋酸(1:9)所配成的混合液的pH恰好在4.8左右,正好是蛋白质的
1
2.
3.
4.
5.
6.
7. 等电点,从而可以使最多的酪蛋白沉淀析出。 加入的醋酸不能过量,过量酸会促使牛奶中的乳糖水解为半乳糖和葡萄糖,难以将酪蛋白分离。 析出的酪蛋白沉淀是絮状物,直接过滤会堵塞漏斗孔,所以要先对悬浊液进行离心操作,使得絮状物富集,便于过滤。 用乙醇-乙醚混合液洗涤沉淀的原因是因为酪蛋白不溶于乙醇和乙醚,而脂质溶于其中,可以用来洗涤除去酪蛋白粗制品中的脂质。 理论上最终得到的酪蛋白应该是纯白色的,但是实际得到的酪蛋白表面会有一些黄色物质,这些黄色物质是没有洗净的残留脂质。其原因可能是在用乙醇-乙醚混合液洗涤沉淀的时候,没有充分搅拌,使得洗涤不彻底。 通过查找资料得知,蛋白质的颜色反应是不同物质与蛋白质中的特定结构(例如肽键、苯环、氨基酸等)的反应,因为反应能产生特定的颜色,所以可以用来鉴定蛋白质。但是也要注意,颜色反应不是蛋白质的专一反应,一些非蛋白物质也可产生相同颜色反应,因此不能仅根据颜色反应的结果决定被测物是否是蛋白质。颜色反应是一些常用的蛋白质定性和定量测定的依据。 离心仪是本次实验中第一次接触到的器械,它的使用也有注意事项:处于相对位置
的两个离心杯要保证质量相同,因为高速转动需要很大的向心力,如果相对位置的两个离心杯质量不同,会使得转轴受力不均匀,可能导致转轴弯曲。所以,在放入离心机之前,要用天平比较两个离心杯和其中液体的质量,并进行适当调整。
2
第二篇:牛奶中酪蛋白和乳糖的分离及纯度测定
第21卷 第3期大学化学20xx年6月牛奶中酪蛋白和乳糖的分离及纯度测定
周夏衍 夏春兰 楚延锋 付晓平 邓立志 周鑫玉
(武汉大学化学与分子科学学院 武汉430072)
摘要 分离牛奶中的酪蛋白和乳糖,并对其纯度进行测定。以此作为物理化学设计实验的部
分内容。
“牛奶中酪蛋白和乳糖的分离及鉴定”作为物理化学的设计实验,其主要实验内容包括:①通过调节pH分离牛奶中酪蛋白和乳糖;②试验酪蛋白和乳糖的鉴定方法;③泳实验分离不同形态的酪蛋白。实验综合了分离技术、、。“牛奶中酪蛋白和乳糖的分离及纯度测定”1 牛奶中酪蛋白的分离
、乳糖和盐组成。酪蛋白是牛奶中的主要蛋白质,。蛋白质是两性化合物,当调节牛奶的pH达到酪蛋白的等电点(pH=4.8)时,蛋白质所带正、负电荷相等,呈电中性,此时酪蛋白的溶解度最小,会从牛奶中沉淀出来,以此分离酪蛋白。因酪蛋白不溶于乙醇和乙醚,可用此两种溶剂除去酪蛋白中的脂肪。
取50mL新鲜牛奶,在恒温水浴中加热至40℃,边搅拌边慢慢加入10%醋酸溶液,使牛奶pH=4.8,放置冷却、澄清后,用尼龙布过滤酪蛋白。(在滤液中加入少量粉状碳酸钙,留作乳
)依次用乙醇、糖的分离。乙醇和乙醚的等体积混合液、乙醚洗涤酪蛋白,去除脂肪,待酪蛋白
充分干燥后称量其重量,并计算牛奶中酪蛋白的含量。
2 牛奶中乳糖的分离
乳糖是一种二糖,它由D2半乳糖分子C′上的半缩醛羟基和D2葡萄糖分子C4上的醇羟基脱水通过β21,4苷键连接而成。乳糖是还原性糖,绝大部分以α2乳糖和β2乳糖两种同分异构
2020体型态存在,α2乳糖的比旋光[α]D=+86°,β2乳糖的比旋光[α]D=+35°,水溶液中两种乳
糖可互相转变,因此其水溶液有变旋光现象。乳糖也不溶于乙醇,当乙醇混入乳糖水溶液中,乳糖会结晶出来,从而达到分离的目的。
将1中加入碳酸钙的滤液置于蒸发皿中,用蒸汽浴浓缩至约15mL,稍冷后,在热溶液中加入约90mL95%乙醇,再加热,使其混合均匀,趁热过滤,滤液应澄清。滤液移至锥形瓶中,加塞,放置1~2天,让乳糖充分结晶,过滤分离出乳糖晶体。用冷的95%乙醇洗涤结晶,一般应对乳糖重结晶,干燥后称重,计算牛奶中乳糖的含量。
50

3 酪蛋白的纯度测定
用双缩脲法测定酪蛋白的含量。在碱性溶液中双缩脲与铜离子结合形成复杂的紫红色复合物,而蛋白质及多肽的肽键与双缩脲的结构类似,也能与铜离子在碱性环境中形成紫红色复合物,其最大吸收光波长为540nm。该复合物颜色的深浅与蛋白质的浓度成正比,而与蛋白质的分子量及氨基酸组成无关。 配制双缩脲试剂:取1.5g硫酸铜(CuSO4?5H2O)和6.0g酒石酸钾钠(NaKC4H4O6?4H2O)溶
2+
于500mL蒸馏水中,搅拌加入300mL的10%NaOH溶液(可另加1gKI,以防止Cu自动还原成一价氧化亚铜沉淀),用水定容至1000mL。此试剂可长期保存,若有黑色沉淀需重配。 酪蛋白标准曲线的制作:取7个容量瓶编号,按表1操作。
[1]
表1 测定酪蛋白标准曲线的溶液配制
编号
1234567
V/mL
标准酪蛋白溶液
01.002.003.004.005.蒸馏水
6.005.004.00双缩脲试剂
20.0020.0020.00
20.0020.00
:0.NaOH溶液溶解酪蛋白(CP),加热或放置过夜助溶,配
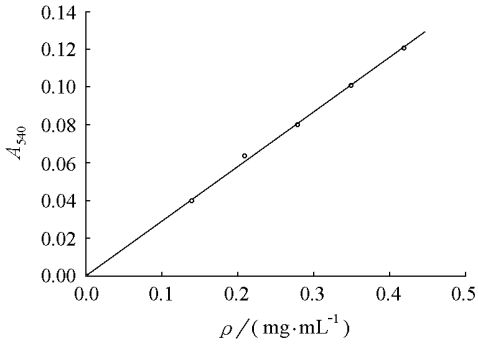
充分混匀后,在60℃水浴中放置30min,冷却至室温,用VIS27220分光光度计在540nm波长下测定其吸光度。以吸光度A540为纵坐标,酪蛋白溶液质量浓度为横坐标,绘制标准曲线(图1)。 酪蛋白溶液标准曲线的拟合式为A=5.711×-4
ρ10+0.2879,R=0.99939,其中A为吸光度,ρ为酪蛋白溶液质量浓度,R为相关系数。
将从牛奶中分离的酪蛋白配成合适的浓度,在上述相同条件下,测定其吸光度。由标准曲线计算纯酪蛋白的浓度,与实际浓度比较,计算从牛
图1 酪蛋白溶液标准曲线
奶中分离出来的酪蛋白的纯度。
测定从牛奶中分离的酪蛋白的纯度一般在90%以上。4 乳糖的纯度测定
不同浓度的乳糖溶液具有不同的旋光度

,其旋光度与浓度成正比。因乳糖具有变旋光现象,其溶液需放置数小时或加入2滴浓氨水,使之达到平衡,再测定旋光度。 配制不同浓度的标准乳糖溶液,放置过夜,用341旋光仪测定其旋光度。乳糖为分析纯,
25
含一个分子结晶水,[α]D=52°。以旋光度为纵坐标,乳糖溶液质量浓度为横坐标,绘制标准
51
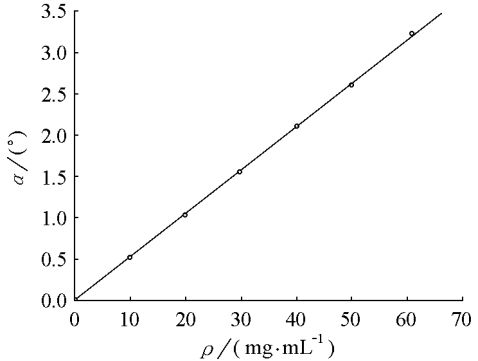
曲线(图2)。
乳糖溶液标准曲线的拟合式为α=-0.006+
ρ0.0528,R=0.9999,其中α为旋光度,ρ为乳糖溶
液质量浓度,R为相关系数。
将从牛奶中分离的乳糖配制成合适的浓度,先
测定其变旋光,后加入2滴浓氨水摇匀,静置20min后,测定平衡时的旋光度。由标准曲线计算纯乳糖
的浓度,与实际浓度比较,计算从牛奶中分离出来
的乳糖的纯度。
测定从牛奶中分离的乳糖的纯度一般在90%
以上。
5 实验注意事项 图2 乳糖溶液标准曲线
①酪蛋白等电点随温度不同而变化,等电点pH为4.6~4.8。分离酪蛋白时,边加醋酸,边搅拌,边测pH,同时观察沉淀。开始快搅拌,接近等电点时,应慢搅拌。 ②酪蛋白沉淀用200目的尼龙布过滤比较好,;而用纱布过滤,酪蛋白容易粘在其上。
,、浸泡,充分洗净脂肪。,应使酪蛋白与双缩脲试剂反应完全,否则测量结果不准。
⑤首次结晶出来的乳糖含有杂质,一般需要重结晶,否则乳糖难以溶解,且溶液混浊,测定的旋光度不准。
⑥测定乳糖的平衡旋光度时,应放置数小时或加入2滴浓氨水,待平衡后再测。
参 考 文 献
1 李如亮.生物化学实验.武汉:武汉大学出版社,1998 (上接第49页)
参 考 文 献
1 高鸿.分析化学前沿.北京:科学出版社,1991
2 陈炳稔,何广平,凌莫育.应用化学,1997,14(6):75
3 陈炳稔,何广平,刘小珠.化学通报,1998(10):43
4 赵振国,顾惕人.化学学报,1983,41(12):1091
5 HeGuangping,ChenBinren.ChineseJournalofReactivePolymers,2001,10(2):15452

