食醋中总酸度的测定
一、教学要求
1、学会食醋中总酸度的测定原理和方法。
2、掌握指示剂的选择原则。
3、比较不同指示剂对滴定结果的影响。
4、加强移液管的使用;
5、掌握强碱滴定弱酸的滴定过程,突跃范围及指示剂的选择原理。
二、预习内容
1、碱式滴定管的规格、洗涤、润洗等操作步骤;
2、NaOH溶液的储存注意事项;
3、吸量管的使用;
三、基本操作
1、吸量管的使用
要准确移取一定体积的液体时,常使用吸管。吸管有无分度吸管(又称移液管)和有分度吸管(又称吸量管)两种。如需吸取5mL、10mL、25mL等整数,用相应大小的无分度吸管,而不用有分度吸管。量取小体积且不是整数时,一般用有分度吸管,使用时,令液面从某一分度(通常为最高标线)降到另一分度,两分度间的体积刚好等于所需量取的体积,通常不把溶液放到底部。在同一实验中,尽可能使用同一吸管的同一段,而且尽可能使用上面部分,不用末端收缩部分。
使用前,依次用洗液、自来水、蒸馏水洗涤,最后再取少量被量液体荡洗3次,以保证被吸取的溶液浓度不变。蒸馏水和溶液荡洗的用量由吸管大小决定,无分度吸管以液面上升到球部为限,有分度吸管则以充满全部体积的1/5为限。
用吸管吸取溶液时,左手拿洗耳球(预先排除空气),右手拇指及中指拿住管颈标线以上的地方。吸管下端至少伸入液面1cm,不要伸入太多,以免管口外壁沾附溶液过多,也不要伸入太少,以免液面下降后吸空。用洗耳球慢慢吸取溶液,眼睛注意正在上升的液面位置,吸管应随容器中液面下降而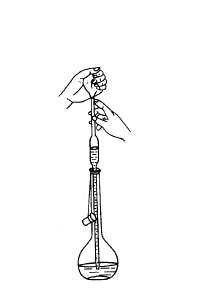

用移液管吸取溶液 从移液管放出溶液
降低。当溶液上升到标线以上时迅速用右手食指紧按管口,取出吸管,左手拿住盛溶液的容器,并倾斜约45°。右手垂直地拿住吸管,使其管尖靠住液面以上的容器壁,微微抬起食指,当液面缓缓下降到与标线相切时,立即紧按食指,使流体不再流出。再把吸管移入准备接收溶液的容器中,仍使其管尖接触容器壁,让接收容器倾斜,吸管直立,抬起食指,溶液就自由地沿壁流下。待溶液流尽后,约等15s,取出吸管。注意,不要把残留在管尖的液体吹出(除非吸管上注明“吹”字),因为在校准吸管容积时没有把这部分液体包括在内。
2、滴定管的使用:
(1)定义:
滴定管是可准确测量滴定剂体积的玻璃量器。
(2)类别:
酸式滴定管:(特征—玻璃旋塞)用于盛放酸性溶液、中性溶液和氧化性溶液。
碱式滴定管:(特征—橡皮管+玻璃珠)用于盛放碱性和无氧化性溶液。
(3)滴定管的准备:
a、用前检查:检查是否漏水,旋塞转动是否灵活;酸式管涂凡士林;碱式管更换胶皮管或玻璃球。
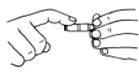
活塞涂凡士林 碱式滴定管赶去气泡的方法
b、洗涤:要求管壁湿润洁净,不挂水珠。
(4)溶液的装入:
a、用待装液润洗2~3次,每次约10mL;b、装液至0.00刻度以上;
c、排气泡; d、调节初读数为0.00,或近0的任一刻度,以减小体积误差。
(4)滴定操作:
a、酸式滴定管:左手无名指和小指向手心弯曲,其余三指,拇指在前,食指、中指在后,轻扣旋塞,转动。
碱式滴定管:左手无名指及小指夹住尖嘴管,拇指与食指捏乳胶管,使玻璃球向手心移动,停止时,先松拇指和食指。
b、滴加方法:逐滴连续滴加;加一滴;使液滴悬而未落,即加半滴于锥形瓶壁(或用蒸馏水冲下或用溶液涮下)。
c、锥形瓶:右手三指拿住瓶颈,瓶底离台约2~3cm,滴定管下端深入瓶口约1cm,同一方向圆周运动,边滴边摇动。
d、注意事项:滴定时,左手不能离开旋塞任其自流;眼睛注意落点周围溶液颜色的变化;开始时可稍快,最后加半滴。
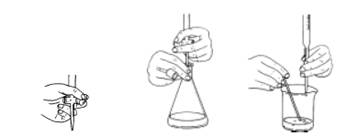
左手操作活塞 酸管滴定操作 碱管滴定操作
(5)读数:
a、装满或滴定完后,等1~2分钟再读数;若滴定速度较慢可等0.5~1分钟。
b、将滴定管从架上取下,用右手大拇指和食指捏住无刻度处,其他手指辅助,保持垂直,视线与凹液底部平行(深色溶液读两侧最高点);读取的数值必须记录至小数点后第二位。
(6)滴定结束:
滴定管内剩余溶液应弃去,洗净滴定管,并用蒸馏水充满,夹在夹上备用。
四、实验原理
食醋是混合酸,其主要成分是HAc(有机弱酸,Ka=1.8×10-5),与NaOH反应产物为弱酸强碱盐NaAc:
HAc + NaOH = NaAc + H2O
HAc与NaOH反应产物为弱酸强碱盐NaAc,化学计量点时pH≈8.7,滴定突跃在碱性范围内(如:0.1mol·L-1NaOH 滴定0.1mol·L-1HAc突跃范围为PH:7.74~9.70),在此若使用在酸性范围内变色的指示剂如甲基橙,将引起很大的滴定误差(该反应化学计量点时溶液呈弱碱性,酸性范围内变色的指示剂变色时,溶液呈弱酸性,则滴定不完全)。因此在此应选择在碱性范围内变色的指示剂酚酞(8.0~9.6)。(指示剂的选择主要以滴定突跃范围为依据,指示剂的变色范围应全部或一部分在滴定突跃范围内,则终点误差小于0.1%)
因此可选用酚酞作指示剂,利用NaOH标准溶液测定HAc含量。食醋中总酸度用HAc含量的含量来表示。
五、实验步骤
1、进入实验室,将实验要用到的有关仪器从仪器橱中取出,把玻璃器皿按洗涤要求洗涤干净备用。
2、用配制且已标定好的NaOH溶液润洗洗涤好的碱式滴定管,然后装入NaOH溶液。
3、用移液管吸取食醋试样5.00mL,移入250mL锥形瓶中,加入20mL蒸馏水稀释(思考题1),加酚酞指示剂2滴(思考题2),用NaOH标准溶液滴定至终点。平行测定2~3次。记录NaOH标准溶液的用量,按下式计算食醋中总酸量。
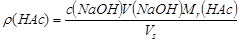
4、用甲基红作指示剂,用上法滴定,计算结果,比较两种指示剂结果之间的差别(思考题3)。
六、注意事项
1、注意食醋取后应立即将试剂瓶盖盖好,防止挥发。
2、甲基红作指示剂时,注意观察终点颜色的变化。
3、数据处理时应注意最终结果的表示方式。
七、思考题和测试题
以NaOH溶液滴定HAc溶液,属于哪类滴定?怎样选择指示剂?
答:属于强碱滴定弱酸型的,最后生成的产物盐为强碱弱酸盐,且溶液呈碱性,所以用碱中变色的指示剂,可想而知酚酞最为理想了
思考题1、加入20mL蒸馏水的作用是什么?
思考题2、为什么使用酚酞作指示剂?
思考题3、为什么使用甲基红作指示剂,消耗的NaOH标准溶液的体积偏小?
思考题答案:
1答:使被滴定体系体积与NaOH标准溶液标定时一致,减小体积变化引起的指示剂终点颜色的差别。
思考题2答:反应产物为NaAc,其水溶液呈弱碱性,即滴定终点在弱碱性范围,故选择酚酞作指示剂;不能用甲基橙作指示剂,会使滴定结果偏低。
思考题3答:甲基红发生颜色变化时,溶液为弱酸性,溶液中还有一定量的HAc没有反应,所以消耗的NaOH标准溶液的体积偏小。
测试题1、如果NaOH标准溶液在放置的程中吸收了CO2,测定结果偏低( )。A 正确 B错误
测试题2、选用甲基红作指示剂,测定结果偏低( )。A 正确 B错误
测试题3、用移液管吸取食醋试样5.00mL,移入250mL锥形瓶中,加入的20mL蒸馏水必须精确()。A 正确 B错误
测试题4、用酚酞作指示剂时,加入过多的指示剂可使测定结果偏高( )。A 正确 B错误
测试题答案:]1、B ;2、A ;3、B ;4、B ;
第二篇:食用醋中醋酸含量的测定
食用醋中醋酸含量的测定
一、实验目的
1、了解实样分析的方法
2、掌握碱标准溶液的标定方法;
3、掌握食醋总酸度的测定原理、方法和操作技术。
二、实验原理:
食醋中的酸性物质主要是醋酸,可以用酸碱中和反应原理,以已知浓度的氢氧化钠溶液进行中和滴定。反应方程式为:CH3COOH+NaOH=CH3COONa+H2O
NaOH在称量过程中不可避免地会吸收空气中的二氧化碳,使得配制的NaOH溶液浓度比真实值偏高,最终使实验测定结果偏高,因此,为得到更准确的数据,必须将NaOH溶液以标准酸溶液邻苯二甲酸氢钾(KHC8H4O4)标定。标定时遵守酸碱中和反应原理,其中参加反应的NaOH与KHC8H4O4的物质的量之比为1∶1。
三、实验器材
试剂:醋精、糯米甜醋、白醋、陈醋、自制家醋、邻苯二甲酸氢钾、氢氧化钠、活性炭、酚酞。
仪器:烧杯、容量瓶、玻璃棒、锥形瓶、25mL酸式滴定管、25mL碱式滴定管、漏斗、滤纸、铁架台、托盘天平、25mL移液管、婆梅氏重表、分析天平、洗耳球。
四、实验步骤
食醋的中和滴定
1用移液管准确量取上述滤液各25mL,转移到250mL容量瓶中加蒸馏水到刻度线,配制成稀醋酸溶液。
2将上述各种稀醋酸溶液注入酸式滴定管中并调整液面在“0”刻度线或以下,读取刻度。
3用托盘天平准确称取200g NaOH固体,配制成500mL溶液。
4将上述NaOH溶液注入碱式滴定管中,并调整液面读取刻度。
5根据不同食醋的特点,分别从酸式滴定管中放入约20mL、10mL、5mL溶液于锥形中,滴加2~3滴酚酞指示剂,读取滴定管中刻度。
6左手控制碱式滴定者,右手不断摇晃锥形瓶,当锥形瓶里溶液呈浅红色,且在半分钟内不再褪色,停止滴定,读取滴定管刻度。
7重复2、4、5、6操作,再做六次上实验。
标定NaOH溶液
用标准酸溶——邻苯二甲酸氢钾(KHC8H4O4)标定实验所用的NaOH溶液:用分析天平准备称取一定质量的邻苯二甲酸氢钾(02000~03000g),倒入洁净的锥形瓶,加入25mL~30mL蒸馏水使邻苯二甲酸氢钾全部溶解,滴入2滴酚酞试液,然后用待标定的NaOH溶液滴定,当锥形瓶里溶液呈浅红色,且在半分钟内不再褪色,停止滴定,记录好实验数据。重复标定三次。
五、数据处理及初步实验结果分析
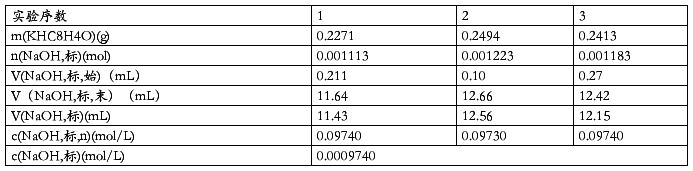
用邻苯二甲酸氢钾标定NaOH溶液的浓度的数据处理
由于KHC8H4O4与NaOH中和时,二者物质的量之比为1∶1,而KHC8H4O4的式量为204,摩尔质量为204g/mol,故:
n(NaOH,标)=n(KHC8H4O4)=m(KHC8H4O4)/204g/mol
c(NaOH,标)=n(NaOH,标)/V(NaOH,标)
数据处理如表一所示:
用标准酸溶液标定NaOH溶液
用NaOH溶液滴定各种食醋中醋酸含量的数据处理及初步实验结果分析
原各食醋中酸的浓度应为稀释后酸浓度的10倍,即附的数据记录表中食醋中酸浓度的10倍(其中c酸为用未经标定的NaOH浓度求算的数值,c′酸为用经标定的NaOH浓度求算的数值,下列各表相同)
表二 各种食醋中酸的浓度
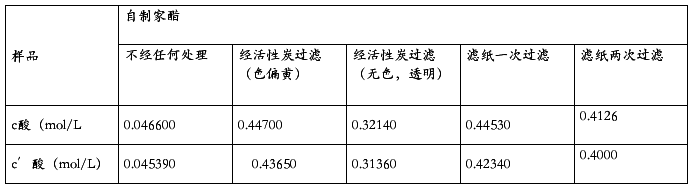
表三 各种食醋中酸的浓度

(1)0.1 mol·L-1 NaOH标准溶液的标定 用减量法准确称取0.3 ~0.4 g KHC8H4O4三份,加25 mL蒸馏水溶解。然后加1滴酚酞指示剂,用NaOH溶液滴定至终点。记录每次消耗NaOH溶液的体积。
(2)食醋试液的制备 取10 mL食醋样品,定容于250 mL容量瓶中。
(3)食醋总酸度的测定 用移液管移取稀释好的食醋试液25 mL放入锥形瓶中,加1~2滴酚酞指示剂,用NaOH标准溶液滴定至终点。记录NaOH消耗的体积,重复做2~3次。
六、注意事项:
(1)因食醋本身有很浅的颜色,而终点颜色又不够稳定,所以滴定近终点时要注意观察和控制。
(2)注意碱滴定管滴定前要赶走气泡,滴定过程中不要形成气泡。
(3)NaOH标准溶液滴定HAc,属强碱滴定弱酸,CO2的影响严重,注意除去所用碱标准溶液和蒸馏水中的CO2。
