蛋白酶的发酵及酶活力测定实验报告
学院:生物科学与工程学院
专业: 生物技术
班级: 1班
姓名:
学号:
摘要:蛋白酶是一类重要的工业用酶,广泛应用于食品、医药、洗涤剂、皮革、酿酒等行业。当前,食品工业用酶主要来自微生物,尤其是蛋白酶的应用最为广泛。作为一种生物催化剂,它具有催化反应速度快,无工业污染,催化反应条件适应性宽等的性质和优点。由于从植物和动物中生产蛋白酶具有的局限性,为了满足当今世界市场的需要,人们越来越多地把目光投到微生物蛋白酶上[2] 。微生物由于具有生长速度快、所需生长空间小、广泛的生化多样性及其遗传可操作性等特点,因而备受人们青睐。本文主要进行了菌种的生长曲线的绘制与菌种最佳发酵产酶时间等方面的研究。
关键字:蛋白酶 生长曲线 酶活力
第一章 前言
1.1研究的目的与意义
蛋白酶是工业酶中用得最多的一种酶,是催化蛋白质肽键水解的一类酶,它作用于蛋白质,将其分解为蛋白胨、多肽及游离氨基酸[1] ,约占酶总量的 60%,其中碱性蛋白酶就占 25%。有调查显示,酶制剂市场量最大的是洗涤剂用酶,第二位是淀粉加工用酶,以后依次为乳制品加工业、制酒工业、纺织工业和饮料加工业等用酶[2]。与动、植物来源的蛋白酶相比,利用微生物产的蛋白酶有易于培养、生长快、产量高、易于提取,适于大规模工业化生产,培养基的成本相对较低等优点,使微生物成为生产蛋白酶的重要来源和首选材料。
1.2 国内外研究概况
1.2.1 微生物蛋白酶的分类
由于从植物和动物中生产蛋白酶具有的局限性,为了满足当今世界市场的需要,人们越来越多地把目光投到微生物蛋白酶上[3]。当前工业用酶主要来源于微生物,微生物来源的蛋白酶按其作用的 pH 值的不同可分为三类,即碱性蛋白酶、中性蛋白酶及酸性蛋白酶,它们作用的最适 pH 值分别为碱性、中性及酸性。
1.2.2在食品工业中的应用
蛋白酶在食品工业上的应用主要是用在制干酪,蛋白质水解调味液,烤焙食品,肉类嫩化,功能性低聚肽和阿斯巴甜的合成等。食品加工使用的蛋白酶通常来自于枯草芽孢杆菌、地衣芽孢杆菌、米曲霉和黑曲霉等。
随着社会发展和生活水平不断提高,人们对肉类的需求量日益增长的同时,对肉的品质也提出了更高要求。微生物蛋白酶肉类嫩化剂是一种专门用于嫩化肉类的生物制剂,在适当温度下,可以断裂蛋白质中的某些肽键,提高肉的嫩度,使肉变得多汁、柔软、易于咀嚼,提高了肉的成品率、保质期和经济效益,因此十分经济且便于生产,并能取得显著效果。面包制作过程中,面粉中含有的不溶解性谷蛋白可以通过碱性蛋白酶限制性降解来修饰。用米曲霉蛋白酶和肽酶对面筋蛋白作有限的水解,可改善面团操作性能和机械性能,以适应不同制品的需要。酶处理后的面团其韧性和机械强度都有所增加。过量使用蛋白酶能减少面团的混合时间和增加面包产量。使用细菌蛋白酶可以增加面团的延展性[4]。
1.3本实验的研究内容
通过研究产蛋白酶菌来了解蛋白酶产生菌的生长情况,学会绘制其生长曲线,了解蛋白酶的性质及蛋白酶的测定原理,掌握蛋白酶的发酵及酶活力测定方法和掌握一定的知识与技能。
第二章 材料与设备
2.1菌种
产蛋白酶芽孢杆菌
2.2培养基
2.2.1牛肉膏蛋白胨培养基
2.2.2酪素培养基
2.3主要试剂材料
福林试剂、0.4mol/L的碳酸钠溶液、0.4mol/L的三氯乙酸、0.5mol/LNaOH溶液、1mol/L和0.1mol/L盐酸溶液 、硼酸缓冲液(pH=10.5)、10g酪素溶液、100ug/mL L--酪氨酸标准溶液
2.4主要仪器设备
UV1000分光光度计、恒温水浴锅、量筒、容量瓶、漏斗、试剂瓶、移液枪、吸管、离心管、枪头、摇床、培养基
第三章 分析测定方法
3.1福林-酚试剂法
福林-酚试剂在碱性条件下可被酚类化合物还原呈蓝色(钼蓝和钨蓝混合物),由于蛋白质分子中有含酚基的氨基酸(如酪氨酸、色氨酸等),可使蛋白质及其水解产物呈上述反应。因此可利用此原理测定蛋白酶活力。通常以酪蛋白为底物,在一定pH值和温度条件下,同酶液反应,经一段时间后终止酶促反应,经离心或过滤除去酪蛋白筹沉淀物后取上清液,用Na2CO3碱化,再加入福林-酚试剂显色,蓝色的深浅与滤液中生成产物酪氨酸量成正比;酪氨酸含量用分光光度计在680nm波长处测定,从而计算出蛋白酶的活力。
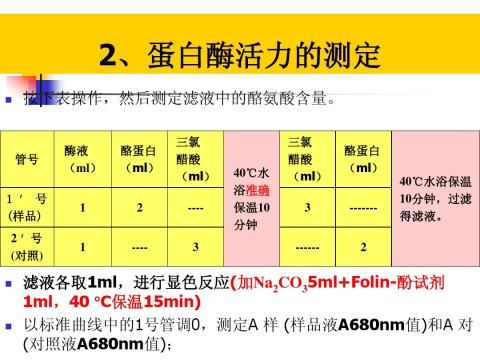
3.2蛋白酶活力测定方法
按中华人民共和国专业标准 SB/T 10317-1999:蛋白酶活力测定法[5]测定。
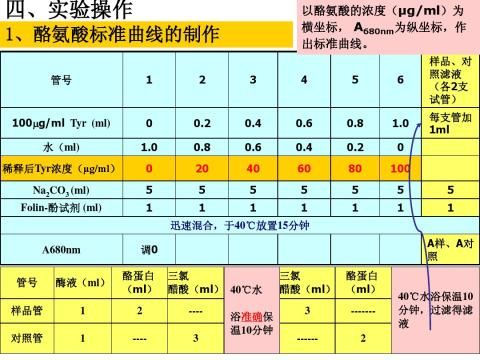
3.2.1标准曲线的制作
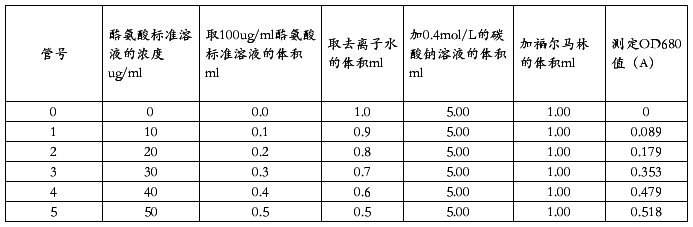
加完之后,置于40+0.2水浴中显色20min,取出,用分光度计于波长680nm,10mm比色皿,以不含酪氨酸的对照管为空白,分别测定其吸光度值。以吸光度值A为纵坐标,酪氨酸的浓度C为横坐标,绘制标准曲线,计算出OD680=1时的浓度,即为吸光常数K值。
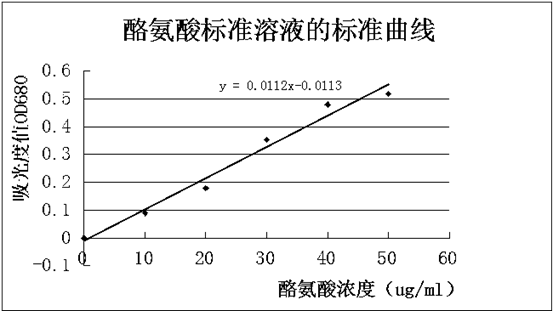
计算出OD680=1时的浓度,即为吸光常数K值,K=88.28。
3.2.2酶活力数值计算:
X= A×K×4/10×n
?式中:X——样品的酶活力,U/mL;A——样品平行试验的平均吸光度;K——吸光常数;4——反应试剂的总体积,mL;10——反应时间 10min,以 1min 计;n——稀释倍数。所得结果表示至整数。
第四章 试验方法
4.1试验流程
培养基的配置→活化菌种→培养取样→标准曲线绘制、生长曲线绘制和酶活测定
4.2培养基的制备
4.2.1牛肉膏蛋白胨培养基制备
配方:牛肉膏0.3g、蛋白胨1.0g、NaCl 0.5g、水1000ml、pH7.0~7.2、 121℃灭菌20min。
4.2.2酪素培养基制备
牛肉膏3g/L或酵母浸粉5g/L 酪素10g/L NaCl 4-5g/L PH7.2—7.4 先将酪素用少量2%氢氧化钠润湿,玻棒搅动,再加适量的蒸馏水,在沸水浴中加热搅拌至完全溶解(10-15min),补足1000mL蒸馏水,加入其他成分,调PH分装灭菌。
4.3菌种活化
将筛选好的并保藏在冰箱里中的未知的产蛋白酶实验菌接种2环于150 ml液体发酵培养基(牛肉膏蛋白胨培养基)的250 ml三角瓶中,30-32 ℃摇瓶发酵,在摇床里30℃震荡培养16到18小时,目的在于活化菌种并得到对数期菌种。在培养瓶中进行发酵。
4.4试剂的配制
4.4.1福林-酚试剂:向2000mL的磨口回流瓶中加入100g钨酸钠(Na2WO4.2H2O)、25g钼酸钠及700mL的去离子水,再加入50mL85%的磷酸及浓盐酸l00mL,充分混合后,接上回流冷凝管,以文火回流10h,结束后再加入150g的硫酸锂(LiSO4)、50mL去离子水及数滴溴水,再继续沸腾15min,以驱除过量的溴,冷却后滤液呈黄绿色(如仍呈绿色,需再重复滴加溴水的步骤),加去离子水定容至1000mL乱,过滤,滤液置于棕色试剂瓶中,贮于冰箱中可长期保存备用。此溶液使用时可按1:3比例用去离子水稀释。
4.4.2 0.4mol/L三氯乙酸(TCA)溶液
精确称取TCA65.4g,加去离子水定容至1000mL。
4.4.3 0.4mo1/L碳酸钠溶液
精确称取无水碳酸钠42.4g,加去离于水溶解后,定容至1000mL。
4.4.4 氢氧化钠溶液c(NaOH)=0. 5mol/L
4.4.5 盐酸溶液c(HCI)=lmol/L及0. lmol/L
4.4.6磷酸缓冲液(pH=7.5 ),适用于中性蛋白酶
称取磷酸氢二钠(Na,HP0,·12H,0)6. 02 g和磷酸二氢钠(NaH,PO,·2H,0)0. 5g ,加水溶解并定容至I000mL
4.4.7 l0g/L酪素溶液
称取酪素 1.000g,精确至0.00 lg,用少量0.5m ol/L氢氧化钠溶液湿润后,加人适量的各种适宜pH的缓冲溶液约80mL,在沸水浴中边加热边搅拌,直至完全溶解,冷却后,转人100mL容量瓶中,用适宜的pH缓冲溶液稀释至刻度。此溶液在冰箱内贮存,有效期为三天。
4.4.8 100μg/mL酪氨酸溶液:
精确称取0.100g酪氨酸,逐步加入lmol/L盐酸6ml溶解后,用0.1mol盐酸定容至100mL得1mg/ml酪氨酸溶液,取此溶液10ml,用0.1mol盐酸定容到100ml,放入4度冰箱中保存。
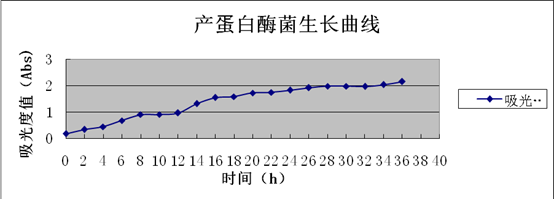
4.5产蛋白酶菌生长曲线的测定
4.5.1获取不同培养时间发酵液
4.5.1.1 20##年12月11号,星期三 ,整点8:00时,准时接入已经活化好的对数期菌种,用1000ul 的移液枪吸取5ml的对数期菌液加入到发酵瓶A中(液体为酪素培养基),剩下的对数期菌种菌液置于4℃冰箱种中保藏于。并同时将A号发酵瓶放到摇床中,继续30℃震荡发酵。在直到20:00时将放在冰箱中保藏的菌种液(活化的对数期菌种)取出5ml接种到B号发酵瓶中。并放在30℃的摇床中继续发酵。
4.5.1.2 20##年12月12号,星期四 ,在8:00时,将放在冰箱中保藏的菌种液(活化的对数期菌种)取出5ml接种到C号发酵瓶中。立即从A、B、C号瓶移取发酵液5ml到对应的离心管中。A瓶取样分别对应的编号是12、13、14、15、16、17、18对应培养时间为24h、26h、28h、30h、32h、34h、36h。B瓶取样分别对应的编号是6、7、8、9、10、11对应培养时间为12h、14h、16h、18h、20h、20h完成全部取样。C瓶取样分别对应的编号是0、1、2、3、4、5对应培养时间为0h、2h、4h、6h、8h、10h。并且全部放到4度冰箱封存。
4.5.2 吸光度值的测定
将编号0、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18的离心管从冰箱里取出,用离心机在设定的转速为3500rpm,离心10min,将要测酶活力的的编号的上清液倒入另一干净的试管中。沉淀留下。
(2) 离心管中加入蒸馏水5ml轻微震荡制成悬浮液。
(3) 将悬浮液加到比色皿中,测其吸光度值。 测定的OD600值填入下表。
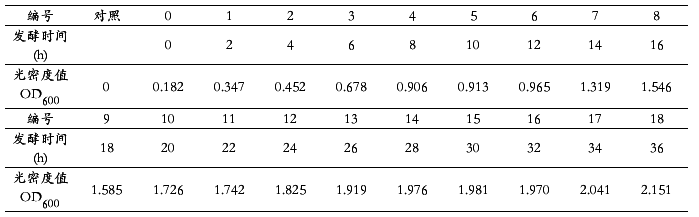
4.6酶活力的测定
(1)待测液的制备:
选择培养时间为0、6、12、18、24、30、36h的离心管, 离心之后的上清液,即为待测酶液。
(2)将酪素、三氯乙酸溶液放入40±0.2°C 恒温水浴锅中,预热 5min。
(3)按下表操作:
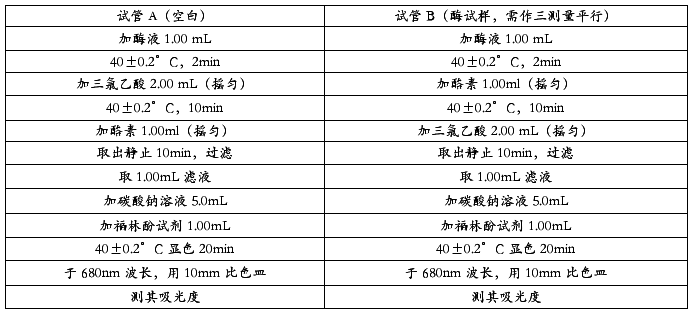
将测定的OD680值填入下表

5.1 酶活力的计算
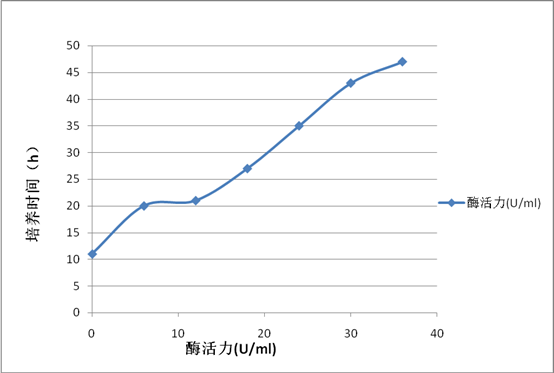
根据酶活计算公式将数据填入下表

第五章 结果与讨论
通过酶活力的曲线可以看出在36h左右酶活力达到最大,此时发酵液中的产蛋白酶最多。所以在选择发酵时间时,应选择36h为最大产酶时间点。
掌握了蛋白酶产生菌的生长曲线绘制方法,同时通过研究蛋白酶的性质及学习其测定方法,用微生物学方法测定蛋白酶的酶活力。
第六章 参考文献
[l] Mala B Rao,APama M.talkasle, Mohini S.Ghatge,et aL. Molecular and iotechologleal aspects of microbial protease[M].Miaebiology and Molecular Biology eview,sept.1998:597~635.
[2]罗贵民.酶工程[M].北京:化学工业出版社,2002.
[3]黄文涛,胡学智.译《酶应用手册》[M],上海科学出版社,1989.
[4]夏凡,琚争艳.微生物碱蛋白酶在食品工业中的应用及其安全性研究进展[J].山东食品
发酵,2008,(2):19-22.
[5]中华人民共和国专业标准:蛋白酶活力测定法,SB/T:10317-1999.
第二篇:实验四 蛋白酶活力的测定