实验十三 乙酸乙酯的制备
一. 实验目的:
1. 掌握实验室制备乙酸乙酯的原理与方法,初步掌握低沸点易燃液体的操作要点。
2. 掌握回流蒸馏分液漏斗的使用等操作。
二. 实验重点和难点:
1. 有机酸合成酯的一般原理及方法。
2. 提高有机反应装置及仪器的基本操作。
实验类型:基础性 实验学时:4学时
三. 实验仪器与药品:
主要实验仪器:蒸馏装置 回流冷凝管 分液漏斗 温度计 量筒
三颈烧瓶(100mL) 蒸馏头 pH试纸 锥形瓶
主要化学试剂:冰醋酸 95%乙醇 浓硫酸 饱和碳酸钠溶液
饱和氯化钙及饱和氯化钠水溶液 无水硫酸镁
四. 实验装置图:
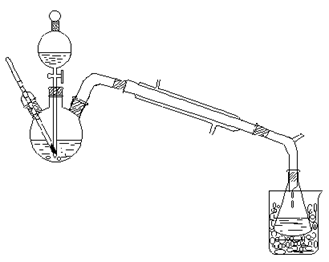
五. 实验原理:
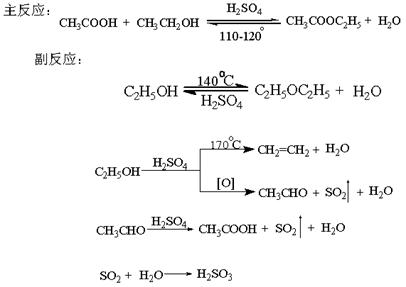
常用的催化剂:浓硫酸、氯化氢、对甲苯磺酸
酸的作用是使羰基质子化从而提高羰基的反应活性。
整个反应是可逆的。为了使反应向有利于生成酯的方向移动,通常采用过量的羧酸或醇,或者除去反应中生成的酯或水,或者二者同时采用。
但究竟使用过量的酸还是过量的醇,取决于原料是否易得,价格及过量的原料与产物容易分离与否等因素。
理论上催化剂不影响平衡混合物的组成,但实验表明,加入过量的酸,可以增大反应的平衡常数。因为过量的酸存在,改变了体系的环境,并通过水合作用除去反应中生成的部分水。
在实践中,提高反应收率常用的方法是除去反应中形成的水,特别是大规模的工业制备中。在某些酯化反应中,醇、酯和水之间可以形成二元或三元最低恒沸物,也可以在反应体系中加入能与水、醇形成恒沸物的第三组分,如苯、四氯化碳等。以除去反应中不断生成的水,达到提高酯产量的目的,这种酯化方法,一般称为共沸酯化。究竟采取什么方法,要根据反应物和产物的性质来确定。
为了提高酯的产量,本实验采取加入过量的乙醇及不断地把反应中生成的酯和水蒸出的方法。在工业生产中,一般采用加入过量的乙酸,以便使乙醇转化完全,避免由于乙醇和水及乙酸乙酯形成二元或三元恒沸物给分离带来困难。
以上酸催化的直接酯化是工业和实验室制备羧酸酯最重要的方法。除此之外,还有:
①、 采用酰氯、酸酐和腈的醇解。
②、 利用羧酸盐与卤代烷或硫酸酯的反应。
羧酸酯是在工业和商业上用途广泛的化合物,酯在工业和商业上大量用作溶剂。低级酯一般是具有芳香气味或特定水果香味的液体,自然界许多水果和花草的芳香气味,就是由于酯存在的缘故。酯在自然界以混合物的形式存在,人工合成的一些香料就是模拟天然水果和植物提取液的香味经配制而成的。
六. 实验內容及步骤:
①、 安装实验仪器:按照上图组装仪器。接受器浸入冰水中冷却,接尾管的支管接橡皮管通入下水道。
②、 加试剂:在 三颈瓶中加入4mL乙醇,慢慢振荡+5mL浓H2SO4+沸石。漏斗内盛预先在烧杯内混匀的10mL乙醇 + 8mL 乙酸
③、 加热反应:先从漏斗中放出3mL混合液,于石棉网上加热至110-1200C。有馏分分出时,打开滴液漏斗,控制流速与馏分滴速相当(1d/s),
④、 滴加完毕后,至1300C无馏分为止。
⑤、 除杂质:摇动盛粗产品的锥形瓶,向其中加入饱和碳酸钠水溶液至pH为中性(黄绿色),或者直至不再有CO2气体逸出,有机相对pH试纸呈中性为止。
⑥、 提纯:将液体转入分液漏斗中,搖振后静置,分去水相,有机相用10mL饱和食盐水洗涤后,以出去CO32-,静置弃水相。再每次用10mL饱和氯化钙溶液洗涤两次。弃去下层液(水相)。
⑦、 干燥:酯层转入干燥的锥形瓶+无水硫酸镁干燥。计量体积(一般10mL左右)并计算回收率。
⑧、 (本部分可以不做)水浴蒸馏得纯产物:将干燥的粗乙酸乙酯在水浴上进行蒸馏,收集73--78℃馏分,
⑨、 计算产率:
七. 实验注意事项:
1. 注意操作安全性。
(1) 实验仪器安装要认真、仔细和小心。
(2) 使用试剂时注意防火,防硫酸,防烧伤。
(3) 在除杂使用分液漏斗时,注意及时排空气(充分搖振) 。
2. 反应时严格控制好温度及滴加速度。
温度不宜过高,控制温度在110--120℃之间,最高不超过130℃,否则会增加副产物乙醚的含量,滴加速度太快会使醋酸和乙醇来不及反应而被蒸出。
3. 除杂质及干燥操作要尽可能的完全。
也就是说不能马虎,象碳酸钠必须洗干净,否则下一步用饱和氯化钙溶液洗去醇时,会产生絮状的碳酸钙沉淀,造成分离困难。若洗涤不净或干燥不够时,会使沸点降低,影响产率。
4. 实验过程中要认真观察,及时记录反应情况,不得随意脱岗,造成事故。
5. 分批加浓硫酸,边加边摇边冷却,防止乙醇氧化。
6. 装置要严密,反应完后要先停火,稍冷却后再拆下接受器,防止产物挥发。
7. 控制好反应温度及滴加乙醇的速度1d/s。
8. 洗涤时注意顺序,室内无明火。
9. 分净水后用无水硫酸镁干燥约20~30分钟。
10. 产品验收体积和沸点。
11. 【实验要求】测定产品的折光率,计算产率。
八. 实验相关内容:
1. 在馏出液中除了酯和水外,还会有少量未反应的乙醇和乙酸,也含有副产物乙醚。故必须用碱除去其中的酸,并用饱和氯化钙除去未反应的醇,否则会影响到酯的得率。
2. 当有机层用碳酸钠洗过后,若紧接着就用氯化钙溶液洗涤,有可能产生絮状碳酸钙沉淀,使进一步分离变得困难,故在两步操作之间必须用水洗一下。由于乙酸乙酯在水中有一定的溶解度,为了尽可能减少由此而造成的损失,所以实际上用饱和食盐水来进行水洗。
3. 乙酸乙酯与水或乙醇可分别生成共沸混合物,若三者共存则生成三元共沸混合物。因此,有机层中的乙醇不除净或干燥不够时,由于形成低沸点共沸混合物,从而会影响到酯的产率。

九. 思考题:
1. 酯化反应有什么特点?
2. 本实验如何创造条件促使酯化反应尽量向生成物方向进行?
3. 本实验可能有哪些副反应?
4. 如果采用醋酸过量是否可以? 为什么?
5. 该酯化反应是烷氧键方式断裂还是酰氧键方式断裂?
第二篇:13.实验五乙酸乙酯的制备
实验五 乙酸乙酯的制备
一、实验目的
1、掌握酯的制备的原理和方法。
2、熟悉蒸馏、萃取、液体有机物干燥等基本操作。
3. 学习滴液漏斗的使用
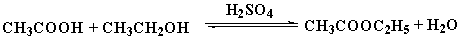 二、实验原理
二、实验原理
主反应:
可逆反应,采取如下措施使反应向右进行:
A.增加反应物的浓度(过量乙酸或乙醇);
B.减少生成物的浓度(蒸去乙酸乙酯)。
副反应:
三、主要仪器与试剂
请学生自已整理罗列
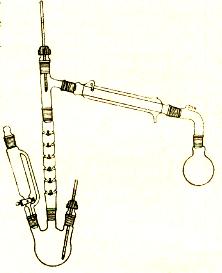
四、实验装置图
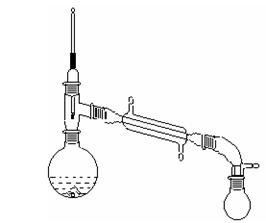
五、实验步骤
① 在100ml三口烧瓶的一侧口装配一恒压滴液漏斗,另一侧固定一温度计,中口装配蒸馏头,温度计及直型冷凝管,冷凝管末端连接接引管及锥形瓶,锥形瓶用冰水浴冷却。
② 在一小锥形瓶内放入3ml乙醇,一边摇动,一边慢慢地加入3ml浓硫酸,将此溶液倒入三口烧瓶中。
③ 配制20ml乙醇和14.3ml冰醋酸的混合液,倒入滴液漏斗中,加热烧瓶,使反应混合物的温度为120℃左右,
④ 然后把滴液漏斗中的乙醇和冰醋酸的混合液慢慢地滴入三口烧瓶中,调节加料的速度,使和酯蒸出的速度大致相等,加料的时间约需30~60分钟,保持反应混合物的温度为120~125℃,滴加完毕后,继续加热约10min,直到不再有液体馏出为止。
⑤ 反应完毕后,将饱和碳酸钠溶液很缓慢地加入馏出液中,直到无二氧化碳逸出为止,饱和的碳酸钠要小量分批地加入,并要不断地摇动接受器(为什么?)。
⑥ 把混合液倒入分液漏斗中,静置,放出下层废液,用石蕊检验酯层,如果显酸性,再用饱和碳酸钠溶液洗涤,直到酯层不显酸性为止,放出下层废液。
⑦ 加入等体积的饱和食盐水洗涤,放出下层废液,再加入饱和氯化钙溶液洗涤,放出下层废液,从分液漏斗上口将乙酸乙醋倒入干燥的小锥形瓶中内,
⑧ 加入无水碳酸钾干燥,放置约20min,在此期间要间歇振荡锥形瓶,
⑨ 通过长茎漏斗(漏斗上放折叠式滤纸)把干燥的粗乙酸乙醋滤入50ml蒸馏烧瓶中,装配蒸馏装置,在水浴上加热蒸馏,收集74~80℃的馏分。
六、实验记录(须严格按标准格式记录)
七、实验结果
产品状态,量,计算产率
八、思考题:
1.粗产品中主要有哪些杂质?是怎样的洗涤操作?
2.本实验采用怎样的操作来提高产率?
注意:本次实验过程中带课老师请不断补充三个大烧杯里的公用溶液。
