实验二 液体饱和蒸汽压的测定
摘要: 本实验采取动态法,通过测定在不同外部压力下水的沸点来确定不同温度条件下水的饱和蒸汽压同温度的关系。根据实验结果对克拉贝龙—克劳修斯方程进行了验证,并由此方程计算出纯水的平均摩尔汽化热。
关键词:沸点 饱和蒸汽压 摩尔汽化热 克拉贝龙—克劳修斯方程
Experiment No.2: The Determination of Saturated Vapor Pressure of the Liquid
Abstract: In this experiment, we determined the boiling point of pure water under different exterior pressures in order to make sure the relationship of saturated vapor pressures and temperature, by using ‘Dynamic Method’. According to the result, we validate Clapeyron-Clausuis Equation, and then calculated the molar heat of vaporization of pure water.
Key words: Saturated vapor pressure Molar heat of vaporization Clausius-Clapeyron Equation Boiling point
1. 前言
在封闭体系中,当液相的蒸发速度与相应气相的凝聚速度相等时,体系达到动态平衡,此时的蒸气压为该温度下的饱和蒸气压,液体的饱和蒸气压等于外压时的温度为液体的沸点,因此沸点是随外压变化的,当外压为101325Pa时,称之为正常沸点。每蒸发1mol液体所需的热量称该温度下的摩尔汽化热。
克拉贝龙-克劳修斯方程描述了饱和蒸气压,温度与摩尔汽化热之间的关系:
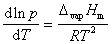
它是克拉贝龙方程式的简化形式,可以根据该式测定液体的饱和蒸气压。饱和蒸汽压是液体工质最基本的物性参数之一, 是化工、生产、科研、设计过程中的重要基础数据,所以掌握通常测量饱和蒸气压的方法具有很大的实际意义。
液体饱和蒸汽压的测量方法主要有三种:静态法,动态法和饱和气流法。动态法是指在不同外界压力下, 测定液体的沸点, 又称沸点法。动态法与其它两种方法相比具有操作简单,结果比较准确的优点,适用于蒸气压不太高的液体。本实验采用动态法来测量水的饱和蒸气压,并由此得到水的正常沸点和摩尔汽化热。
2. 实验部分
2.1 仪器与试剂
BY型U形压力计 江苏省常州市东风仪表厂
2XZ-2B型旋片真空泵 上海真空泵厂
G型单相串激电动机 本溪微电机厂
6511型电动搅拌机调速器 上海标本模型厂
调压变压器 苏州电器厂
Fortin式大气压计;1/10刻度水银温度计
HEGON电炉;热得快
缓冲瓶;真空储气瓶。
2.2 实验步骤
1) 记录实验开始和结束时的大气压强和气温;
2) 将缓冲瓶与大气连通,加热大烧杯中的水。沸腾后继续煮沸5~10分钟以驱赶空气,再停止加热,让水浴温度在搅拌中缓慢下降。当B、C液面等高时,读取温度数据和气压差数据;
3) 关闭缓冲瓶与大气之间的通道,利用安全瓶中的真空降低体系的外压。每次降压约40mmHg,液体会再次沸腾,当B、C液面等高时,读取一组温度数据和气压差数据。反复降压直到汞高刻度相差约400mmHg为止。
4) 上述两步平行重复三次。
2.3 注意事项
1)每测完一组温度和压差的数据以后,要赶快对给体系加热,使环境的空气不会进入到体系中去;。
2)煮沸时间要足够长使得平衡管A管和B管之间的空气赶净;
3 ) 读取温度和压力计的凑数时要快和要准;
4 ) 平衡管要完全浸入水槽的液面以下。
3.结果与讨论
3.1 实验结果
三组平行实验计算的纯水的平均摩尔汽化热和正常沸点如下:
Δ vapHm1=42.14±0.55kJ/mol Tb1=372.61K
Δ vapHm2=42.68±0.11kJ/mol Tb2=372.47K
Δ vapHm3=43.74±0.64kJ/mol Tb3=372.27K
平均值:
Δ vapHm =42.85±0.43kJ/mol Tb = 372.45 K
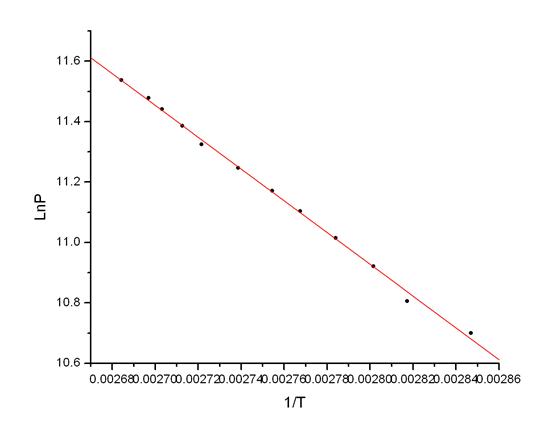
各组数据的P ~ T图和Ln(P) ~ 1/T图详见附件中的Fig A1 ~ Fig A6.
3.2 结果讨论
1)与文献值的比对
在373.15k时Δ vapHm =40.70kJ/mol
η1=(42.14-40.70)/40.7=3.54%
η1=(42.68-40.70)/40.7=4.86%
η1=(43.74-40.70)/40.7=7.47%
η=(42.85-40.70)/40.7=5.28%
纯水正常沸点Tb=373.15K
η1=(372.61-373.15)/ 373.15=-0.14%
η2=(372.47-373.15)/ 373.15=-0.18%
η3=(372.27-373.15)/ 373.15=-0.24%
η=(372.45-373.15)/ 373.15=-0.19%
2)结果的误差分析
由上面的比对,实验测得的摩尔汽化热误差在百分之五左右,存在着一定的系统误差,下面具体对误差产生的原因和影响进行讨论。
①克拉贝龙-克劳休斯方程实际是克拉贝龙方程的简化,其假设条件是所研究体系为纯物质的气-液两相平衡体系,忽略液体体积并假设水蒸气为理想气体;而在本实验中,为了简化成线性方程来处理又将Δ vapHm视作常数。这些理论上的假设与实际实验条件并不完全相符, 下面我们来具体讨论这些假设的不符之处。
a.被研究体系中理论上只有液态水和水蒸气,但实际上会有一些空气残留,空气不易完全赶尽,待测体系中混有空气时对饱和蒸汽压的测定会产生影响:
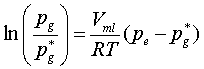
在上述公式中,Pg≠为没有惰性气体存在时液体的饱和蒸气压,Pg为有惰性气体存在且总压为Pe时液体的饱和蒸气压。在总压一定的情况下,混入的空气压强越大,液体饱和蒸汽压就越小,沸点相应偏小。
b. 沸点附近的液体蒸气与理想气体间存在着一定的差异,此时的压强并非很低,蒸气分子之间的作用力还比较强。
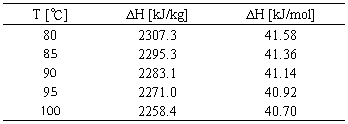
c. 将Δ vapHm视作常数简化为线性方程后求出的ΔvapHm ,实际上是一个温度介于80℃和100℃之间某温度的Δ vapHm值,由Table1可以看出它比100℃下的Δ vapHm大,于是造成了实验结果偏大。
Table1.不同温度下水的摩尔汽化热
②U型压强计的两段水封并非完全平齐, 因此在数据处理时对每列压强差数据都要减去这个初始的偏差值,由于本次实验中两段水封几乎以平齐,故没有进行这样的处理。
③读压强计和温度计的示数需要在平衡管中液面齐平的一瞬间完成,且两者都不太易读准确,所以容易造成读数误差。
3.3 思考和补充
1)关于实验的改进
平衡管的上端接着冷凝管,水蒸气在这里会被冷凝成液态流回到平衡管中,随着实验的进行,平衡管B、C球之间的液柱中积水会渐渐增多,影响B、C液面相平的判断。我建议在平衡管与冷凝管之间插入一段三通管,使冷凝水能暂存在三通管中而不会流回到平衡管。另外为了防止倒吸和爆沸,还可以对平衡管进行改进。
2)关于沸点的讨论
从P~T图我们可以看到沸点与压强的正相关关系,实际上水的沸点T(摄氏度)和压强P(mmHg)之间有这样一个关系式:T=100.00+0.0367(P-760)-0.000023(P-760)^2。此外,液体的沸点也随海拔高度而改变,高度越高,液体沸点越低,并有下面的近似计算式:
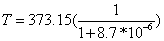 (K).
(K).
3)心得体会
本次试验操作简单,主要是通过实验让我们进一步理解饱和蒸汽压的相关概念。另外通过实验我掌握了如何用动态法测定液体摩尔汽化热,它中间的思想是值得仔细体会的,从公式中看似乎要在不同温度下测饱和蒸气压,但实际上反过来做更方便,即在不同外部压力下测定液体的沸点,通过达到沸点时液体的饱和蒸气压与外压相等得到了该沸点温度下的饱和蒸气压。这正是“反弹琵琶”的妙用。
3.4 实验结论
本次试验测得纯水的平均摩尔汽化热为42.85,正常沸点为Tb = 372.45 K;在80~100℃的范围内饱和蒸汽压和沸点基本满足克拉贝龙—克劳修斯方程。
参考文献:
[1] 崔献英,柯燕雄,单绍纯.物理化学实验[M].中国科技大学出版社,2000: 29~32.
[2] 付献彩,沈文霞,姚天扬,侯文华.《物理化学》(第五版)上册[M].高等教育出版社,2005:277~280.
[3] 吴泳华,霍剑青,熊永红.大学物理实验 (第一册) [M], 高等教育出版社, 2001
[4] 刘士星.化工原理[M],中国科学技术大学出版社, 1994.
[5] 周蔚,段平和,李森男.纯液体饱和蒸气压测定实验改进[J],洛阳师范学院学报,2005,(5):118~120.
附件:实验数据处理
1. 数据记录
1.1 环境状况
大气压:768.45mmHg(始),769.25mmHg(末);
室温:14.30℃(始),13.72℃(末)。
1.2 仪器参数
1/10℃分度水银温度计测量误差:0.05℃(不使用放大镜);
1mm刻度直尺测量误差:0.5mm(不使用放大镜)。
1.3 实验数据
Table A1

Table A2

Table A3

注:在进行第一组测量时,测到第12组才使Δh到达400mm左右,所以为了保证三组数据的一致性,每组都测了12组。
2. 数据处理
2.1 数据计算
大气压P0 = (768.45+769.25)÷2 mmHg = 768.85 mmHg
将Table A1~A3的数据进行如下计算:
T[K] =T[℃]+273.15;
Δh =h1-h2 [cm];
ΔP=101325×Δh÷76 [Pa];
P = P0- ΔP = P0-101325×Δh÷76 [Pa];
并算出每组数据所对应Ln(P)和1/T的值,结果如Tablet A4~A6所示:
Table A4

Table A5

Table A6
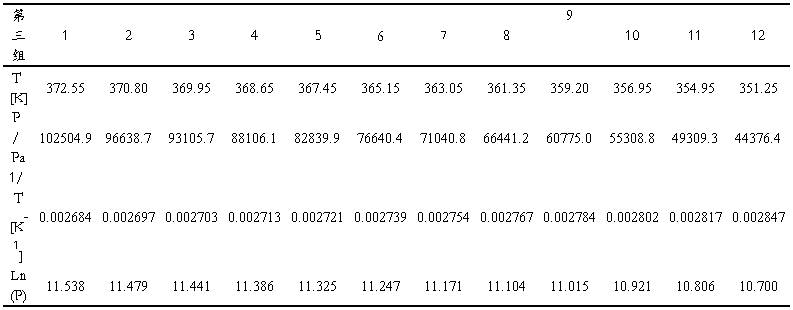
2.2 P ~ T和Ln(P) ~ 1/T曲线绘制与拟合
根据Tablet A4~A6的数据,分别绘制三组实验的P ~ T图及Ln(P) ~ 1/T一元线性回归拟合图。
FigA1.第一组数据P ~ T图
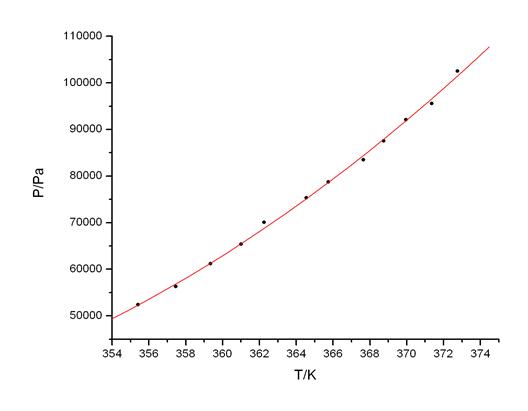
Fig A2.第一组数据Ln(P) ~ 1/T线性拟合图


FigA3.第二组数据P ~ T图
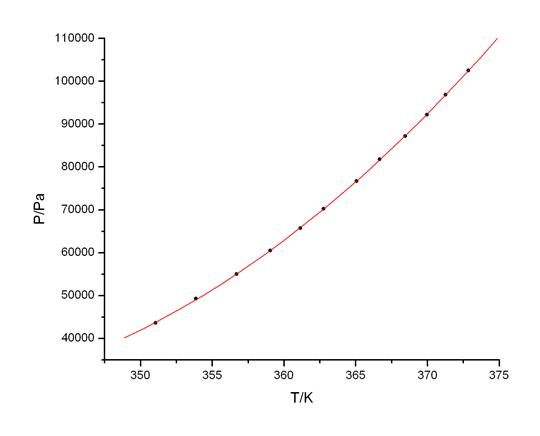 Fig A4.第二组数据Ln(P) ~ 1/T线性拟合图
Fig A4.第二组数据Ln(P) ~ 1/T线性拟合图

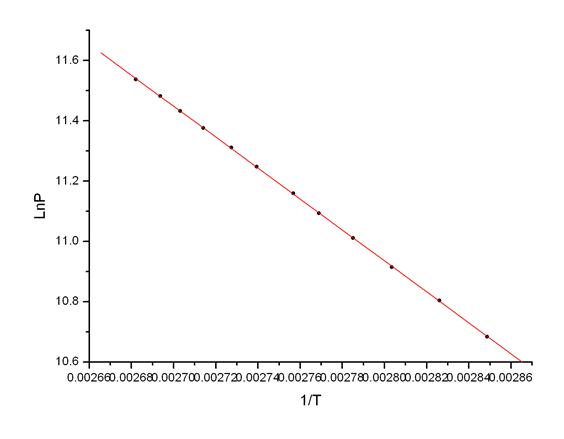
FigA5.第三组数据P ~ T图
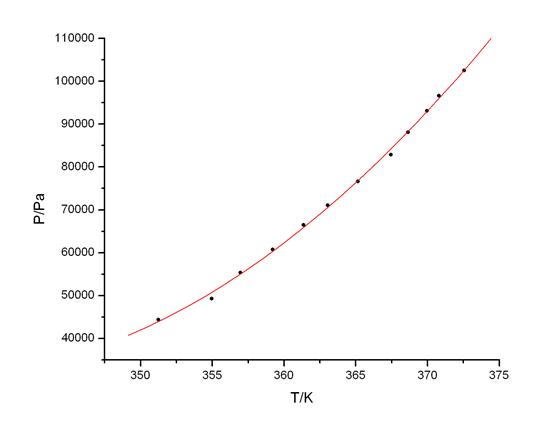
Fig A6.第三组数据Ln(P) ~ 1/T线性拟合图

2.3 计算摩尔汽化热和沸点
根据线性拟合的参数,由Δ vapHm = -kR,R=8.314472 [J·mol-1·K-1],得:
Δ vapHm1= -kR=5067.9×8.314472 J/mol= 42.14kJ/mol
Δ vapHm2= -kR=5133.7×8.314472 J/mol= 42.68kJ/mol
Δ vapHm3= -kR=5261.3×8.314472 J/mol= 43.74kJ/mol
平均值:Δ vapHm =42.85kJ/mol
将P = 101325Pa代入拟合直线方程 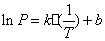 中,得水的正常沸点
中,得水的正常沸点
Tb1=372.61K
Tb2=372.47K
Tb3=372.27K
平均值:Tb = 372.45 K
2.4 ΔvapHm的误差传递公式的推导及计算
因为ΔvapHm = -kR
所以由误差传递公式: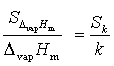
即: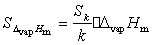
又斜率k的标准差为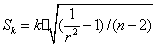
故: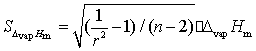
第一组:Δ vapHm =42.14 kJ/mol,r=0.99914,n=12
SΔ vapHm=42.14×0.0132=0.55
第二组:Δ vapHm =42.68 kJ/mol,r=0.99997,n=12
SΔ vapHm=42.68×0.0025=0.11
第一组:Δ vapHm =42.14 kJ/mol,r=0.99893,n=12
SΔ vapHm=43.74×0.0146=0.64
