化学震荡
一、目的要求
1、了解 、熟悉化学振荡反应的机理。
2、通过测定电位——时间曲线求得振荡反应的表观活化能。
二、基本原理
有些自催化反应有可能使反应体系中某些物质的浓度随时间(或空间)发生周期性的变化,这类反应称为化学振荡反应。
最著名的化学振荡反应是1959年首先由别诺索夫(Belousov)观察发现,随后柴波廷斯基(Zhabotinsky)继续了该反应的研究。他们报道了以金属铈离子作催化剂时,柠檬酸被HBrO3氧化可发生化学振荡现象,后来又发现了一批溴酸盐的类似反应,人们把这类反应称为BZ振荡反应。例如丙二酸在溶有硫酸铈的酸性溶液中被溴酸钾氧化的反应就是一个典型的BZ振荡反应。典型的BZ系统中,铈离子和溴离子浓度的振荡曲线如图1所示。
对于以BZ反应为代表的化学振荡现象,目前被普遍认同的是Field,Körös和Noyes在1972年提出的FKN机理。FKN机理提出反应由三个主过程组成:
过程A (1) Br-+BrO3-+2H+→HBrO2+HBrO
(2) Br-+HBrO2+H+→2HBrO
过程B (3) HBrO2+BrO3-+H+→2BrO2+H2O
(4) BrO2+Ce3++H+→HBrO2+Ce4+
(5) 2HBrO2→BrO3-+H++HBrO
过程C (6) 4Ce4++BrCH(COOH)2+H2O+HBrO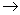 2Br-+4Ce3++3CO2+6H+
2Br-+4Ce3++3CO2+6H+
过程A是消耗Br-,产生能进一步反应的HBrO2,HBrO为中间产物。
过程B是一个自催化过程,在Br-消耗到一定程度后,HBrO2才按式(3)、(4)进行反应,并使反应不断加速,与此同时,Ce3+被氧化为Ce4+。HBrO2的累积还受到式(5)的制约。
过程C为丙二酸溴化为BrCH(COOH)2与Ce4+反应生成Br-使Ce4+还原为Ce3+。
过程C对化学振荡非常重要,如果只有A 和B,就是一般的自催化反应,进行一次就完成了,正是C的存在,以丙二酸的消耗为代价,重新得到Br-和Ce3+,反应得以再启动,形成周期性的振荡。
该体系的总反应为:
2H++2 BrO3-+3CH2(COOH)2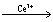 2BrCH(COOH)2+3CO2+4H2O
2BrCH(COOH)2+3CO2+4H2O
振荡的控制离子是Br-。
由上述可见,产生化学振荡需满足三个条件:
1.反应必须远离平衡态。化学振荡只有在远离平衡态,具有很大的不可逆程度时才能发生。在封闭体系中振荡是衰减的,在敞开体系中,可以长期持续振荡。
2.反应历程中应包含有自催化的步骤。产物之所以能加速反应,因为是自催化反应,如过程A中的产物HBrO2同时又是反应物。
3.体系必须有两个稳态存在,即具有双稳定性。
化学振荡体系的振荡现象可以通过多种方法观察到,如观察溶液颜色的变化,测定吸光度随时间的变化,测定电势随时间的变化等。
按在FKN机理基础上建立的俄勒冈模型,推导可得振荡周期t与过程C即反应步骤(6)的速率系数及有机物浓度呈反比关系,比例常数还与其它步骤的速率系数有关。如测定不同温度下的振荡周期,并近似地忽略比例常数随温度的变化,则可应用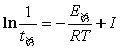 及
及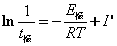 可估算过程C即反应步骤(6)的表观活化能E诱,E振。另一方面,随着反应的进行,有机物浓度逐渐减少,振荡周期将逐渐增大,并最终停止振荡,反应终止。
可估算过程C即反应步骤(6)的表观活化能E诱,E振。另一方面,随着反应的进行,有机物浓度逐渐减少,振荡周期将逐渐增大,并最终停止振荡,反应终止。
本实验采用电动势法测量反应过程中离子浓度的变化。以甘汞电极作为参比电极,用铂电极测定不同价位铈离子浓度的变化,用离子选择性溴电极测定溴离子浓度的变化。本实验通过测定离子选择性电极上的电势(U)随时间(t)变化的U-t曲线来观察BZ反应的振荡现象(见图1),同时测定不同温度对振荡反应的影响。根据U-t曲线,得到诱导期(t诱)和振荡周期(t1振,t2振,…)。

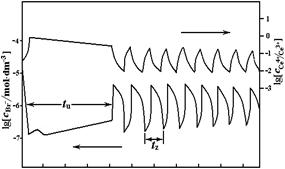
图1.振荡反应装置 图2. 振荡曲线
三、 仪器与试剂
仪器: 2D-BZ振荡实验装置,100ml电解池,光亮铂丝电极,217型双盐桥甘汞电极(用 H2SO4作液接盐桥),SYC-15B超级恒温槽,移液管,洗耳球。
试剂:0.05mol·L-1硫酸铈铵溶液(在0.2mol·L-1硫酸介质中配制)。
0.2mol·L-1溴酸钾溶液,0.4mol·L-1丙二酸溶液,3mol·L-1硫酸溶液
四、实验步骤
按图17-1连接好仪器装置,开启电脑,打开超级恒温槽,将温度恒定在25.0±0.1℃。在100mL的反应器中加入浓度为0.4mol·L-1的丙二酸、浓度为 0.2mol·L-1的KBrO3、浓度为 3mol·L-1的硫酸各10 mL混合,开启电磁搅拌使溶液在设定温度下恒温至少10min(调节调速旋钮约3圈半)。打开BZ振荡2.0软件,设置纵坐标0-1.5V,横坐标0-30min。待电压稳定后,开始绘图,绘图约5min后加入10mL浓度为 硫酸铈铵溶液,观察溶液颜色变化,
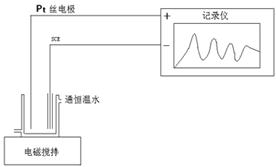
图18-1 B-Z反应实验装置示意图
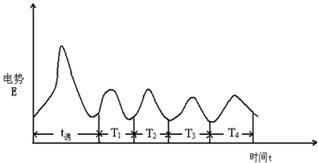
图18-2 B-Z反应的电势振荡曲线
经过一段时间后,此后的曲线呈现有规律性周期变化。图像出现10个周期以后,停止绘图。
获取振荡曲线数据和图像。
取出电极洗净电解池和所用电极,在20-50℃之间选择5-8个合适的温度(如20.0℃,25.0℃,30.0℃,···),在每个温度下重复上述步骤,绘制在不同温度下的曲线。
五、数据记录和处理
室温: 始:31.3℃ 末:31.7℃
大气压: 始:100.68kPa 末:101.60kPa
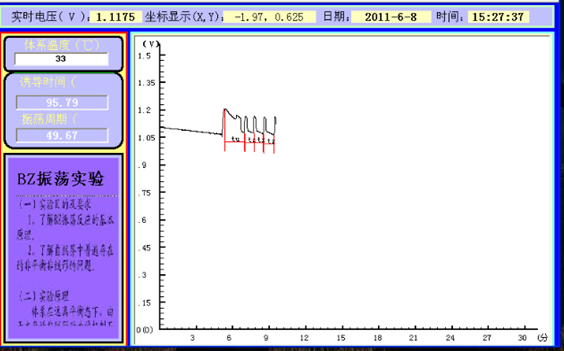
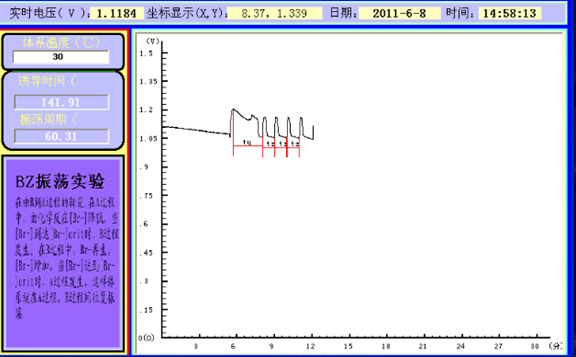

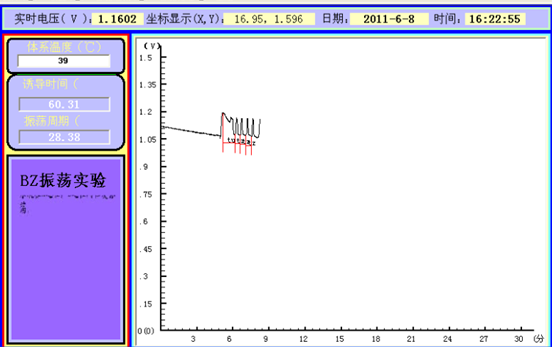
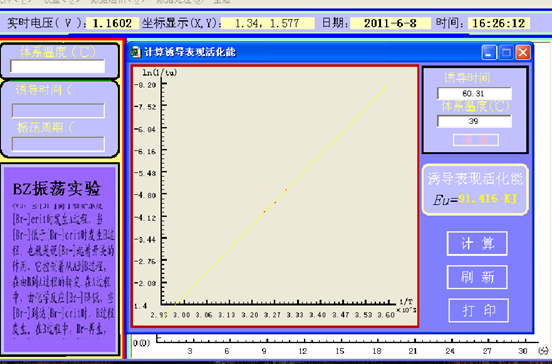

数据分析:根据上述图可得,诱导时间(tu)=60.31s,震荡周期(tz)=28.38s。
由图中直线的斜率可以求得诱导表观活化能(Eu)=91.416kJ,震荡表观活化能(Ez)=45.946kJ.
六、注意事项
(1)各个组分的混合顺序对体系的振荡行为有影响。应在丙二酸、溴酸钾、硫酸混合均匀 后,且当记录仪的基线走稳后,再加入硝酸铈铵溶液。
(2)反应温度可明显地改变诱导期和振荡周期,故应严格控制温度恒定。
(3)实验中溴酸钾试剂纯度要求高。
(4)配制硝酸铈铵溶液时候,一定要在硫酸介质中配制,防止发生水解呈浑浊。
(5)所使用的反应容器一定要冲洗干净,转子位置及速度都必须加以控制。
七、思考题
1、影响诱导期、周期、及振荡寿命的主要因素有哪些?
答:主要因素有:反应体系的温度、反应物的浓度、离子的活性、催化剂的性质。
2、为什么在实验过程中应尽量使搅拌子的位置和转速保持一致?
答:因为化学振荡反应发生的3个条件之一为:体系必须具有双稳态性,即可在两态间来回振荡。所以应尽量使搅拌子的位置和转速保持一致是体系在一个相对稳定的状态下反应。
第二篇:化学振荡1
第六章钙动力与生物化学振荡
April12,2012
作业1,2课件第56页,无量纲化方程组(6.2),得到(6.5)(6.6)式:du
dτdv
dτ=a?u+u2v=f(u,v),=b?u2v=g(u,v).
√√√√33c.2其中u=3?1cX,v=3?1Y,τ=k?1t,a=k1k3/k?1cA,b=k2/k?1B
求出其唯一定态解为
uss=a+b,
线性化之后得到矩阵A,??b?a????A=?????2bvss=b/(a+b)2.???(a+??????2?(a+b)?b)2
???(a+??????2?(a+b)?b)2答:无量纲化过程略,特征矩阵为:????f??g???????ssss??A=????g????f???ssss????b?a?????????=??????2b??
作业3推导课件60页方程(6.13)的稳定性由特征方程
λ2+Hλ?
的根来确定,其中H=γfu(u0,v0)fv?fv(u0,v0)+1。
dv答:定态(u0,v0)满足:dw=0,=0,即u0=?,f(?,v0)=0。特征矩阵为:
???????1γ????????A=????γ?1f?f+fwwv则特征方程为:
(λ+1)(λ?即为:λ2+Hλ?fv1?wγfw(u0,v0)?fv)?fw(u0,v0)=0γfu(u0,v0)=0,其中H=?fv(u0,v0)+1。
1
作业4考虑一个有反馈的Goodwin模型:
du1
dtdur
dt
反馈函数由下面两个函数给出:
a+um
(i)f(u)=,1+ua,m为正常数。
(1)确定反馈函数中正负反馈性质。
(2)推导一个系统稳定态的简化方程。
(3)说明对于任意负反馈系统,只有一个稳定态,对正反馈系统则可能有多个稳定状态。答:
(1)函数(i)当0<a<1时,f(u)是一个增函数,即u越大,ui增长率越大,是正反馈,当a>1时,f(u)是一个减函数,因此为负反馈。
函数(ii)总是一个减函数,因此总是负反馈。
dur1(2)系统定态为:du=0,=0,r=2,3,···,n,得到,=f(un)?k1u1,r=2,3,···,n=ur?1?krur,(ii)f(u)=1.1+uf(un)=k1u1,
ur?1=krur,
进一步得到un满足
f(un)=k1···knun.
其它ur可以由(2)式递推得到。r=2,3,···,n(1)(2)
(3)定态解满足的方程的形式为f(u)=Ku,等式左边为反馈函数,右边满足质量作用定
f(u)律,K>0。对于一个负反馈系统,应当有d
<0,显然右边为增函数,而f(u)为减函
f(u)数,则交点至多只有一个,也即稳定点至多只有一个。反之若是正反馈系统d
>0,则
有可能有多个交点,也即系统有多个稳定态。
作业5已知布鲁塞尔反应系统:
A→X,B+X→Y+D,Y+2X→3X,X→E,
2k1k2k3k4
其中k是速率常数,反应物A和B的浓度保持为常数。
(1)根据质量作用定律写出X和Y浓度的微分方程。
(2)进行无量纲化,使得方程变为:dudv=1?(b+1)u+au2v,=bu?au2v,dτdτ
3,b=kB/k.其中,u,v是X,Y对应的无量纲变量,τ=k4t,a=k3(k1A)2/k424
(3)确定正稳定态并证明在b=bc=1+a处系统由稳定态变为不稳定,且是一个Hopf分叉节√点。并说明在b=bc处,极限环的周期为2π/。
答:(1)根据质量作用定律有,
d[X]
dtd[Y]
dt
√=k1[A]?k2[B][X]+k3[Y][X]2?k4[X].=k2[B][X]?k3[Y][X]2.=√k4[Y],τ3,b=k[B]/k.=k4t,a=k3(k1[A])2/k424(3)(4)(2)取无量纲变量:u=k4[X],v
代入方程(3)(4)即可得到所求形式方程。
(3)系统定态为==0,即
au2v?(b+1)u+1=0,
bu?au2v=0.(5)(6)
其解为:uss=1,vss=。方程(5)(6)的特征矩阵为:
???b?1a???A=????b?a
特征方程为:
(γ?b+1)(γ+a)+ab=0,
即γ2+(a?b+1)γ+a=0.当b<a+1时,特征根实部小于零,因此是稳定解,√当b=a+1时,特征根是一对虚根,因此为Hopf分岔点,γ=±i,因此在b=bc处极限环的频率为Imγ,周期为2π/Imγ。(请参考:Page251,Nonlineardynamicsandchaos,StevenH.Strogatz。)???????,???
3
7.2Murray(2002)讨论了一个常见的简单的CICR模型:ER中释放的Ca2+是钙离子的单增反曲
函数,并且有一个线性的钙离子去除机制,即:k1c2dc=L+?k2c,dtK+c2
其中L是一个常数,表示钙离子从ER渗漏到细胞质的速率。
(a)无量纲化这个反应方程式,共有几个无量纲参数?
√(b)证明当L=0,k1>2k2时,共有两个正的定态,说明它们的稳定性。以下问题均假√设k1>2k2。
(c)当渗漏增加的时候,零点集dc/dt=0如何变化?证明存在一个值Lc,当L>Lc时,只有一个正解存在。
(d)固定L<Lc并假设初始状态在最低的稳定点,当c有一个小的扰动的时候c会怎样变化?大扰动时呢?如果把L提高到Lc以上再降回到零,c如何变化?在L,c相平面画出分岔图,标出稳定和不稳定分支。这个模型是否有滞后现象?
答:(a)取无量纲参量:α=k2k1,η=L,uk2=c,τ=k2t,代入方程有,
duu2=η+α?u.dτ1+u2
只有两个无量纲参数。
√(b)由L=0,k1>2k2有η=0,α>2,令du=0解得,uss=
设f(u)=,则在定态解处的导数为,√,这是两个正定态解。1?u22ussssf(uss)=α?1=.22(1+uss)21+uss′
则在uss=√处,导数大于零,因此这个不动点是不稳定不动点,另一个导数小于零,为稳定不动点。
(c)零点集曲线向上平移。当零点集的第一个极小值与坐标轴相切时,此时为临界位置,令f′(u)=0可得方程:
α2u=1.(1+u2)2
其最小正根u?即为零点集最小值,代回方程即可得,Lc=k2√k1u2Ku??.1+u?
4
(d)此时系统有三个不动点分别为(从小到大)稳定,不稳定,稳定不动点。小扰动时,c会逐渐回到小的稳定不动点处,如果是大扰动,则有可能跨过threshold(即为不稳定不动点)而趋向于大的稳定不动点。如果把L提高到Lc以上再降回到零点,c将沿着最大的稳定曲线运动。分岔图见图1,取参数α=3用AUTO作图。存在滞后现象,从零点开始沿着稳定曲线箭头所示方向运动,到达分叉点附近将向上不稳定点运动,当从上不稳定点回来时,则会在上稳定点直接沿着稳定线运动,不会沿着上去的轨迹返回,有类似磁滞回线的现象。Threshold
HB
Figure1:L,c相平面分岔图
7.3早期的钙离子振荡模型之一是由Goldbeter,Dupont和Berridge在19xx年提出的two-pool模
型。他们假设IP3引起一个Ca2+流入到细胞内,r,并且这个输入引起一个IP3关联的更多的Ca2+从ER的释放。即:
dc=r?kc?f(c,ce)dtdce=f(c,ce)dt
f(c,ce)=Juptake?Jrelease?kfce,
其中,Juptake
JreleaseV1cn=,K1)(cp)(V2cme.=K2K3+cpe
5(10)(11)(7)(8)(9)
这里,kfce是从ER到细胞质的渗漏。典型参数在书中表7.8中给出。
(a)无量纲化反应方程。共有几个无量纲参数?
(b)证明封闭细胞内(如一个和细胞外没有交换的细胞),two-pool模型不能描述振荡现象。
(c)系统稳态和流入r的关系是什么?
(d)用AUTO作出这个模型的分岔图,选取r为分岔参数。找到Hopf分岔节点并确定稳定极限环分支。画出不同r值的一些典型的极限环。
答:(a)见讲义59页的无量纲化过程,共六个无量纲参数。
(b)对于一个闭系统,有r=0,k=0.则dcdce+=0.dtdt
则模型本质上变成一个一维问题,不可能产生振荡性。
(c)见图2分岔图。流入r的大小决定系统稳态分岔。
Stable periodic orbits
HBUnstable ssFigure2:Twopoolmodel分岔图
(d)分岔图见图2,AUTO模拟结果:Hopf分叉节点为r1=3.109,r2=6.652处,取r=4,5,6分别作出相图,极限环已标出,见图三。
6
C_E2
C_E2
c_e2
dc/dt=0
r=4
1.81.61.4
r=5
1.81.61.4
Limit cycle
1.81.61.41.21
dc/dt=0
r=6
1.21
1.2
Limit Cycle
1
dc_e/dt=0
0.80.60.40.200
0.5
1
1.5
2C
2.5
3
3.5
4
0.80.60.40.200
0.5
1
1.5
2C
2.5
3
3.5
4
0.80.60.40.200
0.5
1
1.5
2c
2.5
3
3.5
4
Figure3:Twopoolmodelwithdi?erentin?uxr
7.5*当k4=k2,k?4=k?2时,写出书中7.2.5节的简化IP3受体模型的方程。令h=1?y。求出h的
微分方程,写出如下形式:
τh
dh
=h∞?h.dt
直接从书中图7.8的状态表中推导简化模型的方程。
答:由课本P289(7.16)式,将k4=k2,k?4=k?2,h=1?y代入可得,
dhk?2
=?(k2+c)h+k?2.dtk2
则有,τh=
?22,h∞
=
k?22.上式化为:
τh
自主阅读教材PP.288-290。
dh
=h∞?h.dt
7.6*有一个如图7.8所示的反应链,假设两个钙离子可以以一种合作的效应使得受体失活。一
个简单的这种合作效应模型为,
Sij0?Sij1
k?2k2c2
对i,j=0,1,假定组I和组II都处于拟稳态。求出模型的微分方程。答:即推导k4=k2,k?4=k?2下的(7.16)式。
参考(7.11)-(7.14)式写出质量作用定律联立可以得到(7.16)式。
7.9*参考2006Domiganetat.建立的钙离子振荡模型,考虑一个简单IPR模型(基于一个更早的
模型,Atrietal.,1993)
(a)解释模型中每个变量的生理意义。(b)参数v表示什么?
7
(c)当α=0和α=1时模型的形式截然不同,说明每个参数后的生理假设。
(d)用AUTO软件画出模型的分岔图,以v为分岔参数。α=0和α=1处的分岔图的区别是什么?(不要画出全部分岔图,只要找出主分支即可)
(e)你会怎样模拟实验学家所加的IP3脉冲?
(f)系统会对IP3脉冲如何反应?α=0和α=1两处反应的区别是什么?
答:略
8
