高中化学重要知识点总结 (完
整版)
一、俗名
无机部分:
纯碱、苏打、天然碱 、口碱:Na2CO3 小苏打:NaHCO3 大苏打:Na2S2O3 石膏(生石膏):CaSO4.2H2O 熟石膏:2CaSO4·.H2O 莹石:CaF2 重晶石:BaSO4(无毒) 碳铵:NH4HCO3 石灰石、大理石:CaCO3 生石灰:CaO 食盐:NaCl 熟石灰、消石灰:Ca(OH)2 芒硝:Na2SO4·7H2O (缓泻剂) 烧碱、火碱、苛性钠:NaOH 绿矾:FaSO4·7H2O 干冰:CO2 明矾:KAl (SO4)2·12H2O 漂白粉:Ca (ClO)2 、CaCl2(混和物) 泻盐:MgSO4·7H2O 胆矾、蓝矾:CuSO4·5H2O 双氧水:H2O2 皓矾:ZnSO4·7H2O 硅石、石英:SiO2 刚玉:Al2O3 水玻璃、泡花碱、矿物胶:Na2SiO3 铁红、铁矿:Fe2O3 磁铁矿:Fe3O4 黄铁矿、硫铁矿:FeS2 铜绿、孔雀石:Cu2 (OH)2CO3 菱铁矿:FeCO3 赤铜矿:Cu2O 波尔多液:Ca (OH)2和CuSO4 石硫合剂:Ca (OH)2和S 玻璃的主要成分:Na2SiO3、CaSiO3、SiO2 过磷酸钙(主要成分):Ca (H2PO4)2和CaSO4 重过磷酸钙(主要成分):Ca (H2PO4)2 天然气、沼气、坑气(主要成分):CH4 水煤气:CO和H2 硫酸亚铁铵(淡蓝绿色):Fe (NH4)2 (SO4)2 溶于水后呈淡绿色 光化学烟雾:NO2在光照下产生的一种有毒气体 王水:浓HNO3与浓HCl按体积比1:3混合而成。 铝热剂:Al + Fe2O3或其它氧化物。 尿素:CO(NH2) 2
有机部分:
氯仿:CHCl3 电石:CaC2 电石气:C2H2 (乙炔) TNT:三硝基甲苯 酒精、乙醇:C2H5OH 氟氯烃:是良好的制冷剂,有毒,但破坏O3层。 醋酸:冰醋酸、食醋 CH3COOH 裂解气成分(石油裂化):烯烃、烷烃、炔烃、H2S、CO2、CO等。 甘油、丙三醇 :C3H8O3 焦炉气成分(煤干馏):H2、CH4、乙烯、CO等。 石炭酸:苯酚 蚁醛:甲醛 HCHO 福尔马林:35%—40%的甲醛水溶液 蚁酸:甲酸 HCOOH
葡萄糖:C6H12O6 果糖:C6H12O6 蔗糖:C12H22O11 麦芽糖:C12H22O11 淀粉:(C6H10O5)n 硬脂酸:C17H35COOH 油酸:C17H33COOH 软脂酸:C15H31COOH 草酸:乙二酸 HOOC—COOH 使蓝墨水褪色,强酸性,受热分解成CO2和水,使KMnO4酸性溶液褪色。
二、 颜色
铁:铁粉是黑色的;一整块的固体铁是银白色的。 Fe2+——浅绿色 Fe3O4——黑色晶体 Fe(OH)2——白色沉淀 Fe3+——黄色 Fe (OH)3——红褐色沉淀 Fe (SCN)3——血红色溶液 FeO——黑色的粉末 Fe (NH4)2(SO4)2——淡蓝绿色 Fe2O3——红棕色粉末 FeS——黑色固体 铜:单质是紫红色 Cu2+——蓝色 CuO——黑色 Cu2O——红色 CuSO4(无水)—白色 CuSO4·5H2O——蓝色 Cu2 (OH)2CO3 —绿色 Cu(OH)2——蓝色
[Cu(NH3)4]SO4——深蓝色溶液 BaSO4 、BaCO3 、Ag2CO3 、CaCO3 、AgCl 、 Mg (OH)2 、三溴苯酚均是白色沉淀 Al(OH)3 白色絮状沉淀 H4SiO4(原硅酸)白色胶状沉淀
Cl2、氯水——黄绿色 F2——淡黄绿色气体 Br2——深红棕色液体 I2——紫黑色固体 HF、HCl、HBr、HI均为无色气体,在空气中均形成白雾
CCl4——无色的液体,密度大于水,与水不互溶 KMnO4--——紫色 MnO4-——紫色 1
第二篇:高中化学重要知识点
高中化学重要知识点
重要物质的用途
1、氧化铝陶瓷(人造刚玉)——高级耐火材料,如制坩埚、高温炉管等;制刚玉球磨机、高压钠灯的灯管等。
2、氮化硅陶瓷——超硬物质,本身具有润滑性,且耐磨损;除氢氟酸外,它不与其他无机酸反应,抗腐蚀能力强,高温时也能抗氧化,而且能抗冷热冲击。常用来制造轴承、汽轮机叶片、机械密封坏、永久性模具等机械构件;也可以用来制造柴油机。
3、碳化硼陶瓷——广泛应用于工农业生产、原子能工业、宇航事业等方面。
4、非盐型离子化合物的水解(水化格式,似复分解)
Mg3N2+6H2O==3Mg(OH)2↓+2NH3↑
Ca3P2+6H2O==3Ca(OH)2+2PH3↑
+2-1 -1 -1
CaC2+2H2O→Ca(OH)2+HC≡≡CH↑
类似的不难写出AI4C3、Mg4C3等的水解。如
+3-4 -4
AI4C3+12H2O→4AI(OH)3↓+3CH4↑
+2 -8 +1 -1 -8
Mg4C3+8H-OH→4Mg(OH)2↓+C3H8↑
题眼:根据常见反应的特征现象。
5、有“电解”条件的,通常联想到下列七种代表物:
电解水型:含氧酸H2SO4(aq)、强碱NaOH (aq)、活波金属的含氧酸盐Na2SO4(aq) 分解电解质型:无氧酸如HCI(aq)(HF除外)、不活波金属的无氧酸盐如CuCI2(aq) 放氧生酸型:不活波金属的含氧酸盐如CuSO4(aq)
放氢生碱型:活波金属的无氧酸盐如NaCI(aq)
电解熔融离子化合物:如AI2O3(I)、NaCI(I)
7、具有漂白作用的物质
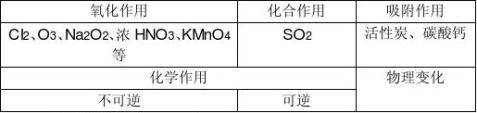
其中能氧化指示剂而使指示剂褪色的主要有CI2(HCIO)和浓HNO3及Na2O2

高中化学实验题文字表达归纳(实验题拿满分困难的同学错在细节问题,多注意)
1、测定溶液PH的操作:用玻璃棒沾取少量待测液到PH试纸上点触,半分钟后,再和标准比色卡对照,读出对应的PH。
2、有机试验中长导管的作用:冷凝回流提高反应物的利用率。
3、氢氧化铁胶体的制备:往煮沸的蒸馏水中逐滴滴加饱和的FeCI3溶液,当溶液变为红褐色时,立即停止加热。
4、颜色反应的操作:先将铂丝沾盐酸溶液在酒精灯火焰上灼烧,反复几次,直到与酒精灯火焰颜色相近为止,然后用铂丝沾取少量待测液,到酒精灯火焰上灼烧,观察火焰颜色,如为黄色,则溶液中含有钠离子,若透过蓝色钴玻璃呈紫色,则说明溶液中含有钾离子。
5、证明沉淀完全的操作:如往含有SO4 2-的溶液中加BaCI2溶液,如何证明硫酸根沉淀完全?将沉淀静置,取上层清液,再滴加BaCI2溶液,若无白色沉淀生成,说明沉淀已经完全。
6、洗涤沉淀操作:把蒸馏水沿着玻璃棒注入到过滤器中至浸没沉淀,静置,使蒸馏水滤出,重复2-3次即可。
7、渗析操作:将胶体装到半透膜袋内,用线将半透膜扎好后系在玻璃棒上浸在烧杯的蒸馏水中,及时更换蒸馏水。
8、萃取分液操作:关闭分液漏斗活塞,将混合液到倒入分液漏斗中,充分震荡、静置、分层,在漏斗下面放一个小烧杯,打开分液漏斗活塞,使下层液体从下口沿烧杯壁流下,上层液体从上口倒出。(打开上口、旋开活塞、放出下层、上口倒出)
9、酸碱中和滴定终点判断:如强酸滴强碱,用酚酞做指示剂,当最后一滴滴到锥形瓶中,溶液由红色变为无色,且半分钟内不变色即为终点。
10、装置气密性检查:(1)简易装置:将导气管一端放入水中(液封气体),用手加热试管,观察导气口有气泡冒出,冷却到室温后,导管口有一段水柱,表明装置气密性良好。(2)有分液漏斗的装置:用止水夹关闭烧瓶右侧的导气管,打开分液漏斗往分液漏斗中加水,加一定水后,若漏斗中的水不再滴下则装置气密性良好。(3)起普发生器型装置。关闭导气管出口,往球形漏斗(长颈漏斗)中加水,加适量水后,若球形漏斗(长颈漏斗)和容器中形成液面差,且长时间不变化,则装置气密性良好。
11、容量瓶检漏操作:往容量瓶内加一定量的水,塞好瓶塞。用食指摁住瓶塞,另一只手托住瓶底,把瓶倒立过来,观察瓶塞周围有无水漏出。如果不漏水,将瓶正立并将瓶塞旋转180°后塞紧仍把瓶倒立过来,再检查是否漏水。如果仍不漏水,即可使用。
12、气体验满及检验操作:(1)氧气验满:用带火星的木条放在集气瓶口,木条复燃说明收集的氧气已满。(2)可燃性气体(如氢气)的验纯方法:用排水法收集一小试管的气体,用大拇指摁住管口移近火焰,若听到尖锐的爆鸣声,则气体不纯;听到轻微“噗”的一声,则气体已纯。(3)二氧化碳验满:将燃着的木条平放在集气瓶口,若火焰熄灭则气体已满。(4)氨气验满:用湿润的红色石蕊试纸放在集气瓶口,若试纸变蓝,则气体已满。(5)氯气验满:用湿润的淀粉碘化钾试纸放在集气瓶口,若试纸变蓝则气体已满。
13、浓硫酸稀释操作:将浓硫酸沿着烧杯壁缓缓注入水中(乙醇、硝酸、乙酸等)中,并不断搅拌。
主要实验操作及现象(多用于无机有机推断题,做突破口)
1、镁条在空气中燃烧:发出耀眼强光,放出大量热生成白烟同时生成一种白色物质。
2、氢气在氯气中燃烧:发出苍白色火焰,产生大量的热。
3、加热试管中的硫酸铜晶体:蓝色晶体逐渐变为白色粉末。且试管口有液滴生成。
4、点燃纯净的氢气用干冷的烧杯罩在火焰上:发出淡蓝色火焰烧杯内壁有液滴生成。
5、将氯气通入碘化钾溶液中,溶液中有褐色物质产生。
6、细铜丝在氯气中燃烧后加入水:有棕色的烟生成,加水后成绿色的容液。
7、铁粉与硫粉混合后加热到红热:反应继续进行,放出大量热,生成黑色物质。
8、在集气瓶中混合硫化氢和二氧化硫:瓶内壁有黄色粉末生成。
9、二氧化硫气体通入品红溶液后加热:红色先褪去,加热后又恢复到原来的颜色。
10、钠在空气中燃烧:火焰呈黄色,生成淡黄色物质。
11、氨气与氯化氢相遇大量白烟产生。
12、在硅酸钠中加入盐酸:有白色胶状沉淀产生。
13、在氢氧化铁胶体中加硫酸镁溶液:胶体变浑浊。
14、将点燃的镁条伸入装有二氧化碳的集气瓶中:剧烈燃烧,有黑色固体附着于集气瓶壁。
15、向天然水中加入少量肥皂液:泡沫逐渐减少,且有沉淀产生。
16、光照甲烷与氯气的混合气体:黄绿色逐渐变浅,时间较长,容器内壁有液滴生成。
17、蛋白质遇到浓HNO3:变成黄色
化学:高中有机化学知识点总结
1、需水浴加热的反应有:
(1)银镜反应(2)乙酸乙酯水解(3)苯的硝化(4)糖的水解(5)酚醛树脂的制取(6)固体溶解度的测定。凡是在不高于100℃的条件下反应,均可用水浴加热,其优点:温度变化平稳,不会大起大落,有利于反应的进行。
2、需用温度计的实验有:
(1)实验室制乙烯(170℃)(2)蒸馏(3)固体溶解度的测定(4)乙酸乙酯水解(70—80℃)
(5)中和热的测定(6)制硝基苯(50—60℃)
(说明):(1)凡是需要准确控制温度者均需用温度计。(2)注意温度计水银球的位置。
3、能与Na反应的有机物有:
醇、酚、羧酸等——含有羟基的化合物。
4、能发生银镜反应的物质有:
醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖——凡含醛基的物质。
能使高锰酸钾酸性溶液褪色的物质有:
(1)含有碳碳双键、碳碳三键的烃和烃的衍生物、苯的同系物(与苯环直接相连的碳上要有氢)
(2)含有羟基的化合物如醇或酚类物质
(3)含有醛基的化合物
(4)具有还原性的无机物(如SO2、FeSO4、KI、HCI、H2O2 等)
5、能使溴水褪色的物质有:
(1)含有碳碳双键、碳碳三键的烃和烃的衍生物(加成)
(2)苯酚酚类物质(取代)
(3)含有醛基的化合物(氧化)
(4)碱性物质(如NaOH 、Na2CO3)(氧化还原——歧化反应)
(5)较强的无机还原剂(如SO2、FeSO4、KI等)(氧化)
(6)有机溶剂(萃取)
6、密度比水大的液体有机物有:
溴乙烷、溴苯、硝基苯、四氯化碳等
7、烃的含氧衍生物为气体的是HCHO
8、密度比水小的液体有机物有:
烃、大多数酯、一氯烷烃。
9、常温下为气体的有机物有:
分子中含有碳原子数小于或等于4的烃(新戊烷除外)、一氯甲烷、甲醛
二.实验室制法
乙炔:CaC2+2H2O→Ca(OH)2+HC≡≡CH↑
注排水法收集,过CuSO4溶液,除去硫化氢等杂质气体。不能用起普发生器、饱和氯化钠,降低反应速率 导管口放棉花 防止微溶的Ca(OH)2泡沫堵塞导管
乙醇:CH2=CH2+H2O→(催化剂、加热、加压)→CH3CH2OH
(话说我忘了这是工业还是实验室。。。)
(注:无水CuSO4验水)(白→蓝)
提高纯度:加CaO再加热蒸馏)
三.燃烧现象
烷:火焰呈淡蓝色,不明亮
烯:火焰明亮,有黑烟
炔:火焰明亮,有浓烈黑烟
苯:火焰明亮,有浓烈黑烟
醇:火焰呈淡蓝色,放大量热
醇:
1、置换(活波金属)
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
钠的密度大于醇 反应平稳
钠的密度小于水 反应剧烈
2、消去(分子内脱水)
C2H5OH→(浓硫酸,170℃)CH2=CH2↑+H2O
3取代(分子间脱水)
2C2H5OH→(浓硫酸,140℃)CH3CH2OCH2CH3(乙醚)+H2O
(乙醚:无色 无毒 易挥发 液体 麻醉剂)
4、催化氧化
2CH3CH2OH+O2→(Cu或Ag,加热)2CH3CHO(乙醛)+2H2O 现象:铜丝表面变黑 进入酒精后变红(红热状态进入酒精)
液体有特殊刺激性气味
酸:取代(酯化)
CH3COOH+C2H5OH→(浓硫酸,加热)CH3COOC2H5+H2O
(乙酸乙酯:有香味的无色油状液体)注:【酸脱羟基醇脱氢】(同位素示踪法) 碎瓷片(沸石):防止暴沸(暴力的暴)
浓硫酸:催化、脱水、吸水
饱和Na2CO3溶液:便于分离和提纯
卤代烃:
1、取代(水解)【NaOH 水溶液】
CH3CH2X+NaOH →(H2O,加热)C2H5OH+NaX
NaOH 水溶液:中和HBr加快反应速率)
检验X:加入硝酸酸化的AgNO3溶液观察沉淀颜色若白色则为CI 淡黄则为Br 黄色则为I
2、消去【NaOH 醇溶液】
CH3CH2CI+NaOH →(醇,加热)CH2=CH2↑+H2O+NaCI
(注:相邻碳上有氢才可以消去)
加H加在H多处,脱H脱在H少处(马氏规律)
锦上添花 雪上加霜
醇溶液:抑制水解(抑制NaOH 电离)
有机几大反应类型
取代、加成、消去、加聚、缩聚、氧化、还原
其他分类细化:取代(酯化,烷烃卤代,水解(卤代烃的水解)
其他知识点
1、反应前后压强|体积不变:Y=4
变小:Y<4
变大:Y>4
2、耗氧量:等物质的量(等V):C越多,消耗氧气越多
等质量 :C%越高,耗氧越少
3、医用酒精:75% 工业酒精:95%(含甲醇,有毒) 无水酒精99%
4、乙酸酸性介于HCI和H2CO3之间 食醋:3%-5% 冰醋酸纯乙酸(纯净物)
5、高分子,链节、聚合度、单体
