化学必修1第三章金属及其化合物
第一节 金属的化学性质 检测题
一、选择题:(每小题只有一个正确答案)
1.金属材料在人类社会的发展史上一直发挥着重要的作用。人类历史上使用最早的金属( )
A.铜 B.铁 C.铝 D.钛
2.下列关于金属的叙述中正确的是
A.所有的金属都是固态的
B.金属具有导电性、导热性和延展性
C.活泼的金属、或较活泼的金属能与酸反应,但不能与碱反应
D.金属元素在自然界中都是以化合态存在的
3.通过你的观察和推理,判断下列实验室中对于少量Na的保存方法正确的是
A.保存在水中 B.密封,保存在广口瓶中
C.用铝箔包裹,密封在广口瓶中 D.密封,保存在煤油中
4.从生活常识角度考虑,试推断钠元素在自然界中存在的主要形式是
A.Na B.NaCl C.NaOH D.Na2O
5.下列物质中,有一种物质的颜色与其它三种的颜色不同,这种物质是
A.NaOH B.Na2O C.Na2O2 D.NaHCO3
6.铝在空气中能够稳定存在的原因是
A.铝的活泼性差 B.铝的还原性差
C.铝与氧气不反应 D.铝表面有氧化膜
7.将2.3g金属钠放入100g水中,完全反应后溶液的质量分数为( )
A.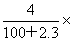 100% B.
100% B.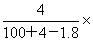 100%
100%
C.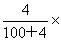 100% D.
100% D.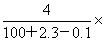 100%
100%
8.关于Na2O和Na2O2的叙述正确的是( )
A.都是白色的固体 B.都是碱性氧化物
C.都能和水反应形成强碱溶液 D.都是强氧化剂
9.下列各组中的两物质相互反应时,若改变反应条件(温度、反应物用量比),化学反应的本质并不改变的是
A.Na和O2 B.NaOH和CO2
C.Na2O2和CO2 D.木炭(C)和O2
10.为了除去铁粉中的少量铝粉,可以选取下列哪种溶液 ( )
 A.浓盐酸 B.浓硝酸 C.浓硫酸 D.浓氢氧化钠溶液
A.浓盐酸 B.浓硝酸 C.浓硫酸 D.浓氢氧化钠溶液
11.Na2O2与水反应能够产生O2,这一反应在呼吸面具、潜水艇及太空飞船中可为人体提供呼吸所用的O2。下面对该反应的说法中正确的是 ( )
A.这是一个氧化还原反应,Na2O2既是氧化剂,又是还原剂
 B.这是一个氧化还原反应,Na2O2是氧化剂,水是还原剂
B.这是一个氧化还原反应,Na2O2是氧化剂,水是还原剂
C.这是一个氧化还原反应,Na2O2是还原剂,水是氧化剂
D.这是一个置换反应,有单质O2产生
12.取一块用砂纸打磨过的铝箔在空气中加热至熔化,下列说法中不正确的是
A.铝失去了光泽 B.剧烈燃烧,火星四射
C.熔化的铝不滴落 D.在加热熔化过程中生成了氧化铝
13.若在加入铝粉能放出H2的溶液中,分别加入下列各组离子,肯定不能共存的是
A. Fe3+、NO3-、Cl-、Na+
B.Ba2+、Mg2+、HCO3-、AlO2-(95上海)
C.NO3-、Na+、K+、CO32-
D.NO3-、K+、AlO2-、OH-
14.下列反应的离子方程式书写不正确的是 ( )
A.钠和冷水反应 2 Na+2H2O=2Na++2OH-+H2↑
B.金属铝溶于氢氧化钠溶液 Al+2OH-=AlO2-+H2
C.金属铝溶于盐酸中:2Al+6H+=2Al3++3H2↑
D.铁跟稀硫酸反应:Fe+2H+=Fe2++H2
15.一块表面已被氧化为Na2O的钠块10.8g,将其投入100g水中,产生H2 0.2g,则被氧化的钠是
A.9.2g B.10.6g C.6.2g D.4.6g
16.下列关于铝的叙述中,不正确的是
A.铝是地壳中含量最多的金属元素 B.常温下,铝能与NaCl溶液发生置换反应
C.铝是一种比较活泼的金属 D.在化学反应中,铝容易失去电子,是还原剂
17.取两份等量的铝粉,分别与足量的盐酸、浓氢氧化钠溶液反应,在相同状态下产生的气体体积之比是
A.1:1 B.1:2 C. 1:3 D. 3:2
18. 氢氧化铝可作为治疗胃酸过多的内服药,这是利用了氢氧化铝的
A. 酸性 B. 碱性 C. 两性 D. 氧化性
19. 下列性质中,不属于大多数金属通性的是
A. 有银白色光泽 B. 有延展性
C. 有良好的导电性和导热性 D. 有很高的熔点和硬度
20..称取两等份铝粉,第一份加入足量的盐酸,第二份加入足量的烧碱。若同温同压下放出相同体积的气体,则消耗的HCL和NaOH的物质的量之比为
A.1:1 B.2:3 C.3:2 D.3:1
二、填空题

 21.取黄豆粒大小的一块金属钠,用滤纸擦干其表面的煤油,然后加入到硫酸铜溶液中,观察实验现象并写出化学方程式:①钠在溶液中反应的实验现象 ,反应的化学方程式是 。②溶液中的实验现象 ;反应的化学方程式是 。
21.取黄豆粒大小的一块金属钠,用滤纸擦干其表面的煤油,然后加入到硫酸铜溶液中,观察实验现象并写出化学方程式:①钠在溶液中反应的实验现象 ,反应的化学方程式是 。②溶液中的实验现象 ;反应的化学方程式是 。
22.在铝质易拉罐中收集满CO2气体,然后在其中倒入10mL浓NaOH溶液,并迅速用胶带将易拉罐口封住,能够观察到的实验现象是易拉罐突然变瘪了,可经过一段时间之后,又可以观察到的现象是 。试解释易拉罐变瘪的原因 ;并解释后一现象的原因 。写出反应过程中的两个离子方程式 ; 。
23.有一镁铝合金,根据某同学的操作,回答下列问题:
⑴将合金与过量NaOH溶液反应,所得溶液中不存在的离子是 。
 A、Na+ B、Mg2+ C、OH- D、ALO2-
A、Na+ B、Mg2+ C、OH- D、ALO2-


 ⑵将合金溶于过量的盐酸中,充分反应后,溶液中新生成的离子是 ;再加入过量的NaOH溶液,反应后溶液中新生成的离子是 ,减少的金属离子是 。
⑵将合金溶于过量的盐酸中,充分反应后,溶液中新生成的离子是 ;再加入过量的NaOH溶液,反应后溶液中新生成的离子是 ,减少的金属离子是 。
24.某学生课外活动小组模拟呼吸面具中的反应原理设计用图3-1所示的仪器来制取氧气并测量氧气的体积。图中量气装置E由甲乙两根玻璃管组成,它们由橡皮管连通,并装入适量水。甲管有刻度(0~50mL)供量气用,乙管可上下移动调节液面高低。
实验可供选用的药品还有:稀硫酸、盐酸、过氧化钠、碳酸钠、大理石、水。试回答:
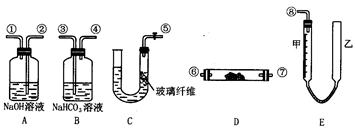
实验仪器图3-1
(1)图中各装置接口连接顺序是______(填各接口的编号,其中连接胶管及夹持装置均省略)。
(2)装置C中放入的反应物是______和______。
(3)装置A的作用是______,装置B的作用是______。
(4)为了较准确测量氧气的体积,除了必须检查整个装置的气密性之外,在读反应前后甲管中液面的读数求其差值的过程中应注意______和______(填字母编号)。
a.视线与凹液面最低处相平
b.等待片刻,待乙管中液面不再上升时立刻读数
c.读数时应上下移动乙管,使甲乙两管液面相平
d.读数时不一定使甲乙两管液面相平
25.在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。
应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。
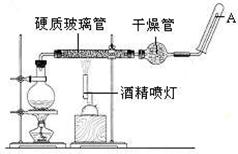
请回答该实验中的问题。
(1)写出该反应的反应方程式: ;并指明该氧化还原反应的还原剂是 ,氧化剂是 。
(2)实验前必须对整套装置进行气密性检查,操作方法是 。
(3)圆底烧瓶中盛装的水,该装置受热后的主要作用是 ;烧瓶底部放置了几片碎瓷片,碎瓷片的作用是 。
 (4)酒精灯和酒精喷灯点燃的顺序是 ,为什么? 。
(4)酒精灯和酒精喷灯点燃的顺序是 ,为什么? 。
(5)干燥管中盛装是的物质是 ,作用是 。
 (6)试管中收集气体是 ,如果要在A处玻璃管处点燃该气体,则必须对该气体进行 ,方法是 。这一操作的目的是 。
(6)试管中收集气体是 ,如果要在A处玻璃管处点燃该气体,则必须对该气体进行 ,方法是 。这一操作的目的是 。
26.将质量为1。15 g钠用刺了孔的铝箔包裹后放入水中,共收集到1。232 L(标准状况)气体。请回答下列问题:
⑴1.15 g钠与水反应,理论上生成气体的体积(标准状况)为 L 。
 ⑵Al和NaOH溶液反应也能生成H2,写出相应的化学方程式: 。
⑵Al和NaOH溶液反应也能生成H2,写出相应的化学方程式: 。
 ⑶若反应后溶液的体积为100 mL,则溶液中NaOH的物质的量浓度为多少?
⑶若反应后溶液的体积为100 mL,则溶液中NaOH的物质的量浓度为多少?
高一化学必修1第三章金属及其化合物
第一节金属的化学性质答案
一.选择题
21.①钠浮在液面上,很快熔化成小球,钠球在水面上四处游动,并发出嘶嘶的响声;2Na+2H2O=2NaOH+H2↑ ②溶液中有蓝色沉淀产生;2NaOH+CuSO4=Na2 SO4+Cu(OH)2↓(蓝色)
22.易拉罐又鼓起来;易拉罐中的CO2与浓NaOH反应,致使易拉罐内气压降低,从而使易拉罐被大气压压瘪;浓NaOH与易拉罐(Al)反应产生H2,随着易拉罐内H2量的增多,易拉罐内气压增大;CO2+2OH- =CO32-+H2O;
2Al+2OH-+2H2O=2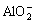 +3H2
+3H2
23、(1)B
(2)Mg2+、Al3+、AlO2-;Mg2+、AL3+
24.(1)⑤③④⑥⑦②①⑧(⑥、⑦可换位) (2)大理石盐酸 (3)除去混在O2中未反应的CO2吸收CO2中混有的HCl(4)ac
 25.(1)
25.(1) ;Fe;H2O
;Fe;H2O
(2)在玻璃管口A处接一断乳胶管,乳胶管头上连一段玻璃管,并将管口没入水中,用酒精灯火焰微热烧瓶底部,如果能够观察到没入水中的玻璃管口有气体逸出,停止加热后,玻璃管内有水柱上升,且较长时间水柱不回落,则标明该套装置气密性良好。
(3)为硬质玻璃管内Fe与水蒸气的反应实验提供持续不断的水蒸气;防止爆沸事故的发生。
(4)先点燃酒精灯,产生水蒸气后,再点燃酒精喷灯;防止先点燃酒精喷灯所导致的Fe与O2的反应。
(5)碱石灰干燥剂;除去反应产生的H2中的水蒸气。
(6)H2;验纯;用试管收集一试管气体,靠近火焰酒精灯火焰,如果发出的声音是“啪”的爆鸣声,则证明产生的氢气不纯(含有氧气),如果是“噗”的声音,则证明是纯净的氢气;防止点燃时,氢气因含有氧气而爆炸。
26、(1)0.56
 (2)2Al2NaOH+2H2O====2NaAl2+3H2
(2)2Al2NaOH+2H2O====2NaAl2+3H2
(3)0.3 mol·l-1
第二篇:高一化学必修一第一章《从实验学化学》单元测试题1(含详细解答)
第一章《从实验学化学》单元测试题
(90分钟,100分)
一、选择题(每小题只有1个选项符合题意,每小题3分,共54分)
1.在盛放浓硫酸的试剂瓶标签上应印有下列警示标记中的(
)
【答案】 D
【解析】 浓H2SO4具有强烈的腐蚀性,但不能燃烧爆炸。
2.(湖南长沙一中2009-2010学年度高一月考,2)下列实验中均需要的仪器是( ) ①配制一定物质的量浓度的溶液 ②PH试纸的使用 ③过滤 ④蒸发
A.试管 B.胶头滴管
C.玻璃棒 D.漏斗
【答案】 C
3.(福建龙岩一中2009-2010学年度高一上学期模块考试)下列分离或提纯物质的方法正确的是( )
A.用蒸馏的方法制取蒸馏水
B.用过滤的方法除去NaCl溶液中含有的少量淀粉胶体
C.用溶解、过滤的方法提纯含有少量BaSO4的BaCO3
D.用加热、蒸发的方法可以除去CaCl2、MgCl2等杂质
【解析】 B中淀粉胶体微粒可透过滤纸,因此不能用过滤方法除去,应用渗析的方法;C中BaSO4和BaCO3均不溶于水不能通过过滤的方法提纯,可采用加入稀盐酸过滤的方法除去BaCO3;D中粗盐中的CaCl2、MgCl2,均溶于水,加热蒸发会与NaCl共同析出,因此通过蒸发方法不能除去CaCl2、MgCl2。
【答案】 A
4.关于粗盐提纯的下列说法中正确的是( )
A.溶解粗盐时,应尽量让溶液稀些,防止食盐不完全溶解
B.滤去不溶性杂质后,将滤液移至坩埚内加热浓缩
C.当蒸发到剩余少量液体时,停止加热,利用余热将液体蒸干
D.将制得晶体转移到新制过滤器中用大量水进行洗涤
【答案】 C
【点拨】 溶解粗盐时,在保证粗盐溶解的前提下应尽量少加水,避免蒸发时困难;B选项操作应在蒸发皿中进行,利于水分的挥发;D项操作会造成食盐过多损失。 1
5.关于容量瓶的四种叙述:①是配制准确浓度溶液的仪器;②不宜贮存溶液;③不能用来加热;④使用之前要检查是否漏水。这些叙述中正确的是( )
A.①②③④
C.①②④
【答案】 A
【点拨】 容量瓶是配制准确浓度溶液的仪器,应了解其特点,有刻度线、温度、容量等标识,不能用于加热和存放试剂。
6.某同学在实验报告中记录下列数据,其中正确的是( )
A.用25mL量筒量取12.36mL盐酸
B.用托盘天平称量8.75g食盐
C.用500mL的容量瓶配制450mL溶液
D.用广泛pH试纸测得某溶液的pH为3.5
【答案】 C
【点拨】 在读取读数时要注意其精确度,量筒精确到0.1mL,托盘天平精确到0.1g,广泛pH试纸精确到1个单位。容量瓶有规格,配制溶液时应该选择规格等于或稍大于所需溶液体积的容量瓶。而配450mL溶液,选500mL的容量瓶合适。
7.(湖南长沙一中2009-2010学年度高一月考,7)下列说法中正确的是( )
A.在一定温度和压强下,各种气态物质体积大小由构成气体分子大小决定
B.在一定温度和压强下,各种气态物质体积的大小由构成气体的分子数决定
C.不同的气体,若体积不同,则它们所含的分子数一定不同
D.气体摩尔体积是指1mol任何气体所占的体积约为22.4L
【解析】 依据气体体积的影响因素可知:温度和压强一定时,气体体积主要由其物质的量的多少决定;气体摩尔体积是指在一定温度、压强下1mol任何气体所占的体积约为相等,但只有在标准状况下的气体摩尔体积是指1mol任何气体所占的体积为22.4L;依据阿伏加德罗定律及其推论知:不同的气体,若体积不等,则它们所含的分子数有可能相等。
【答案】 B
8.下列实验操作正确的是( )
A.制取蒸馏水时,为了防止瓶内产生暴沸现象,应先向烧瓶内加入几片碎瓷片
B.稀释浓硫酸时,常把水加入到盛浓硫酸的烧杯中
C.做CO还原Fe2O3实验时,为防止CO污染环境,实验完毕,常先停止通CO,再停止加热
D.在用水吸收HCl气体时可把导管直接插入液面下
【答案】 A
【点拨】 进行化学实验时要牢记实验操作程序,特别是危险性的操作更要谨慎,实验 2 B.②③ D.②③④
前多从以下几个方面进行思考:防暴沸——加碎瓷片;防倒吸;热还原结束时的操作:停止加热应继续通气体至冷却;稀释时通常把密度大的液体加到密度小的液体中。
9.(山东五莲2009-2010学年度上学期期中考试)设NA表示阿伏加德罗常数,下列叙述中正确的是( )
A.常温常压下,11.2L NH3所含的原子数为2NA
B.常温常压下,80g SO3含有的氧原子数为3NA
C.标准状况下,22.4L H2中所含原子数为NA
D.一定条件下,56g铁粉与足量的Cl2完全反应转移电子数目为2NA
【解析】 A中常温常压下,11.2L NH3的物质的量不是0.5mol,因此原子数不是2NA;C中标准状况下,22.4L H2的物质的量为1mol,含原子数为2NA,Fe与Cl2反应生成FeCl3,56g Fe的物质的量为1mol,与Cl2反应时转移3mol电子,即转移电子数目为3NA。
【答案】 B
10.若某原子的摩尔质量为M g·mol,则一个该原子的真实质量是( )
A.M g 1B.g M
6.02×10D. g M23-1MC. g 6.02×10【答案】 C
【点拨】 摩尔质量与相对原子质量及1摩尔原子质量数值相等,所以1摩尔原子的质量为Mg,而
M1摩尔原子中含有原子的数目为6.02×1023个,所以1 g。 6.02×1011.在标准状况下,1体积水溶解700体积氨气,所得溶液密度为0.9g·cm-3,这种氨水的物质的量浓度和溶质的质量分数分别为( )
A.18.4mol·L 34.7%
B.20.4mol·L-1 38.5%
C.18.4mol·L-1 38.5%
D.20.4mol·L-1 34.7%
【答案】 A
【点拨】 NH3溶于水后虽然大部分生成NH3·H2O,但在计算时,我们仍以NH3作为氨水中的溶质;气体溶于水后,溶液的体积、密度均发生了改变,计算时应该用溶液质量除以密度求出其体积。
设水的体积为1L,则有:
700L÷22.4L·mol-1×17g·mol-1
w=--×100%=34.7%。 1 000g+700L÷22.4L·mol×17g·mol-1
3
氨水的体积为:
1 000g+700L÷22.4L·mol×17g·molV=--0.9g·cm×1 000cm·L
=1.7L。
700L÷22.4L·mol故c==18.4mol·L-1。 1.7L
12.(2009·海南化学·8)下列叙述正确的是(用NA代表阿伏加德罗常数的值)( )
A.2.4 g金属镁变为镁离子时失去的电子数为0.1NA
B.1 mol HCl气体中的粒子数与0.5 mol/L盐酸中溶质粒子数相等
C.在标准状况下,22.4 L CH4与18 g H2O所含有电子数均为10NA
D.CO和N2为等电子体,22.4 L的CO气体与1 mol N2所含的电子数相等
【答案】 C
13.某非金属单质A和氧气发生化合反应生成B。B为气体,其体积是反应掉氧气体积的两倍(同温、同压)。以下对B的分子组成的推测一定正确的是( )
A.有1个氧原子 B.有2个氧原子 -1-1-1
C.有1个A原子 D.有2个A原子
【答案】 A
【点拨】 审题要细,如“A为非金属单质”,生成物B与消耗的O2的体积比为21,即B与O2的分子个数之比为21,由质量守恒定律,则B分子中应有1个氧原子。A的状态与O2的体积比都不知,无法确定B分子中A原子的数目。本题实际上考查了阿伏加德罗定律的推论:在同温同压下,气体体积比等于气体分子数之比。深刻理解定律,准确判断题目中的情况为哪种情况是解题的关键。
14.已知Q与R的摩尔质量之比为922,在反应X+2Y===2Q+R中,当1.6g X与Y完全反应后,生成4.4g R,则参与反应的Y和生成物Q的质量之比为( )
A.46∶9
C.23∶9
【答案】 D
【点拨】 本题主要考查质量守恒定律及化学反应方程式的有关计算,即化学反应中反应物的总质量等于生成物的总质量;参与反应的反应物之间,反应物与生成物之间,生成物之间的质量之比等于它们的摩尔质量乘以化学计量数之比。根据X+2Y===2Q+R知4.4g R
2×9生成时生成的Q为×4.4g=3.6g,由质量守恒定律知参与反应的Y的质量为3.6g+4.4g22
6.4g16-1.6g=6.4g,则参与反应的Y和生成物Q=,故选D。 3.6g9
15.(湖南长沙一中2009-2010学年度高一月考,13)某10% NaOH溶液,加热蒸发掉 B.32∶9 D.16∶9 4
100g水后得到80mL 20%的溶液,则该20% NaOH溶液的物质的量浓度为( )
A.6.25mol·L
C.7mol·L-1 -1B.12.5mol·L D.7.5mol·L-1 -1
【解析】 设20% NaOH溶液的质量为m,依据溶液蒸发前后溶质的质量不变,则20% m=(m+100g)×10%,解之得,m=100g,故20% NaOH溶液中溶质的质量为20%×100g=20g,其溶质NaOH的质量为0.5mol,所以该20%NaOH溶液的物质的量浓度为0.5mol÷0.08L=6.25mol·L。
【答案】 A
16.下列说法中正确的是( )
A.标准状况下,22.4L水中所含的分子数约为6.02×1023
B.标准状况下,aL的氧气和氮气的混合物含有的分子数约为
C.常温常压下,48g O3气体含有的氧原子数为
6.02×1023
D.2.24L CO2中含有的原子数为0.3×6.02×1023
【答案】 B
【点拨】 标准状况下水不是气态,不能用
Vm=22.4L·mol-1计算;48g O3气体是1mol O3分子,原子数为3×6.02×1023;D项中没有气体存在的条件,所以不能确定;标准状况下 aL混合气
a-123n=aL/22.4L·mol,分子数为6.02×10,故选B。 22.4
17.下列有关实验的叙述中,正确的是( )
①仅用蒸馏水就可鉴别蔗糖、硫酸铜粉未、碳酸钙粉未;
②用分液漏斗分离甘油和水的混合物;
③稀释浓硫酸时,将浓硫酸沿烧杯壁慢慢注入水中并不断搅拌;
④用玻璃棒蘸取溶液滴在pH试纸中央,测该溶液的pH;
⑤配制一定物质的量浓度的溶液,需要的玻璃仪器只有容量瓶和烧杯;
⑥在250mL烧杯中,加入216mL水和24g NaOH固体,配制10% NaOH溶液。
A.①⑥
B.④⑤⑥ D.②⑤ a6.02×1023 22.4-1C.①③④⑥
【答案】 C
【点拨】 蔗糖溶于水为无色溶液,硫酸铜粉未溶于水为蓝色溶液,碳酸钙粉未不溶于水;甘油与水互溶,不能用分液漏斗分开;配制一定物质的量浓度的溶液,需要的玻璃仪器还有玻璃棒;③、④操作是正确的;⑥通过计算也是对的。故选C。
18.(山东五莲2009-2010学年度上学期期中考试)下列有关0.2mol·L-1 BaCl2溶液的说 5
法不正确的是( )
A.500mL溶液中Cl离子浓度为0.2mol·L
B.500mL溶液中Ba2+离子浓度为0.2mol·L-1
C.500mL溶液中Cl-离子总数为0.2NA
D.500mL溶液中Ba和Cl离子总数为0.3NA
【解析】 离子浓度与所取溶液体积无关,因此0.2mol·L BaCl2溶液中无论体积多少,Ba浓度总是0.2mol·L,Cl浓度为0.4mol·L。500mL溶液中;n(Cl)=0.4mol·L×0.5L=0.2mol,n(Ba2+)=0.2mol·L-1×0.5L=0.1mol,因此Cl-总数为0.2NA,Ba2+和Cl-离子总数为0.3NA。
【答案】 A
二、非选择题(本题包括6个小题,共46分)
19.(6分)在配制一定体积的溶液中,下列操作使得到的溶液浓度偏高、偏低还是无影响?
(1)将溶解溶质的烧杯内的液体倒入容量瓶后,未洗涤烧杯就进行定容。
________________________________________________________________________
(2)定容时,液面超过容量瓶颈上的刻度线,用胶头滴管将过量的液体吸出。
________________________________________________________________________
(3)定容摇匀后,发现瓶内液面略低于瓶颈刻度线。
________________________________________________________________________
【解析】 用容量瓶配制一定体积的溶液时:①应尽可能将溶质全部转移到容量瓶中,否则所配溶液浓度偏低。②定容时,若加水过量则所配溶液浓度偏低,若用胶头滴管将多余液体吸出时,也同时带走了少量溶质,所以所得溶液浓度仍偏低。③定容时,由于少量液体沾在瓶口、瓶壁上,而使瓶内液面略低于刻度线,其对溶液浓度无影响。
【答案】 (1)偏低 (2)偏低 (3)无影响
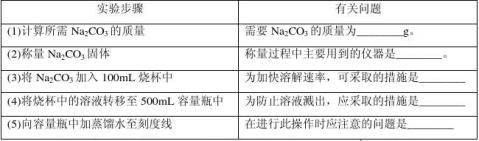
20.(山东五莲2009-2010学年度上学期期中考试)(6分)某同学按下列步骤配制500mL 0.200mol·L-1 Na2CO3溶液,请回答有关问题。
2+-1--1--1-1--12+-
23【答案】 (1)10.6 (2)托盘天平、砝码、药匙(“砝码”不填也正确) (3)搅拌、加热 (4)
6
用玻璃棒引流 (5)加蒸馏水至容量瓶中的液面接近刻度线1cm~2cm处,改用胶头滴管滴加 不是。因为该同学没有洗涤烧杯和玻璃棒
21.(10分)欲用98%的浓硫酸(g=1.84g·cm-3)配制成浓度为0.5mol·L-1的稀硫酸500ml。
(1)选用的主要仪器有:
①__________,②__________,③__________,④____________,⑤____________。
(2)请将下列各操作,按正确的序号填在横线上。
A.用量筒量取浓H2SO4
B.反复颠倒摇匀
C.用胶头滴管加蒸馏水至刻度线
D.洗净所用仪器
E.稀释浓H2SO4
F.将溶液转入容量瓶
其操作正确的顺序依次为____________________________。
(3)简要回答下列问题:
①所需浓硫酸的体积为____________mL。
②如果实验室有15mL、20mL、50mL的量筒应选用____________mL的量筒最好,量取时发现量筒不干净用水洗净后直接量取将使浓度__________(“偏高”、“偏低”、“无影响”)
③将浓硫酸沿烧杯内壁慢慢注入盛水的烧杯中,并用玻璃棒不断搅拌的目的是____________,若搅拌过程中有液体溅出结果会使浓度偏____________。
④在转入容量瓶前烧杯中液体应____________,否则会使浓度偏____________;并洗涤烧杯和玻璃棒2~3次,洗涤液也要转入容量瓶,否则会使浓度____________。
⑤定容时必须使溶液凹液面与刻度线相切,若俯视会使浓度____________;仰视则使浓度____________。
【解析】 设所需浓硫酸的体积为V,
则:V×1.84g·cm-3×98%=0.5L×0.5mol·L-1×98g·mol-1,解得V=13.6mL。依公式cn=知,造成浓度偏差的原因可从n或V进行分析。造成n的偏差往往由①称量,②转移,V
③洗涤等操作所致。造成V的偏差可由④错误读数,⑤未冷却所致。如未洗涤溶解用的烧杯和玻璃棒,造成n值偏小,c值偏小。
【答案】 (1)量筒 烧杯 玻璃棒 500mL容量瓶 胶头滴管 (2)D、A、E、F、D、
C、B (3)①13.6 ②15 偏低 ③防止暴沸,迅速散热 低 ④静置冷却 高 偏低 ⑤偏高 偏低
【点拨】 ①溶液在注入容量瓶前要先恢复到室温。因溶解过程有吸热(NH4NO3、KNO3 7
溶解等)过程、放热(NaOH、Na2CO3、KOH、H2SO4等溶解)过程,影响溶液的体积。
②配制NaOH溶液时,必须用小烧杯快速称量NaOH固体。因NaOH固体易潮解,且有腐蚀性,称量过程中时间越长,吸水越多,导致所配溶液浓度越低。若在纸上直接称量,NaOH吸水潮解并粘在纸上,会部分损失,使所配溶液浓度偏低。另外,潮解后固体表面的溶液渗过纸后会腐蚀托盘。
22.(16分)某同学用某种粗盐进行提纯实验,步骤见下图。

请回答:
(1)步骤①和②的操作名称是________________。
(2)步骤③判断加入盐酸“适量”的方法是________________________________________________________________________
________________________________________________________________________ 步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止__________________,当蒸发皿中有较多量固体出现时,应__________________,用余热使水分蒸干。
(3)猜想和验证:

-生的气体通入澄清石灰水中,猜想Ⅲ是对SO24的检验,可选用适当的钡试剂。
【答案】 (1)过滤 (2)滴加盐酸至无气泡放出为止 局部过热,造成固体(或溶液)飞溅 停止加热(或熄灭酒精灯) (3)猜想Ⅰ:有气泡放出,烧杯底变浑浊(或石灰水变浑浊) 猜想Ⅱ:稀硝酸(或稀盐酸) 猜想Ⅱ不成立 猜想Ⅲ:滴入BaCl2[或Ba(OH)2、或Ba(NO3)2]溶液和稀HNO3 有白色沉淀且不溶于稀HNO3
23.(贵州乌沙中学2009-2010学年高一上学期期中考试)(10分)现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg/mol。若阿伏加德罗常数用NA表示,则: 8
(1)该气体的物质的量为________mol。
(2)该气体所含原子总数为________个。
(3)该气体在标准状况下的体积为________L。
(4)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为________。设溶液的密度为ρg/cm,则该溶液的物质的量浓度为__________mol·L。
(5)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为________mol·L。
mgm【解析】 (1)nmol。 Mg/molM
(2)由于该气体为双原子分子,则原子数为
m2mNmol×2×NA= MM
(3)根据气体的物质的量,则
m22.4mV=22.4L/mol×mol=L。 MM
(4)根据水的密度,1L水的质量为1000g,
因此w=mgm×100%=×100%. mg+1000gm+1000-13-1
m331000cm/L·ρg/cm×100%m+1000c=Mg/mol
=1000ρmL-1。 M(m+1000)
mMm-1(5)c=mol·L。 VLMV
m2mNA22.4m【答案】 (1) (2) (3) MMM
m1000ρmm(4)×100% (5)m+1000M(m+1000)MV
24.(12分)常温下,将20.0g质量分数为14.0%的KNO3溶液跟30.0g质量分数为24.0%的KNO3溶液混合,得到密度为1.15g·cm
(1)混合后溶液的质量分数。
(2)混合后溶液的物质的量浓度。
(3)在1 000g水中需溶解多少摩尔KNO3才能使其浓度恰好与上述混合后溶液的浓度相等?
【答案】 (1)20% (2)2.28mol·L-1
(3)2.48mol
【点拨】 (1)混合后溶液中KNO3的总质量为: -3的混合溶液。计算:
9
20g×14%+30g×24%=10g,溶液总质量为: 20g+30g=50g
混合后溶液中KNO3的质量分数为: w(KNO3)=10g100%=20% 50g
(2)混合后溶液中的KNO3的物质的量为: n(KNO3)=10g
-=0.099mol 101g·mol
混合后溶液的总体积为:
50gV[KNO3(aq)]-=43.5mL 1.15g·mL
=43.5×10-2L
混合后溶液中KNO3的物质的量浓度为: c(KNO3)=0.099molL-1 -=2.28mol·4.35×10L
(3)因为混合后溶液中KNO3的质量为10g,故其中的溶剂水的质量为40g,1 000g水需要KNO3的物质的量为:
10g×1 000gn(KNO3)=2.48mol 40g×101g·mol- 10
