高中化学计算题的解法归纳
【知识网络】

【典型例题评析】
例1 某体积可变的密闭容器,盛有适量的A和B的混合气体,在一定条件下发生反应:
 A+3B 2C。若维持温度和压强不变,当达到平衡时,容器体积为VL,其中C气体的体积占10%,下列推断正确的是 (全国高考题)
A+3B 2C。若维持温度和压强不变,当达到平衡时,容器体积为VL,其中C气体的体积占10%,下列推断正确的是 (全国高考题)
①原混合气体的体积为1.2VL ②原混合气体的体积为1.1VL
③反应达平衡时气体A消耗掉0.05VL ④反应达平衡时气体B消耗掉0.05VL
A.②③ B.②④ C.①③ D.①④
体积差:
例3 将硫酸钾、硫酸铝、硫酸铝钾三种盐混合溶于硫酸酸化的水中,测得c(SO42-)=0.105mol/L、c(Al3+)=0.055mol/L,溶液的pH=2.0(假设溶液中H2SO4完全电离为H+和SO42-),则c(K+)为
(上海高考题)
A.0.045mol/L B.0.035mol/L C.0.055mol/L D.0.040mol/L
电荷守恒:
例4 用惰性电极电解M(NO3)x的水溶液,当阴极上增重a g时,在阳极上同时产生bL氧气(标准状况),从而可知M的原子量为
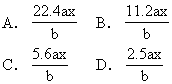
电子守恒:
铜和镁的合金4.6g完全溶于浓硝酸,若反应中硝酸被还原只产生4480mL的NO2气体和336mL的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为(上海高考题)
A.9.02g B.8.51g C.8.26g D.7.04g
例5 将1.92g铜粉与一定量浓硝酸反应,当铜粉完全作用时收集到1.12L(标准状况)。则所消耗硝酸的物质的量是 (上海高考题)
A.0.12mol B.0.11mol C.0.09mol D.0.08mol
原子守恒|:
例8 在一定条件下,将m体积NO和n体积O2同时通入倒立于水中且盛满水的容器内,充分反应后,容器内残留m/2体积的气体,该气体与空气接触后变为红棕色,则m与n的比值为(上海高考题)
方程式叠加
例9 由CO2、H2和CO组成的混合气在同温同压下与氮气的密度相同。则该混合气体中CO2、H2和CO的体积比为 (上海高考题)
十字交叉法
例10 由锌、铁、铝、镁四种金属中的两种组成的混合物10g,与足量的盐酸反应产生的氢气在标准状况下为11.2L,则混合物中一定含有的金属是(全国高考题)
A.锌 B.铁 C.铝 D.镁
例13 第ⅡA族元素R的单质及其相应氧化物的混合物12g,加足量水经完全反应后蒸干,得固体16g,试推测该元素可能为(上海高考题)
A.Mg B.Ca C.Sr D.Ba
极值法
R---->ROH
2.8/M1=(3.58-2.8)/17
M1=61
R2O---->2ROH
2.8/(2M2+16)=(3.58-2.8)/18
 例15 在一个密闭容器中,用等物质的量的A和B发生反应:A(g)+2B(g) 2C(g)。当反应达到平衡时,如果混合气体中A和B的物质的量之和与C的物质的量相等,则此时A的转化率为(全国高考题)
例15 在一个密闭容器中,用等物质的量的A和B发生反应:A(g)+2B(g) 2C(g)。当反应达到平衡时,如果混合气体中A和B的物质的量之和与C的物质的量相等,则此时A的转化率为(全国高考题)
A.40% B.50% C.60% D.70%
估算法
2012山东高考
25℃时,将a mol NH4NO3溶于水,溶液显酸性、原因是 (用离子方程式表示)。向该溶液滴加b L 氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将 (填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为 mol·L-1。(NH3·H2O的电离平衡常数取Kb=2×10-5mol·L-1)
2011山东高考
28.(14分)研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为 。利用反应6NO2+ 8NH3 7N2+12H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是 L。
7N2+12H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是 L。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 mol NO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K= 。
(1) 3NO2+H2O===2HNO3+NO 6.72
(2)-41.8 b 8/3
2010山东高考:
28.(14分)硫一碘循环分解水制氢主要涉及下列反应:
 Ⅰ SO2 + 2H2O + I2 = H2SO4 + 2HI
Ⅰ SO2 + 2H2O + I2 = H2SO4 + 2HI
Ⅱ 2HI  H2 + I2
H2 + I2
Ⅲ 2H2SO4 = 2SO2 + O2 + 2H2O
(1)分析上述反应,下列判断正确的是 。
a.反应Ⅲ易在常温下进行 b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O d.循环过程中产生1 mol O2的同时产生1 mol H2
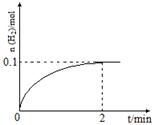
(2)一定温度下,向1 L密闭容器中加入1 mol HI(g)发生反应Ⅱ,H2物质的量随时间的变化如图所示。
0~2 min内的平均反应速率v(HI)= 。
该温度下,H2(g)+I2(g)  2HI(g)的平衡常数K= 。
2HI(g)的平衡常数K= 。
0.1 mol·L-1·min-1; 64
2009山东高考:
28.(14分)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2 (g)+3H2(g)  2NH3(g),若在恒温、恒压条件下向平恒体系中通入氩气,则平衡 移动(填“向左”“向右”或“不”);使用催化剂 反应的△H(填“增大” “减小” 或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平恒体系中通入氩气,则平衡 移动(填“向左”“向右”或“不”);使用催化剂 反应的△H(填“增大” “减小” 或“不改变”)。
(2)已知:O2 (g)=O2+(g)+e-  H1= 1175.7 kJ·mol-1
H1= 1175.7 kJ·mol-1
PtF6(g)+ e- PtF6-(g)
PtF6-(g)  H2= —771.1 kJ·mol-1
H2= —771.1 kJ·mol-1
O2+PtF6-(s)=O2+ (g)+ PtF6-(g)  H3= 482.2 kJ·mol-1
H3= 482.2 kJ·mol-1
则反应O2(g)+ PtF6(g)= O2+PtF6-(s) 的 H=_____________ kJ·mol-1。—78.2 kJ·mol-1
H=_____________ kJ·mol-1。—78.2 kJ·mol-1
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4*)=c(Cl-)。则溶液显_____________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=__________。
mol·L-1
2008山东高考:
29.(12分)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
⑴丙烷脱氢可得丙烯。
已知:C3H8(g)====CH4(g)+HC≡CH(g)+H2(g) △H1=156.6kJ·mol-1
CH3CH=CH2(g)====CH4(g)+HC≡CH(g) △H2=32.4kJ·mol-1
则相同条件下,反应C3H8(g)====CH3CH=CH2 (g)+H2(g)的△H= kJ·mol-1。124.2
⑵以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为 ;放电时,CO32-移向电池的 (填“正”或“负”)极。
⑶碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的平衡常数K1= 。(已知:10-5.60=2.5×10-6)4.2×10-7 mol·L-1
HCO3-+H+的平衡常数K1= 。(已知:10-5.60=2.5×10-6)4.2×10-7 mol·L-1
2012高考计算
4)解析:NH4 NO3溶液由于NH4+水解溶液显酸性,滴加氨水后溶液由酸性变为中性,
NO3溶液由于NH4+水解溶液显酸性,滴加氨水后溶液由酸性变为中性, 水的电离平衡向逆反应方向移动。Kb=,而c(OH-)=10-7mol/L,则c(NH4+)=200c(NH3·H2O),故n(NH4+)=200n(NH3·H2O),根据电荷守恒,n(NH4+)=n(NO3-),则溶液中n(NH4+)+n(NH3·H2O)=a+
水的电离平衡向逆反应方向移动。Kb=,而c(OH-)=10-7mol/L,则c(NH4+)=200c(NH3·H2O),故n(NH4+)=200n(NH3·H2O),根据电荷守恒,n(NH4+)=n(NO3-),则溶液中n(NH4+)+n(NH3·H2O)=a+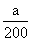 ,根据物料守恒,滴加氨水的浓度为(a+-a)mol÷bL= mol/L。
,根据物料守恒,滴加氨水的浓度为(a+-a)mol÷bL= mol/L。
第二篇:高中化学计算题总结+高考真题练习
高中化学计算题的解法归纳
【知识网络】
【易错指津】
1.根据氧化还原反应中电子守恒计算时,一是准确判断新给物质的化合价,二是如原子团中某原子个数不为1时,要乘以原子个数。
2.根据化学反应,利用气体物质的量推算容器压强时,不要将固体物质的量也计算在内。
3.对一些特殊反应,如浓H2SO4、浓HNO3、浓HCl随反应进行浓度在减少,导致反应情况改变,不能只从理论上计算。
【典型例题评析】
例1 某体积可变的密闭容器,盛有适量的A和B的混合气体,在一定条件下发生反应:
 A+3B 2C。若维持温度和压强不变,当达到平衡时,容器体积为VL,其中C气体的体积占10%,下列推断正确的是(全国高考题)
A+3B 2C。若维持温度和压强不变,当达到平衡时,容器体积为VL,其中C气体的体积占10%,下列推断正确的是(全国高考题)
①原混合气体的体积为1.2VL ②原混合气体的体积为1.1VL
③反应达平衡时气体A消耗掉0.05VL ④反应达平衡时气体B消耗掉0.05VL
A.②③ B.②④ C.①③ D.①④
例2 C8H16经多步裂化,最后完全转化为C4H8、C3H6、C3H6、C2H4、C2H6、CH4五种气体的混合物。该混合物的平均相对分子质量可能是(上海高考题)
A.28 B.30 C.38 D.40
例3 将硫酸钾、硫酸铝、硫酸铝钾三种盐混合溶于硫酸酸化的水中,测得c(SO42-)=0.105mol/L、c(Al3+)=0.055mol/L,溶液的pH=2.0(假设溶液中H2SO4完全电离为H+和SO42-),则c(K+)为(上海高考题)
A.0.045mol/L B.0.035mol/L C.0.055mol/L D.0.040mol/L
例4 某金属单质跟一定浓度的硝酸反应,假定只产生单一的还原产物,当参加反应的单质与被还原硝酸的物质的量之比为2:1时,还原产物是(全国高考题)
A.NO2 B.NO C.N2O D.N2
例5 将1.92g铜粉与一定量浓硝酸反应,当铜粉完全作用时收集到1.12L(标准状况)。则所消耗硝酸的物质的量是(上海高考题)
A.0.12mol B.0.11mol C.0.09mol D.0.08mol
例6 由NaH2PO4脱水形成聚磷酸盐Na200H2P200O601,共脱去水分子的数目为(上海高考题)
A.198个 B.199个 C.200个 D.201个
例7 工业上常用漂白粉跟酸反应放出的氯气质量对漂白粉质量的质量分数来表示漂白粉的优劣,漂白粉与酸的反应为:Ca(ClO)2+CaCl2+2H2SO4=2CaSO4+2Cl2↑+2H2O,现为了测定一瓶漂白粉的x%,进行如下实验,称取漂白粉样品2.00g,加水研磨后,转入250mL容量瓶内,用水稀释至刻度,摇匀后,取出25.0mL,加入过量的KI溶液和过量稀硫酸,静置,待漂白粉放出的氯气与KI完全反应后,用0.1mol/LNa2S2O3标准溶液滴定反应中生成的碘,反应如下2Na2S2O3+I2= Na4S4O6+2NaI,滴定时用去溶液20.0 mL。试用上述数据计算该漂白粉的X%。(全国高考题)
例8 在一定条件下,将m体积NO和n体积O2同时通入倒立于水中且盛满水的容器内,充分反应后,容器内残留m/2体积的气体,该气体与空气接触后变为红棕色,则m与n的比值为(上海高考题)
例9 由CO2、H2和CO组成的混合气在同温同压下与氮气的密度相同。则该混合气体中CO2、H2和CO的体积比为 (上海高考题)
例10 由锌、铁、铝、镁四种金属中的两种组成的混合物10g,与足量的盐酸反应产生的氢气在标准状况下为11.2L,则混合物中一定含有的金属是(全国高考题)
A.锌 B.铁 C.铝 D.镁
例11 铜和镁的合金4.6g完全溶于浓硝酸,若反应中硝酸被还原只产生4480mL的NO2气体和336mL的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为(上海高考题)
A.9.02g B.8.51g C.8.26g D.7.04g
例12 两种气态烃组成的混合气体0.1mol,完全燃烧得0.16molCO2和3.6g水,下列说法正确的是:混合气体中(上海高考题)
A.一定有甲烷 B.一定是甲烷和乙烯 C.一定没有乙烷 D.一定有乙炔
例13 第ⅡA族元素R的单质及其相应氧化物的混合物12g,加足量水经完全反应后蒸干,得固体16g,试推测该元素可能为(上海高考题)
A.Mg B.Ca C.Sr D.Ba
例14 将可能混有下列物质的硫酸铵样品13.2g,在加热条件下与过量氢氧化钠溶液反应,可收集到气体4.3L(标准状况),则该样品内不可能含有的物质是(上海高考题)
A.碳酸氢铵和硝酸铵 B.碳酸铵和氯化铵
C.氯化铵和碳酸氢铵 D.氯化铵和硝酸铵
 例15 在一个密闭容器中,用等物质的量的A和B发生反应:A(g)+2B(g) 2C(g)。当反应达到平衡时,如果混合气体中A和B的物质的量之和与C的物质的量相等,则此时A的转化率为(全国高考题)
例15 在一个密闭容器中,用等物质的量的A和B发生反应:A(g)+2B(g) 2C(g)。当反应达到平衡时,如果混合气体中A和B的物质的量之和与C的物质的量相等,则此时A的转化率为(全国高考题)
A.40% B.50% C.60% D.70%
练习巩固:
【1】某种H和CO的混合气体,其密度为相同条件下

再通入过量O2,最后容器中固体质量增加了 [ ]
A.3.2 g B.4.4 g
C.5.6 g D.6.4 g
【2】FeS2与硝酸反应产物有Fe3+和H2SO4,若反应中FeS2和HNO3物质的量之比是1∶8时,则HNO3的唯一还原产物是 [ ]
A.NO2 B.NO C.N2O D.N2O3
【3】用惰性电极电解M(NO3)x的水溶液,当阴极上增重a g时,在阳极上同时产生bL氧气(标准状况),从而可知M的原子量为 [ ]
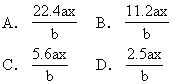
【4】 有某碱金属M及其相应氧化物的混合物共10 g,跟足量水充分反应后,小心地将溶液蒸干,得到14 g无水晶体。该碱金属M可能是 [ ]
A.锂B.钠C.钾D.铷
【5】 某烃0.1mol,与在标准状况下为20 L的氧气(过量)充分反应后,迅速将混合气体通入足量Na2O2粉末中,在一定设备中使气体完全反应,此时粉末增重15 g。经处理后得到气体14.4 L(标准状况)。该烃能使溴水褪色,试通过计算求出该烃的分子式,并写出可能的结构简式。
【6】酸雨是因为过度燃烧煤和石油,生成的硫的氧化物与氮的氧化物溶于水生成硫酸和硝酸的缘故。某次雨水的分析数据如下:
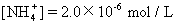
[Cl-]=6.0×10-6mol/L
[Na+]=3.0×10-6mol/L

则此次雨水的pH大约为 [ ]
A.3 B.4 C.5 D.6
【7】 加热碳酸镁和氧化镁的混合物mg,使之完全反应,得剩余物ng,则原混合物中氧化镁的质量分数为 [ ]
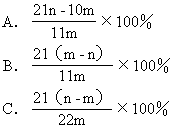
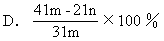
【8】 150℃时,将1L混合烃与9L氧气混合,在密闭容器内充分燃烧,当恢复至150℃,体积恒定时,容器内压强增大8%,则该混合烃的组成是 [ ]
A.甲烷与乙烷体积比是1∶4
B.丙炔与乙炔体积比是1∶4
C.乙烯与丁烷体积比是1∶4
D.乙烯与丁烯体积比是1∶4
【9】由锌、铁、铝、镁四种金属中的两种组成的混合物10 g与足量的盐酸反应产生的氢气在标准状况下为11.2 L,则混合物中一定含有的金属是 [ ]
A.锌B.铁C.铝D.镁
【10】含有杂质的乙烯2.8 g,与氢气发生加成反应时,充分反应后用去氢气0.25 g,则乙烯中所含杂质可能是 [ ]
A.乙炔 B.1,3-丁二烯
C.丙烷 D.甲烷
【11】 现有某氯化物与氯化镁的混合物,取3.8g粉末完全溶于水后,与足量的硝酸银溶液反应后得到12.4 g氯化银沉淀,则该混合物中的另一氯化物是 [ ]
A.LiCl B.KCl
C.CaCl2 D.AlCl3
【12】 有一系列α-氨基酸按如下特点排列:
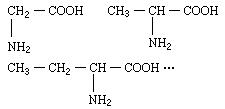
该同系列中所含碳元素的质量分数最大值接近 [ ]
A.32.0% B.46.6%
C.85.7% D.92.3%
【13】 已知自然界中铱有两种质量数分别为191和193的同位素,而铱的相对平均原子质量为192.22,这两种同位素的原子个数比应为 [ ]
A.39∶61 B.61∶39
C.1∶1 D.39∶11
【14】 一定量的乙醇在氧气不足的情况下燃烧,得到CO、CO2和水的总质量为27.6g,若其中水的质量为10.8g,则CO的质量是 [ ]
A.1.4g B.2.2g
C.4.4g D.在2.1g和4.4g之间
【15】 右图中横坐标表示完全燃烧时耗用可燃气体X(X=A、B、C)的物质的量n(X),纵坐标表示消耗O2的物质的量n(O2),A、B是两种可燃性气体,C是A和B图6-1的混合气体,则C中n(A)∶n(B)为 [ ]
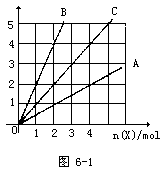
A.2∶1 B.1∶2
C.1∶1 D.任意比
【16】 在30mL量筒中充满NO2和O2的混合气体,倒立于水中使气体充分反应,最后剩余5mL气体,求原混合气中氧气的体积是多少毫升?
