 金属和金属材料
金属和金属材料
金属材料
一、金属材料的发展与利用
1、从化学成分上划分,材料可以分为金属材料、非金属材料、有机材料及复合材料等四大类。
2、金属材料包括纯金属和合金。
金属材料:纯金属(90多种);合金(几千种)
 黑色金属:通常指铁、锰、铬及它们的合金。
黑色金属:通常指铁、锰、铬及它们的合金。
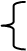 纯金属 重金属:如铜、锌、铅等
纯金属 重金属:如铜、锌、铅等
有色金属
轻金属:如钠、镁、铝等;
有色金属:通常是指除黑色金属以外的其他金属。
(1)金属材料的发展
石器时代→青铜器时代→铁器时代→铝的应用→高分子时代
(2)金属材料的应用
①最早应用的金属是铜,应用最广泛的金属是铁,公元一世纪最主要的金属是铁
②现在世界上产量最大的金属依次为铁、铝和铜
③钛被称为21世纪重要的金属
二、金属的物理性质
1、金属共同的物理性质:常温下金属都是固体(汞除外),有金属光泽,大多数金属是电和热的良导体,有延展性(又称可塑性→金属所具有的展性和延性:在外力的作用下能够变形,而且在外力停止作用以后仍能保持已经变成的形状和性质。各种金属的可塑性有差别;金属的可塑性一般是随着温度的升高而增大。),密度较大,熔沸点较高等。
2、金属的特性:
①纯铁、铝等大多数金属都呈银白色,而铜呈紫红色,金呈黄色;
②常温下,大多数金属都是固体,汞却是液体;
③各种金属的导电性、导热性、密度、熔点、硬度等差异较大。
3、金属之最
地壳中含量最多的金属元素—铝(Al) 人体中含量最多的金属元素—钙(Ca)
导电、导热性最好的金属——银(Ag) 目前世界年产量最高的金属—铁(Fe)
延展性最好的金属———金(Au) 熔点最高的金属————钨(W)
熔点最低的金属————汞(Hg) 硬度最大的金属————铬(Cr)
密度最小的金属————锂(Li) 密度最大的金属————锇(Os)
最贵的金属———— 锎kāi(Cf)
4、金属的用途:金属在生活、生产中有着非常广泛的应用,不同的用途需要选择不同的金属。
【练习】
(1) 为什么菜刀、镰刀、锤子等用铁制而不用铅制?
答:因为铁的硬度比铅大,且铅有毒。
(2) 银的导电性比铜好,为什么电线一般用铜制而不用银制?
答:银和铜的导电性相近,但银比铜贵得多,且电线用量大,经济上不划算。
(3) 为什么灯泡里的灯丝用钨制而不用锡制?如果用锡制的话,可能会出现什么情况?
答:因为钨的熔点(3410℃)高,而锡的熔点(232℃)太低。如果用锡制的话,通电时锡易熔断,减少灯泡的使用寿命,还会造成极大浪费。
(4) 为什么有的铁制品如水龙头等要镀铬?如果镀金怎么样?
答:因为铁制品会生锈,镀上一层光亮且不易生锈的铬,能起到很好的保护作用,铬的硬度大,耐磨。由于金价格昂贵,如果镀金,虽然美观但成本太高。
三、合金
1、合金:在金属中加热熔合某些金属或非金属所制得的具有金属特征的物质。
2、合金的特点
一般来说,合金比组成他们的纯金属的硬度和强度大,抗腐蚀的性能也更好.
有的合金比组成他们的纯金属的熔点低。
多种多样的合金
3、21世纪重要的金属材料——钛和钛合金
钛和钛合金被认为是21世纪的重要金属材料
①物理性质与性能:银白色、熔点高、密度小、可塑性好、易于加工、机械性能好、尤其是抗腐蚀性能非常好,
②用途:广泛用于火箭、导弹、航天飞机、船舶、化工和通信设备等。
钛合金与人体有很好的相容性,因此可用来制造人造骨骼。
4、钛镍形状记忆合金
形状记忆合金具有形状记忆效应的合金。
广泛用于人造卫星、宇宙飞船的天线、牙齿矫正、水暖系统等方面。
5、淬火和回火
淬火和回火是金属热处理中常用的两种方法.
(1)淬火:把金属工件加热到一定温度,然后浸入冷却剂(如冷水等)中急速冷却以增加硬度。例如经过淬火后的钢,其硬度和耐磨性增强,塑性和韧性却降低.
(2)回火:把淬火后的工件用较低温度加热,然后自然冷却,使其能保持一定的硬度,增加韧性。例如,淬火后的钢再经回火后,其韧性可部分恢复。
金属的化学性质
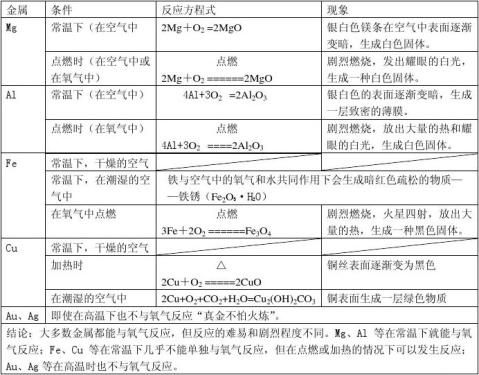
一、金属与氧气反应
常温下金属与氧气的反应
4Al+3O2=2Al2O3 现象:银白色的铝的表面逐渐变暗生成一层致密的薄膜
2Mg+O2=2MgO 现象: 银白色的镁条在空气中表面会逐渐变暗,生成白色固体
2Cu+O2≠2CuO(常温下铜与氧气不反应)
点燃的条件下金属与氧气的反应
c、在氧气中点燃铝
现象:剧烈燃烧,火星四射,放出大量热,生成一种白色固体
即使高温条件下金、铂也不与氧气反应
金属活动性:镁>铝>铁>铜>金
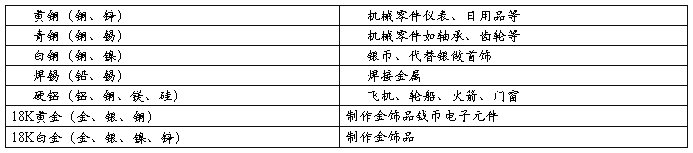
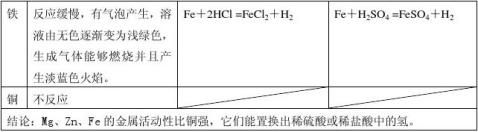
二、金属与酸反应
结论: Mg>Zn>Fe>Cu
置换反应:由一种单质与一种化合物反应,生成另一种单质与另一种化合物的反应
A+BC→AC+B
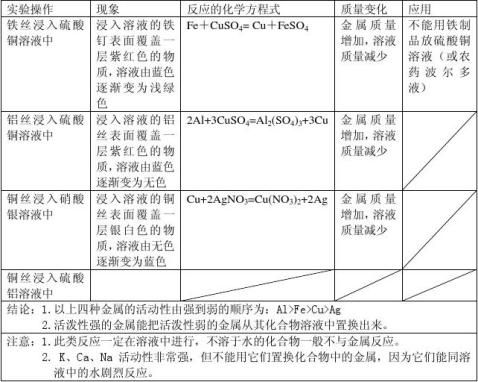
三、金属与盐溶液反应
实验1铝丝浸入硫酸铜溶液中
现象:铝丝表面覆盖一层紫红色的物质,溶液由蓝色变成无色
2Al+3CuSO4== Al2(SO4)3+3Cu
实验2铜丝浸入硝酸银溶液中
现象:铜丝表面覆盖一层银白色物质,溶液由无色逐渐变成蓝色
Cu+2AgNO3= Cu(NO3)2+2Ag
实验3把锌片放入硫酸铜溶液中
现象:锌片表面有红色物质析出。
实验4铜丝放入硫酸锌溶液中
现象:放入硫酸锌溶液中的铜丝无变化。
得出结论 金属+金属化合物→新金属化合物+新金属
铜、银、锌的活动性大小的顺序为:Zn>Cu>Ag
四、金属活动性顺序
金属活动性顺序:
K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au
 金属活动性由强逐渐减弱
金属活动性由强逐渐减弱
应用:
①在金属活动性顺序里,金属的位置越靠前,它的活动性就越强;
②在金属活动性顺序里,位于氢前面的金属能置换出盐酸、稀硫酸中的氢(不是氢原子)
③在金属活动性顺序里,位于前面的金属能把位于后面的金属从它们的化合物溶液中置换出来(K、Ca、Na除外) 。
注意:
④酸一般指盐酸和稀硫酸,若是硝酸或浓硫酸,因其具有较强的氧化性,与金反应时,一般不生成氢气,而生成水;
⑤K、Ca、Na的金属活动性非常强,与化合物溶液接触时,它们能同溶液中的水发反应,如:2Na+2H20—2NaOH+H2↑,所以把它们放到化合物溶液里,不能将金属离子换出来;
⑥反应一定在溶液中进行,不溶于水的金属的化合物一般不与金属反应,如Cu与AgCl不反应,因为AgCl不溶于水。
⑦金属 + 酸 → 盐 + H2↑
⑧金属 + 盐 → 另一金属 + 另一盐(条件:“前换后,盐可溶”)
Fe + CuSO4 == Cu + FeSO4 (“湿法冶金”原理)
 讨论1
讨论1
地壳中铝的含量远远大于金的含量,为什么人类很早就发现和使用金,铝的使用是近百年的事?
金属冶炼的早晚与金属的活动性有关和金属的冶炼难易程度也有关。
讨论2
(1)铝在常温下能与氧气反应,那么我们用的铝制餐具是怎么回事呢?
金属铝在空气中与氧气反应:4Al+3O2=2Al2O3; 形成一层致密的氧化物薄膜,从而阻止铝的进一步氧化,因而铝具有较好的抗腐蚀性。
(2)为何不宜用钢刷来擦洗铝制餐具呢?
若用钢刷擦洗铝制品,容易把氧化薄膜除掉,从而起不到保护作用。
(3)为什么铁制暖气片上要涂上一层铝粉?
铝在空气中与氧气反应,生成一层致密的氧化铝薄膜,可以阻止铝进一步被氧化。所以铝具有很好的抗腐蚀性。
金属资源的利用和保护
一、金属资源的存在形式
1、单质(少数 如:Au、Ag等)
化合物(多数 如:Fe、Cu、Al等)
2、常见的矿石:工业上把能用来提炼金属的矿物。
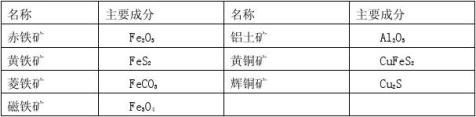
赤铁矿(Fe2O3)、黄铁矿(FeS2)、菱铁矿(FeCO3)、铝土矿(Al2O3)、黄铜矿(CuFeS2)、辉铜矿(Cu2S)
二、铁的冶炼
1、原料:焦炭、石灰石、铁矿石
2、原理:在高温下,利用焦炭与氧气反应生成的一氧化碳把铁从铁矿石中还原出来

3、主要设备:高炉
4、一氧化碳还原氧化铁的实验
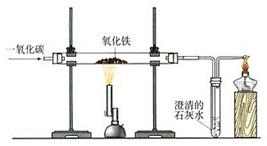 一氧化碳还原氧化铁的实验:
一氧化碳还原氧化铁的实验:
a、装置图:见右图。
b、实验主要现象:红色粉末变为黑色时,澄清的石灰水变浑浊,尾气点燃产生淡蓝色火焰。
c、实验注意事项:
①先通入一氧化碳气体,排尽装置内的空气,防止一氧化碳与空气混合加热后,发生爆炸;
②实验完毕后要继续通入一氧化碳气体,直到玻璃管冷却,防止高温下的铁与空气接触,被氧化为氧化铁。同时,实验过程中还可防止澄清石灰水被倒吸;
③尾气中含有一氧化碳,一氧化碳有毒,所以尾气要收集或点燃,直接排放会污染空气;
④若实验中没有酒精喷灯,也可用酒精灯代替,不过要在火焰上加一个金属网罩,使火力更加集中,提高温度。
三、金属资源保护
1、金属的腐蚀和防护
(1)铁制品锈蚀条件的探究:现有洁净无锈的铁钉、试管、经煮沸迅速冷却的蒸馏水、植物油、棉花和干燥剂氯化钙。试设计实验以证明铁制品锈蚀的条件。

※在水、氧气同时存在的环境中铁能锈蚀,铁锈的主要成分是Fe2O3 · xH2O
※铁锈具有疏松多孔的结构不能阻止
(2)铁的锈蚀
A、铁生锈的条件是:铁与O2、水接触(铁锈的主要成分:Fe2O3·XH2O)
(铜生铜绿的条件:铜与O2、水、CO2接触。铜绿的化学式:Cu2(OH)2CO3)
B、防止铁制品生锈的措施:
①保持铁制品表面的清洁、干燥
②表面涂保护膜:如涂油、刷漆、电镀、烤蓝等
③制成不锈钢
C、铁锈很疏松,不能阻碍里层的铁继续与氧气、水蒸气反应,因此铁制品可以全部被锈蚀。因而铁锈应及时除去。
D、而铝与氧气反应生成致密的氧化铝薄膜,从而阻止铝进一步氧化,因此,铝具有很好的抗腐蚀性能。
里面的铁继续与氧气和水发生发应直到铁完全锈蚀。
(3)铁制品的防护措施
防止铁生锈的原理--就是破坏铁生锈的条件:①隔绝空气 ②隔绝水
防止铁制品生锈的具体方法为:
※保持铁制品表面干燥和洁净
※在铁制品表面涂一层保护膜如:刷油漆、涂油、镀上一层耐磨、耐腐蚀的金属铬、高温灼烧金属,进行“烤蓝”处理等
※制成合金钢,如不锈钢
2、金属资源保护
※防止金属腐蚀
※回收和利用废旧金属
废弃金属的回收的意义:可节约金属资源;由于金属冶炼需在高温下进行,回收废弃金属并再利用可节约能源;降低金属制品的生产成本;方便人们得到物美价廉的金属制品;可减少金属对环境的污染。
※合理开采矿物
※寻找金属的代用品
第二篇:金属和金属材料知识点总结
第八单元 金属和金属材料
考点1 金属材料
1. 金属材料包括纯金属和合金两类。金属属于金属材料,但金属材料不一定是纯金属,也可能是合金。
2. 金属制品是由金属材料制成的,铁、铜、铝及其合金是人类使用最多的金属材料。 考点2 金属材料的发展史
根据历史的学习,我们可以知道金属材料的发展过程。商朝,人们开始使用青铜器;春秋时期开始冶铁;战国时期开始炼钢;铜和铁一直是人类广泛应用的金属材料。在100多年前,又开始了铝的使用,因铝具有密度小和抗腐蚀等许多优良性能,铝的产量已超过了铜,位于第二位。
考点3 金属的物理性质
1.共性:大多数金属都具有金属光泽,密度和硬度较大,熔沸点较高,具有良好的延展性和导电、导热性,在室温下除汞为液体,其余金属均为固体。
2.一些金属的特性:铁、铝等大多数金属都呈银白色,铜呈紫红色,金呈黄色;常温下大多数金属都是固体,汞却是液体;各种金属的导电性、导热性、密度、熔点、硬度等差异较大;银的导电性和导热性最好,锇的密度最大,锂的密度最小,钨的熔点最高,汞的熔点最低,铬的硬度最大。
考点4 物质的性质与物质的用途之间的关系
1.物质的性质决定物质的用途,而物质的用途又反映出物质的性质。
2.物质的性质很大程度上决定了物质的用途。但这不是唯一的决定因素,
在考虑物质的用途时,还需要考虑价格、资源、是否美观、使用是否便利,以及废料是否易于回收和对环紧的影响等多种因素。
考点5 合金
1. 合金:在金属中加热熔合某些金属和非金属,形成具有金属特性的物质。
注意:(1)合金是金属与金属或金属与非金属的混合物。
(2)合金的很多性能与组成它们的纯金属不同,使合金更容易适于不同的用途。
(3)日常使用的金属材料,大多数为合金。
(4)金属在熔合了其它金属和非金属后,不仅组成上发生了变化,其内部组成结构也发生了改
变,从而引起性质的变化。
2.合金的形成条件:其中任一金属的熔点不能高于另一金属的沸点(当两种金属形成合金时)。
3.合金与组成它们的纯金属性质比较。
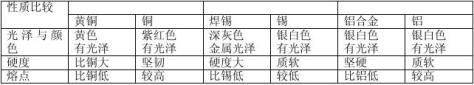
4.几种常见合金
(1)铁合金:主要包括生铁和钢,它们的区别是含碳量不同,生铁含碳量2%-4.3%,钢的含碳量为0.03%—2%。钢比生铁具有更多的优良性能,易于加工,用途更为广泛。
(2)铝合金:铝中加入镁、铜、锌等金属形成合金。广泛应用于制造飞机、舰艇和载重汽车等,可增加它们的载重量以及提高运行速度,并具有抗海水腐蚀、避磁性等特点。
(3)铜合金:黄铜:铜、锌的合金; 青铜:铜、锡的合金; 白铜:铜、镍的合金。
(4)钛和钛合金:被认为是21世纪的重要金属材料。
性质:优异的耐腐蚀性,对海水、空气和若干腐蚀介质都稳定,可塑性好,强度大,有密度小,
又称亲生物金属。
用途:喷气式发动机、飞机机身、人造卫星外壳、火箭壳体、医学补形、造纸、人造骨、海水
淡化设备、海轮、舰艇的外壳等。
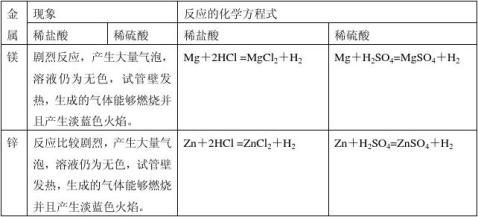
考点7 金属与酸的反应 第 2 页 共 5 页
考点9 置换反应
置换反应:由一种单质与一种化合物反应,生成另一种单质与化合物的反应叫做置换反应。 考点10 金属活动性顺序
人们通过大量的实验验证得到常见金属的活动性顺序:
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
金属活动性:由强到弱
应用:
1. 在金属活动性顺序里,金属的位置越靠前,它的活动性越强。
2. 在金属活动性顺序里,位于氢前面的金属能置换出盐酸、稀硫酸中的氢。
3. 在金属活动性顺序里,位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来(K、
Ca、Na除外)。
考点11 矿石
1. 金属资源的存在方式:地球上的金属资源广泛存在于地壳和海洋中,大多数金属化合物性质较活
泼,所以它们以化合物的形式存在;只有少数金属化学性质很不活泼,如金等以单质形式存在。
2. 矿石:工业上把能提炼金属的矿物叫矿石。
考点12 钢铁生产的发展
钢铁的生产和使用是人类文明和社会进步的一个重要标志。在古代和中世纪的一段很长的历史时期内,我国的钢铁生产技术一直处于世界领先地位。早在春秋战国时期,我国劳动人们就开始了生产和使用铁器;从公元1世纪起,铁便成了我国最主要的金属;新中国成立后,我国的钢铁工业得到了飞速发展,19xx年我国的钢铁产量只有15万吨,居世界第26位,19xx年,我国的钢产量超过1亿吨,跃居世界首位。
考点13 一氧化碳还原氧化铁
(1)仪器:铁架台(2个)、硬质玻璃管、单孔橡皮赛(2个)、酒精灯、试管、酒精喷灯、双孔橡皮赛、导气管。
(2)药品:氧化铁粉末、澄清石灰水、一氧化碳气体
(3

(4)步骤:①检验装置的气密性;②装入药品并固定;③向玻璃管内通入一氧化碳气体;④给氧化铁加
热;⑤停止加热;⑥停止通入一氧化碳。
(5)现象:红色粉末逐渐变成黑色,澄清石灰水变浑浊,尾气燃烧产生蓝色火焰。
高温 点燃
(6)化学方程式:3CO+Fe2O3====2Fe+3CO2 2CO+O2=====2CO2
Ca(OH)2+CO2=CaCO3↓+H2O
(7)注意事项:与CO还原氧化铜的实验操作顺序一样,即先通入CO再加热,实验完毕,停止加热,继
续通入CO至试管冷却。
(8)尾气处理:因CO有毒,不能随意排放在空气中,处理的原则是将CO燃烧掉转化为无毒的CO2或收集
备用。
考点14 工业炼铁
(1)原理:在高温下,利用焦炭与氧气反应生成的还原剂(CO)将铁从铁矿石里还原出来。
(2)原料:铁矿石、焦炭、石灰石和空气
(3)主要设备:高炉
(4)冶炼过程中发生的化学反应:
点燃 点燃 高温
C+O2====CO2 2CO+O2=====2CO2 3CO+Fe2O3====2Fe+3CO2
高温 高温
CaCO3=====CaO+CO2↑ CaO+SiO2=====CaSiO3
注意:石灰石的主要作用是将矿石中的二氧化硅转变为炉渣。
考点15 含杂质化学反应的计算
1. 纯净物与含杂质物质的换算关系:
X纯物质质量分数


÷纯物质质量分数
纯净物质量
物质纯度×100% = 1-杂质的质量分数
混合物质量
2.含杂质物质的化学方程式的计算步骤:
(1)将含杂质的物质质量换算成纯净物的质量。
(2)将纯净物质质量代入化学方程式进行计算。
(3)将计算得到的纯净物质量换算成含杂质物质的质量。
考点16 金属的锈蚀和保护
1.铁的锈蚀条件:有水和氧气
2.防锈的方法:保持干燥;隔绝氧气
考点17 保护金属资源
保护金属资源的有效途径:
1. 防止金属的腐蚀
2. 金属的回收利用
3. 有计划合理的开采矿物
4. 寻找金属的代用品
