必修一第四章知识点总结
1、二氧化硅和二氧化碳比较

硅的化合物的转化

 H2SiO3 Na2SiO3
H2SiO3 Na2SiO3
 SiO2
SiO2
H2Si03+2NaOH==Na2SiO3+2H2O
 Na2SiO3+2HCl==2NaCl+H2SiO3↓
Na2SiO3+2HCl==2NaCl+H2SiO3↓
SiO2+2NaOH == Na2SiO3+H2O
SiO2+Na2CO3 Na2SiO3+CO2↑
Na2SiO3+CO2↑
2、液氯、新制的氯水和久置的氯水比较
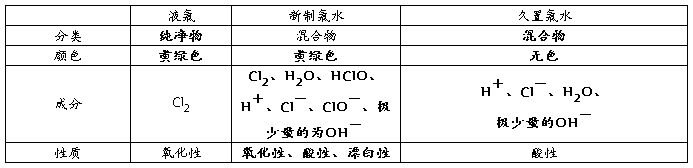
新制氯水变质的原理:H2O+Cl2==HCl+HClO
2HClO==2HCl+O2↑
3、氯气的性质

4、二氧化硫的性质

5、浓硫酸和浓硝酸的性质
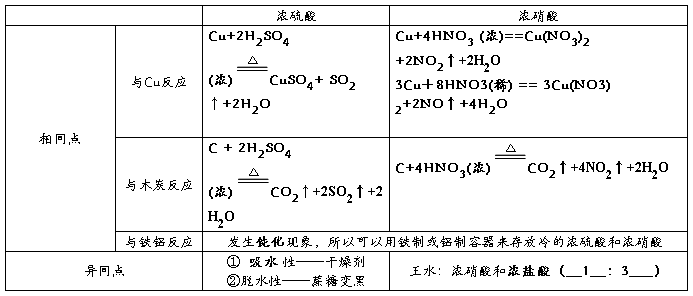
6强酸制弱酸
强酸+弱酸盐===弱酸+强酸盐
CaCO3+2HCl==CaCl2+H2O+CO2↑ CaCO3+2H+==Ca2+++H2O+CO2↑
Na2SiO3+2HCl==2NaCl+H2SiO3↓ SiO32-+2H+==H2SiO3↓
Ca(ClO)2+2HCl== CaCl2+2HClO 2ClO-+2H+==2HClO
应用
(1) Na2SiO3溶液敞口放置在空气中变质
Na2SiO3+H2O+CO2==Na2CO3+H2SiO3↓ SiO32-+H2O+CO2==CO32-+H2SiO3↓
Na2SiO3+2H2O+2CO2==2NaHCO3+H2SiO3↓ SiO32-+2H2O+2CO2==HCO3-+H2SiO3↓
(2) 漂白粉在空气中变质
Ca(ClO)2+H2O+CO2== CaCO3↓+2HClO Ca2++2ClO-+H2O+CO2== CaCO3↓+2HClO
(3) 实验室制SO2
Na2SO3+2H2SO4==Na2SO4+H2O+SO2↑ SO32-+2H+==H2O+SO2↑
(3) 实验室制H2S
FeS+H2SO4==FeSO4+H2S↑ FeS+2H+==Fe2++H2S↑
(4)除杂质
CO2中混有SO2
SO2+2NaHCO3=Na2SO3+H2O+2CO2↑
CO2中混有HCl
HCl+NaHCO3=NaCl+H2O+CO2↑
SO2中混有HCl
HCl+NaHSO3= NaCl+H2O+SO2↑
7 、氨气、氨水与铵盐的性质
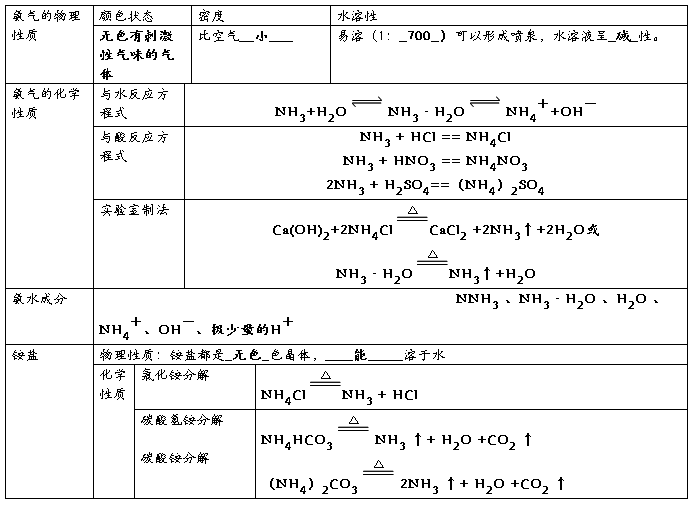
NH4+的检验
药品中加NaOH溶液然后加热,产生的气体使红色石蕊试纸变蓝,说明产生了NH3
进而说明样品中有NH4+
第二篇:高中化学必修1化学方程式总结
高中化学必修1化学方程式总结
1、钠及其化合物的转化关系

①Na2O+2HCl=2NaCl+H2O ②2Na+2HCl=2NaCl+H2↑
Na2O+2H+=2Na++H2O 2Na+2H+=2Na++H2↑
③2Na2O2+4HCl=4NaCl+O2↑+2H2O ④4Na+O2=2Na2O
 2Na2O2+4H+=4Na++O2↑+2H2O ※⑥2Na+2H2O=2NaOH+H2↑
2Na2O2+4H+=4Na++O2↑+2H2O ※⑥2Na+2H2O=2NaOH+H2↑
※⑤2Na+O2 Na2O2 2Na+2H2O=2Na++2OH-+H2↑
Na2O2 2Na+2H2O=2Na++2OH-+H2↑
⑦Na2O+H2O=2NaOH ※⑧2Na2O2+2H2O=4NaOH+O2↑
Na2O+H2O=2Na++2OH- 2Na2O2+2H2O=4Na++4OH-+O2↑
⑨Na2O+CO2=Na2CO3 ※⑩2Na2O2+2CO2=2Na2CO3+O2
⑾2NaOH+CO2=Na2CO3+H2O ⑿Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
2OH-+CO2=CO32-+H2O CO32-+Ca2+=CaCO3↓
⒀NaOH+CO2=NaHCO3 ※⒁Na2CO3+H2O+CO2=2NaHCO3
OH-+CO2=HCO3- CO32-+H2O+CO2=2HCO3-
※⒂2NaHCO3 Na2CO3+H2O+CO2↑或 ※NaHCO3+NaOH=Na2CO3+H2O
Na2CO3+H2O+CO2↑或 ※NaHCO3+NaOH=Na2CO3+H2O
HCO3-+OH-=CO32-+H2O
⒃Na2CO3+2HCl=2NaCl+H2O+CO2↑ ⒄NaHCO3+HCl=NaCl+H2O+CO2↑
CO32-+2H+=H2O+CO2↑ HCO3-+H+=H2O+CO2↑
补充:①石灰水中加入少量NaHCO3 : Ca(OH)2+NaHCO3=CaCO3↓+NaOH+H2O
Ca2++OH-+HCO3-=CaCO3↓+H2O
②石灰水中加入过量NaHCO3 : Ca(OH)2+2NaHCO3=CaCO3↓+Na2CO3+2H2O
Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O
※4Na2O2+4FeCl2+6H2O=8NaCl+4Fe(OH)3↓+O2↑
2、铝及其化合物的转化关系
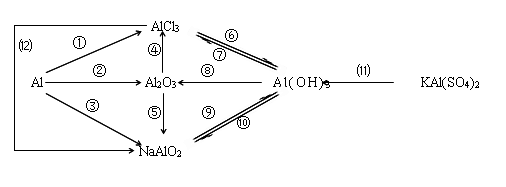
2Al+6HCl=2AlCl3+3H2↑ ②4Al+3O2 2Al2O3
2Al2O3
2Al+6H+=2Al3++3H2↑ Fe2O3+2Al 2Fe+ Al2O3
2Fe+ Al2O3
※③2Al+2NaOH+2H2O=2NaAlO2+3H2↑ ④Al2O3+6HCl=2AlCl3+3H2O
2Al+2OH-+2H2O=2AlO2-+3H2↑ Al2O3+6H+=2Al3++3H2O
※⑤Al2O3+2NaOH=2NaAlO2+H2O ⑥AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl
Al2O3+2OH-=2AlO2-+H2O Al3++3NH3·H2O = Al(OH)3↓+3NH4+
⑦Al(OH)3+3HCl=AlCl3+3H2O ⑧2Al(OH)3 Al2O3+3H2O
Al2O3+3H2O
Al(OH)3+3H+=Al3++3H2O
☆⑨NaAlO2+HCl+H2O =Al(OH)3↓+NaCl或NaAlO2+2H2O+CO2=Al(OH)3↓+NaHCO3
AlO2-+H++H2O=Al(OH)3↓ AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-
※⑩Al(OH)3+NaOH = NaAlO2+2H2O ☆⑾Al3++3H2O Al(OH)3胶体+3H+
Al(OH)3胶体+3H+
Al(OH)3+OH-= AlO2-+2H2O 明矾净水
⑿AlCl3+4NaOH = NaAlO2+3NaCl+2H2O Al3++4OH-= AlO2-+2H2O
3AlO2-+Al3++6H2O=4Al(OH)3↓
3、铁及其化合物的转化关系

 ①Fe3O4+4CO
①Fe3O4+4CO 3Fe+4CO2 ※② 3Fe+4H2O(g)
3Fe+4CO2 ※② 3Fe+4H2O(g) Fe3O4+4H2
Fe3O4+4H2
 ③ Fe+2HCl=FeCl2+H2↑ 或3Fe+2O2
③ Fe+2HCl=FeCl2+H2↑ 或3Fe+2O2 Fe3O4
Fe3O4
Fe+2H+=Fe2++H2↑ ④2Fe+3Cl2 2FeCl3
2FeCl3
※⑤2FeCl2+Cl2 = 2FeCl3 ※⑥Fe+2FeCl3 = 3FeCl2
2Fe2++Cl2 = 2Fe3++2Cl- Fe+2Fe3+= 3Fe2+
⑦FeCl2+2NaOH = Fe(OH)2↓+2NaCl ⑧Fe(OH)2+2HCl = FeCl2+2H2O
Fe2++2OH-= Fe(OH)2↓ Fe(OH)2+2H+= Fe2++2H2O
※⑨4Fe(OH)2+O2+2H2O = 4Fe(OH)3 ⑩FeCl3+3NaOH = Fe(OH)3↓+3NaCl
白色沉淀迅速变成灰绿色,最后变成红褐色 Fe3++3OH-= Fe(OH)3↓
⑾Fe(OH)3+3HCl = FeCl3+3H2O Fe3++3H2O Fe(OH)3胶体+3H+(净水)
Fe(OH)3胶体+3H+(净水)
Fe(OH)3+3H+= Fe3++3H2O ⑿2Fe(OH)3 Fe2O3+3H2O
Fe2O3+3H2O
⒀Fe2O3+6HCl = 2FeCl3+3H2O ※⒁FeCl3+3KSCN = Fe(SCN)3+3KCl
Fe2O3+6H+= 2Fe3++3H2O Fe3++3SCN-= Fe(SCN)3
4、硅及其化合物的转化关系
 ①Si+O2
①Si+O2 SiO2
SiO2
②SiO2+2C Si+2CO↑
Si+2CO↑
※③SiO2+4HF = SiF4↑+2H2O(刻蚀玻璃)
④Si+4HF = SiF4↑+2H2↑
 ⑤SiO2+CaO
⑤SiO2+CaO CaSiO3
CaSiO3
※ ⑥SiO2+2NaOH = Na2SiO3+H2O SiO2+CaCO3
⑥SiO2+2NaOH = Na2SiO3+H2O SiO2+CaCO3 CaSiO3+CO2↑
CaSiO3+CO2↑
SiO2+2OH-= SiO32-+H2O ※⑦Na2SiO3+2HCl = H2SiO3↓+2NaCl
 SiO2+Na2CO3
SiO2+Na2CO3 Na2SiO3+CO2↑ SiO32-+2H+= H2SiO3↓
Na2SiO3+CO2↑ SiO32-+2H+= H2SiO3↓
※⑦Na2SiO3+H2O+CO2=H2SiO3↓+Na2CO3或Na2SiO3+2H2O+2CO2=H2SiO3↓+2NaHCO3
SiO32-+H2O+CO2=H2SiO3↓+CO32-或SiO32-+2H2O+2CO2=H2SiO3↓+2HCO3-
⑧H2SiO3+2NaOH = Na2SiO3+2H2O ⑨H2SiO3 H2O+SiO2
H2O+SiO2
H2SiO3+2OH-= SiO32-+2H2O
5、氯及其化合物的转化关系
 ①2Fe+3Cl2
①2Fe+3Cl2 2FeCl3
2FeCl3
②Cu+Cl2 CuCl2
CuCl2
③2FeCl3+Cu = 2FeCl2+CuCl2
2Fe3++Cu = 2Fe2++Cu2+
 ④H2+Cl2 2HCl
④H2+Cl2 2HCl
※⑤MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
 MnO2+4H++2Cl-
MnO2+4H++2Cl- Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
 ※⑥Cl2+H2O = HCl+HClO ※⑦2HClO 2HCl+O2↑
※⑥Cl2+H2O = HCl+HClO ※⑦2HClO 2HCl+O2↑
Cl2+H2O = H++Cl-+HClO 2HClO 2H++2Cl-+O2↑
※⑧Cl2+2NaOH = NaCl+NaClO+H2O ※⑨2Cl2+2Ca(OH)2 = CaCl2+Ca(ClO)2+2H2O
Cl2+2OH-= Cl-+ClO-+H2O 工业制漂白粉
※⑩Ca(ClO)2+H2O+CO2 = CaCO3↓+2HClO或Ca(ClO)2+2HCl = CaCl2+2HClO
Ca2++2ClO-+H2O+CO2= CaCO3↓+2HClO或ClO-+H+= HClO
漂白粉的漂白原理
向漂白粉溶液中通入过量的CO2:Ca(ClO)2+2H2O+2CO2 = Ca(HCO3)2+2HClO
ClO-+H2O+CO2 = HCO3-+HClO
6、硫及其化合物的转化关系
 ①S+O2
①S+O2 SO2
SO2
②2H2S+SO2=3S+2H2O
※③SO2+O2 2SO3
2SO3
④SO3+H2O = H2SO4
 ⑤SO2+CaO
⑤SO2+CaO CaSO3 或 SO2+Ca(OH)2 = CaSO3↓+H2O
CaSO3 或 SO2+Ca(OH)2 = CaSO3↓+H2O
 ⑥SO3+CaO = CaSO4 SO2+Ca2++2OH-=CaSO3↓+H2O
⑥SO3+CaO = CaSO4 SO2+Ca2++2OH-=CaSO3↓+H2O
SO3+Ca(OH)2 = CaSO4+H2O ⑦2CaSO3+O2 2CaSO4
2CaSO4
※⑧SO2+Cl2+2H2O = H2SO4+2HCl ※⑨Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
SO2+Cl2+2H2O = 4H++SO42-+2Cl- Cu+2H2SO4(浓) Cu2++SO42-+SO2↑+2H2O
Cu2++SO42-+SO2↑+2H2O
※⑩C+2H2SO4(浓)  CO2↑+2SO2↑+2H2O ( 11)3S+6NaOH=Na2SO3+2Na2S+3H2O
CO2↑+2SO2↑+2H2O ( 11)3S+6NaOH=Na2SO3+2Na2S+3H2O
7、氮及其化合物的转化关系

 ※①N2+O2 2NO
※①N2+O2 2NO
※②2NO+O2 = 2NO2
※③3NO2+H2O = 2HNO3+NO
3NO2+H2O =2H++2NO3-+NO
以上三个反应为“雷雨发庄稼”原理
扩展反应有:4NO2+O2+2H2O = 4HNO3
4NO+3O2+2H2O = 4HNO3
※④Cu+4HNO3(浓) = Cu(NO3)2+2NO2↑+2H2O 上面两个反应主要用于气体溶于水时的计算

 Cu+4H++2NO3-=Cu2++2NO2↑+2H2O 或 4HNO3 4NO2↑+ O2↑+ 2H2O
Cu+4H++2NO3-=Cu2++2NO2↑+2H2O 或 4HNO3 4NO2↑+ O2↑+ 2H2O
C+4HNO3(浓) CO2↑+2NO2↑+2H2O 浓硝酸见光易变黄的原因
CO2↑+2NO2↑+2H2O 浓硝酸见光易变黄的原因
※⑤3Cu+8HNO3(稀) = 3Cu(NO3)2+2NO↑+4H2O ⑥N2+3H2 2NH3
2NH3
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O 合成氨反应是人工固氮的主要途径
⑦NH3+HCl = NH4Cl ⑧NH4Cl  NH3↑+HCl↑
NH3↑+HCl↑
NH3+H+ = NH4+(水溶液中) 补充:NH4HCO3 NH3↑+H2O+CO2↑
NH3↑+H2O+CO2↑
氨气与酸均能反应生成铵盐,且与挥发性酸 铵盐受热都易分解,但并不是所有的铵盐
(如浓HCl、浓HNO3)相遇时空气中有白烟 都分解出氨气,如NH4NO3、(NH4)2SO4
※⑧NH4Cl+NaOH  NaCl+NH3↑+H2O NH4++OH-
NaCl+NH3↑+H2O NH4++OH- NH3↑+H2O
NH3↑+H2O
所有的铵盐都能与碱作用放出氨气,可利用此反应鉴别铵离子。
※⑧⑶2NH4Cl+2Ca(OH)2 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
实验室制氨气,此反应为固体反应,不能写成离子方程式。
☆⑨4NH3+5O2 4NO+6H2O 氨的催化氧化反应,工业制硝酸的第一步。
4NO+6H2O 氨的催化氧化反应,工业制硝酸的第一步。
N2+3Mg= Mg3 N2 Mg3 N2 +6H2O=3 Mg(OH)2↓ +2NH3↑
注:带“※”的反应为重要反应,必须熟记;带“☆”的反应只需了解。
