高中化学选修3第一章测试
(满分:100分 考试时间:100分钟)
一、选择题。(在每小题给出的选项中,只有一项符合题目要求的,每题2分,共50分)
1、下列微粒:①质子②中子③电子,在所有原子中不一定含有的微粒是( )
A.①②③ B. 仅有② C.①和③ D.①和②
2、某元素原子的核外有四个能层,最外能层有1个电子,该原子核内的质子数不可能为( )
A. 24 B. 18 C. 19 D. 29
3、下列四个能级中,能量最高,电子最后填充的是( )
A. 3s B. 3p C. 3d D. 4s
4、下列说法中正确的是( )
A. 因为p轨道是“8”字形的,所以p的电子走“8”字形
B. K能级有3S,3P,3d,3f四个轨道
C. 氢原子只有一个电子,故氢原子只有一个轨道
D. 以上说法均不正确
5、下列原子中未成对电子最多的是( )
A. C B. O C. N D. Cl
6、下面是某些元素的最外层电子排布,各组指定的元素,不能形成AB2型化合物的是( )
A. 2S22P2和2S22P4 B. 3S23P4和2S22P4 C. 3s2和2s22p5 D.3s1和3s23p4
7、同主族两种元素原子的核外电子数的差值可能是( )
A. 6 B. 12 C. 26 D. 30
8、已知R为ⅡA族元素,L为ⅢA族元素,它们的原子序数分别为m和n,且R、L为同一周期元素,下列关系式错误的是( )
A. n=m+1 B. n=m+10 C. n=m+11 D. n=m+25
9、下列化合物中阳离子半径与阴离子半径比值最小的是( )
A. NaF B. LiI C. MgCl2 D. KBr
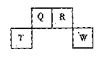
10、已知An+,B(n+1)+,Cn-,D(n+1)-具有相同的电子层结构,则原子半径由大到小的顺序为( )
A. C>D>B>A B. A>B>C>D C. D>C>A>B D. A>B>D>C
11、在前三周期的元素中,原子最外层不成对电子数和它的能层数相等的元素共有( )
A. 6种 B. 5种 C. 4种 D. 3种
12、A、B属于短周期中不同主族的元素,A、B原子最外层电子中,成对电子和未成对电子占据的轨道数相等,若A元素的原子序数为a,则B元素的原子序数为( )
A. a-8 B. a-5 C. a+6 D. a+4
13、按照原子核外电子排布规律,各电子层最多容纳的电子数为2n2(n为电子层数,其中,最外层电子数不超过8个,次外层不超过18个),1999年已发现了核电荷数为118的元素,其原子核外电子层排布是( )
A. 2,8,18,32,32,18,8 B. 2,8,18,32,50,8 C. 2,8,18,32,18,8 D. 2,8,18,32,50,18,8
14、碘跟氧可形成多种化合物。其中一种称为碘酸碘,在该化合物中,碘元素呈+3和+5两种价态,这种化合物的化学式是( )
A. I2O3 B. I2O4 C. I4O7 D. I4O9
15、已知短周期元素的离子aA2+,bB+,cC3-,dD-都具有相同的电子层结构,下列叙述正确的是( )
A. 原子半径A>B>C>D B. 原子序数d>c>b>a
C. 离子半径C3->D->B+>A2+ D. 单质还原性A>B>D>C
16、下列叙述中,A金属的活泼性肯定比B金属强的是( )
A. A原子的最外层电子数比B原子的最外层电子数少
B. A的氢氧化物为两性化合物,B的氢氧化物为弱碱
C. 1molA从酸中置换出H+生成的H2比1molB从酸中置换出H+生成的H2多
D. A元素的电负性比B元素的电负性小
根据下列5种元素的电离能数据(单位:kJ.mol-1)回答17和18题

17、它们的氯化物的化学式,最可能正确的是( )
A. QCl2 B. RCl C. SCl3 D. TCl
18、利用表中的数据判断,V元素最有可能是下列元素中的( )
A. H B. Li C. Na D. K
19、X、Y、Z是周期表中相邻的三种短周期元素,X和Y同周期,Y和Z周主族,三种上元素原子的最外层电子数之和为17,核内质子数之和为31,则X、Y、Z是( )
A. Mg、Al、Si B. Li、Be、Mg C. P、S、O D. N、O、S
20、X、Y、Z三种元素的原子,其最外层电子排布分别为nS1、3S23P1和2S22P4,由这三种元素组成的化合物的化学式可能为( )
A. XYZ2 B. X2YZ3 C. X2YZ2 D. XYZ3
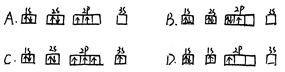 21、下列电子排布图(每一个小方框表示一个原子轨道)所表示元素的原子中,其能量处于最低状态的是( )
21、下列电子排布图(每一个小方框表示一个原子轨道)所表示元素的原子中,其能量处于最低状态的是( )
22、下列有关电负性的说法中正确的是( )
A. 主族元素的电负性越大,元素原子的第一电离能一定越大
B. 在元素周期表中,元素电负性从左到右越来越小
C. 金属元素的电负性一定小于非金属元素的电负性
D. 在形成化合物时,电负性越小的元素越容易显正价
设X、Y、Z代表三种元素,已知:①x+和Y-两种离子具有相同的电子层结构;②Z元素原子核内质子数比Y元素内质子数少9个;③Y和Z两种元素可以形成四核42个电子的负一价阴离子,据此回答23-24题
23、由X、Y、Z三种元素所形成的含68个电子的盐类化合物的化学式是( )
A. KClO4 B. NaClO4 C.KClO3 D.NaClO3
24、Y元素的最高价氧化物的水化物呈( )
A. 碱性 B. 酸性 C. 中性 D. 两性
25、已知X、Y为短周期元素,可形成原子数比为1:3的化合物,若Y的原子序数为m,则x的原子序数为:①m+4;②m-4;③m+8;④m-2;⑤m+6;⑥m+5其中正确的是( )
A.②④⑤⑥ B.①②④⑤⑥ C.①②③④⑤ D. 全部
二、非选择题。(50分)
26、(7分)有A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20,其中A为非金属,A和Z同一族,它们原子的最外层电子排布式为nS1,B和D同一族,它们原子最外层的P能级电子数是S能级的2倍,C元素原子最外层电子数等于D元素原子最外层电子数的1/2。
(1)A是 ,B是 ,C是 ,D是 ,E是 。
(2)写出C元素基态原子的电子排布式 。
(3)用电子排布图表示D元素原子的最外层电子排布 。
27、(7分)材料:制冷剂是一种易能压缩、液化的气体,液化后在管内循环,蒸发时吸收热量,使环境温度降低,达到制冷目的,人们曾采用过乙醚,NH3,CH3Cl等做制冷剂,但它们不是有毒,就是易燃,于是科学家根据元素性质的递变规律来开发新的制冷剂。
问题:(1)已知第三周期氢化物的易燃性顺序为:SiH4>PH3>H2S>HCl,判断第二周期CH4、NH3、H2O、HF的易燃性顺序 > > H2O>HF。
(2)化合物的毒性:PH3>NH3;CCl4>CF4,则下列化合物毒性顺序为H2S H2O;
CS2 CO2(均填“>”,“<”或“=”)。于是科学家们开始把注意力集中在F、Cl的化合物上。
(3)已知CCl4的沸点为76.89℃,CF4的沸点为-128.9℃,新的制冷剂沸点应介于其间,经过较长时间复试验,一种新的制冷剂氟利昂CF2Cl2终于诞生了,其他类似的还可以是 。
(4)科学经过研究发现这种制冷剂造成了当今的某一环境问题是 ,但求助于周期表中元素及其他合物的 (填字母)变化趋势来开发制冷剂的科学思维方法是值得借鉴的。①毒性;②沸点;③易燃性;④水溶性;⑤颜色
A.①②③ B.②④⑤ C.②③④ D.①②③⑤
28、(10分)X、Y、Z、Q、E五种元素中,X原子核外的M层只有两对成对电子,Y原子的核外L层电子数是K层的两倍,Z是地壳中含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大,请回答下列问题:
(1)X、Y的元素符号分别是 、 。
(2)XZ2与YZ2的分子式分别为 和 ,在相同条件下,两者在水中溶解度较大的是 (写分子式)。
(3)Q的元素符号是 ,它位于第 周期,它的核外电子排布式为 ,在形成化合物时它最高的化合价为 。
(4)E的单质与水反应的化学方程式为 。
29、(7分)A、B、C、D、E代表5种元素,请完成下列问题
(1)A元素的基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为 ;该元素的第一电离能比后面一号元素大的原因是 。
(2)B元素的负一价离子的电子层结构与氩相同,C元素的负一价离子的电子层结构与氙相同,B、C形成的化合物的化学式为 。
(3)D元素的正三价离子的 3d轨道为半充满状态,D元素的符号为 。在同期表中位于 ,其基态原子的电子排布式为 。
(4)E元素基态原子的M层全充满,N层没有成对电子,只有1个未成对电子,其单质在一定条件下能与硫反应,试写出该方程式 。
30、(9分)有A、B、C三种元素,已知5.75gA单质跟盐酸完全反应,在标准下可产生2.8LH2和0.25molACln;B的气态氢化物分子为H2B,其相对分子质量与B的最高价氧化物的水化物的相对分子质量之比为1:2.88,B核内质子数与中子数相等;C和B可形成液态化合物CB2,并能溶解B单质,试回答下列问题:
(1)A、B、C名称分别为 、 、 ,A离子的结构示意图为 ,B在周期表中的位置为 ,CB2的分子式为 。
(2)用电子式表示A与B形成化合物的过程 。
(3)工业上制取B的最高价氧化物的水化物的原料的主要成分为 ,写出锻烧此原料的化学方程式 。
31、(10分)X、Y、Z、L、M五种元素的原子序数依次增大,X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量较高的金属元素,回答下列问题
(1)L的元素符号为 ;M在元素周期表中的位置为 ;五种元素的原子半径从大到小的顺序为 (用元素符号表示)
(2)Z、X两元素原子数目比1:3和2:4构成分子A和B,A的电子式为 ,B的结构式为 。
(3)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为 ,其最高价氧化物对应的水化物的化学式为 。该族2-5周期元素单质分别与H2反应生成1mol气态氧化物的反应热如下,表示生成1mol硒化氢的反应热是 (填字母)。
a.+99.7mol/L b. +29.7mol/L c. -20.6mol/L d. -241.8KJ/mol
(4)Z的最简单气态氢化物甲的水溶液成碱性,在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生的产物不污染环境,其化学方程式为 。
参考答案
1-5 BBCDC 6-10 DCBBD 11-15 CBADC 16-20 DBDDA 21-25 ADABD
26、(1)H;O;Al;S;K(2)1S22S22P63S23P1

(3)
27、(1)CH4;NH3(2)>,>(3)CFCl3(或CF3Cl)
(4)使大气臭氧层出现空洞;A
28、(1)S;C(2)SO2;CO2;SO2(3)Cr;四;1S22S22P63S23P63d54S4;+6
(4)2F2+2H2O=4HF+O2
29、(1)N;N的最外层电子排布式为2S22P3,P轨道是半充满的较稳定状态
(2)CsCl (3)Fe 第四周期第ⅤⅢ族;1S22S22P63S23P63d64S2或[Ar]3d64S2


 (
4
)
2Cu+S Cu2S
(
4
)
2Cu+S Cu2S
30、(1)钠;硫;碳; ;第三周期第ⅥA族;CS2
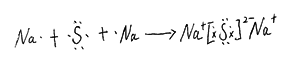
(2)

 (
3
)
FeS2
;
4FeS2+11O2 2Fe2O3+8SO2
(
3
)
FeS2
;
4FeS2+11O2 2Fe2O3+8SO2
31、(1)O;第三周期ⅢA族;Al>C>N>O>H
 (2)
(2)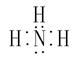
(3)34;H2SeO4;b
(4)2NH3·H2O+2H2O2=N2↑+8H2O或2NH3+2H2O2=N2↑+6H2O(2分)
第二篇:高中化学选修3第二章测试(试卷版)
高中化学选修三第二章测试卷
(满分:100分) (考试时间:100分)
一、选择题(每小题给出的选项中,只有一项符合题目要求的,每题2分,满分40分)
1.(2011黄冈)某化合物含碳、氢、氮三种元素,已知其分子内的4个氮原子排列成内空的四面体结构, 且每2个氮原子间都有一个碳原子,分子中无C-C、C=C和CC键。则此化合物的化学式是( )
A.C6H12N4 B.C4H8N4 C.C6H10N4 D.C6H8N4 2.(2010北京)已知价电子数相同的离子或分子结构相似,如SO3、那么下列分子或离子中与
有相似结构的是( )
都是平面三角形。
化方式分别为( )
223
A.直线形、sp杂化 B.三角形、sp杂化 C.三角锥形、sp杂化 D.三角锥形、sp杂化 6.(2010江苏)说明NH3分子的空间构型是三角锥形结构,而不是平面正三角形结构的充分理由是( )
A.NH3分子是极性分子
B.NH3分子内3个共价键的键角、键长相等
C.NH3分子内3个共价键的键长想等,3个键角都等于107° D.NH3分子内3个共价键的键长相等,3个键角都等于120° 7.(2008湖北黄冈改编)下列叙述中不正确的是( )
A.卤化氢分子中,卤素的非金属性越强,共价键的极性也越强,稳定性也越强 B.以极性键结合的分子,不一定是极性分子
C.判断A2B或AB2型分子为极性分子必须具有极性分子键且空间构型不对称 D.非极性分子中,各原子间都应以非极性键结合
8.(2010海南) 短周期元素X、Y、Z所在的周期数依次增大,它们的原子序数之和为20,且Y与Z核外电子层的结构相同。下列化合物中同时存在极性和非极性共价键的是( ) A.Z2Y B.X2Y2 C.Z2Y2 D.ZYX
9.(2009北京)甲、乙、丙、丁4中物质分别含2种或3种元素,它们的分子中各含18个电子。甲是气态氢化物,在水中分步电离出两种阴离子。下列推断合理的是( )
A.某拿酸溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应 B.乙与氧气的摩尔质量相同,则乙一定含有极性键和非极性键 C.丙中含有2周期IVA族的元素,则丙一定是甲烷的同系物 D.丁和甲中各元素质量比相同,则丁中一定含有-1价的元素 10.(2010全国Ⅱ)短周期元素W、X、Y、Z的原子序数依次增大,且W、X、Y+、Z的最外层电子数与其电子层数的比值依次为2、3、4、2(不考虑零族元素)。下列关于这些元素的叙述错误的是( ) ..
A. X和其他三种元素均可形成至少2种的二元化合物
B. W和X、Z两种元素分别形成的二元化合物中,均有直线形分子 C. W、X和Y三种元素可以形成碱性化合物
D. Z和其他三种元素形成的二元化合物,其水溶液均呈酸性
11.(2010常州)下列关于离子键的特征的叙述中,正确的是( )
A.一种离子对带异性电荷离子的吸引作用与其所处的方向无关,故离子键无方向性
2-+
A.PCl5 B.CCl4 C.NF3 D.
3.六氧化四磷的分子结构中只含有单键,且每个原子的最外层都满足8电子结构,则该分子中含有共价键数目是( )
A.10 B.12 C.24 D.28
4.(2011黄冈)下列分子的立体构型可用sp杂化轨道来解释的是( ) ①BF3 ②CH2=CH2 ③苯 ④CHCH ⑤NH3 ⑥CH4
A.①②③ B.①⑤⑥ C.②③④ D.③⑤⑥
5.根据价层电子对互斥理论及原子的轨道杂化理论判断NF3分子的空间构型和中心原子的杂
2
高中化学选修3第二章章节测试第1页(共4页)
B.因为离子键无方向性,故阴、阳离子的排列是没有规律的,随意的
+-C.因为氯化钠的化学式是NaCl,故每个Na周围吸引一个Cl
D.因为离子键无饱和性,故一种离子周围可以吸引任意多个带异性电荷的离子 12.(2011武汉)下列叙述错误的是( )
A.离子键没有方向性和饱和性,而共价键有方向性和饱和性 B.两种不同的非金属元素可以组成离子化合物
C.配位键在形成时,是由成键双方各提供一个电子形成共用电子对
D.金属键的实质是金属中的“自由电子”与金属阳离子形成的一种强烈的相互作用
13.Co(+3价)的八面体配合物为CoClm·nNH3,若1mol该配合物与AgNO3作用生成1molAgCl沉淀,则m、n的值是( )
A.m=1,n=5 B.m=3,n=4 C.m=5,n=1 D.m=4,n=5 14. (2012河北冀州中学三模)香石花由前20号元素中的6种组成,其化学式为X3Y2(ZWR4)3T2,
X、Y、Z为金属元素,Z的最外层电子数与次外层相等,X、Z位于同族,Y、Z、R、T位于同周期,R最外层电子数是次外层的3倍,T无正价,X与R原子序数之和是W的2倍。下列说法错误的是:( )
A.原子半径:Y>Z>R>T B.XR2、WR2两化合物中R的化合价相同 C.最高价氧化物对应的水化物碱性:X>Z D.气态氢化物的稳定性:W<R<T 15.(2011黄冈)下列几种氢键:①O-H?O,②N-H?N,③F-H?F,④O-H?N,其强度由强到弱的排列顺序是( )
A.③①②④ B.①②③④ C.③②①④ D.①④③② 16.下列化合物的沸点比较,前者低于后者的是( )
A.乙醇和氯乙烷 B.邻羟基苯甲酸与对羟基苯甲酸 C.对羟基苯甲醛与邻羟基苯甲醛 D.H2O和H2Te 17.(2012重庆巴蜀中学)下列叙述正确的是: A.同主族元素原子半径越大熔点越高
B.同主族不同周期元素原子序数之差可能是44 C. 两种原子如某原子半径大,则其离子半径也大。
D.从HF、HCl、HBr、HI酸性增强的事实,推出F、Cl、Br、I的非金属递增的规律 18.(浙江省温州市2012届高三第一次适应性测试)X、Y、Z、R和W代表原子序数依次增
大的5种短周期元素,X元素原子最外层电子数比次外层电子数多2,R与Y同主族,W元素族序数等于周期数的2倍。已知常温下:W氢化物(气态)+Z单质(气态)=Z氢
化物(液态)+W单质(固态)。下列说法正确的是( ) A.Y、W元素氧化物对应的水化物一定是强酸 B.R元素位于第二周期第VA族 C.稳定性:Z氯化物>W氢化物 D.原子半径从小到大:Z<X<Y<R
19.(2009四川)X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻。X的核电荷数是Y是核外电子数的一半,Y与M可形成化合物M2Y。下列说法正确的是( )
A. 还原性:X的氧化物>Y的氧化物>Z的氢化物
B. 简单离子的半径:M的离子>Z的离子>Y的离子>X的离子 C. YX2、M2Y都是含有极性键的极性分子
D. Z元素的最高价氧化物的水化物的化学式为HZO4
20.(2012四川)已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W但是气态氢化物的稳定性比Z的气态氢化物的稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性。下列说法正确的是( ) A.XYZW的原子半径依次减小 B.W与X形成的化合物中只含离子键
C.W的气态氢化物的沸点一定高于Z的气态氢化物的沸点
D.若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3
二、非选择题(共8个小题,满分50分)
21. (高考组合题)海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等;氮是地球上极为丰富的元素。
Ⅰ(8分).(1)在光照条件下,氯气和氢气反应过程如下:
①Cl2?C1+Cl ②Cl+H2?HCl+H ③H+C12?HCl+Cl ??
反应②中形成的化合物的电子式为 ;反应③中被破坏的化学键属 于 键(填“极性”或“非极性”)。
(2)在短周期主族元素中,氯元素及与其相邻元素的原子半径从大到小的顺序是(用元素符号表示)。与氯元素同周期且金属性最强的元素位于周期表的第周期族。 (3)卤素单质及化合物在许多性质上都存在着递变规律。下列有关说法正确的是。 a.卤化银的颜色按AgCl、AgBr、AgI 的顺序依次加深
b.卤化氢的键长按H—F、H—C1、H—Br、H—I的顺序依次减小
高中化学选修3第二章章节测试第2页(共4页)
c.卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱 d.卤素单质与氢气化合按F2、Cl2、Br2、I2的顺序由难变易 (4)卤素单质的键能大小如右图。由图推断:
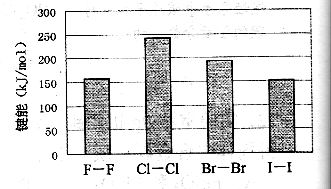
①非金属性强的卤素,其单质分子的化学键 断裂(填“容易”或“不容易”或“不一定容易”)。 ②卤素单质键能大小与键长的关系为:
Ⅱ. (6分)⑴Li3N晶体中氮以N3-的存在,基态N3-的电子排布式为 。 ⑵N≡N的键能为942 kJ·mol-1,N-N单键的键能为247 kJ·mol-1,计算说明N2中的 键比 键稳定(填“σ”或“π”)。
⑶(CH3)3NH+和AlCl4-可形成离子液体。离子液体由阴、阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂 (填“大”或“小”),可用作 (填代号)
a.助燃剂 b.“绿色”溶剂 c.复合材料 d.绝热材料
⑷X+中所有电子正好充满K、L、M三个电子层X的元素符号是 。
22.(2008四川)(9分)D、E、X、Y、Z是周期表中的前20号元素,且原子序数逐渐增大。它们的最简氢化物分子的空间构型依次是正四面体、三角锥形、正四面体、角形(V形)、直线形。回答下列问题:
(1)Y的最高价氧化物的化学式为__________;
(2)上述5种元素中,能形成酸性最强的含氧酸的元素是___________,写出该元素的任意3种含氧酸的化学式:___________________________________;
(3)D和Y形成的化合物,其分子的空间构型为____________;
(4)D 和X形成的化合物,其化学键类型属___________,其晶体类型属__________; (5)金属镁和E的单质在高温下反应得到的产物是___________,此产物与水反应生成
23.(2008重庆)(8分)在20xx年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主
要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且
1 molXY2含有54 mol电子.
(1)该融雪剂的化学式是 ;X与氢元素形成的化合物的电子式是 . (2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是 ;D与E能形成一种非极性分子,该分子的结构式为 ;D所在族元素的氢化物中,沸点最低的是 .
(3)元素W与Y同周期,其单质是原子晶体;元素Z的单质分子Z2中有3个共价健;W与Z能形成一种新型无机非金属材料,其化学式是 (4)元素R与Y同主族,其氢化物能用于刻蚀玻璃,R2与NaOH溶液反应的产物之一是OR2,该反应的离子方程式为 . 24. (2009福建)(6分)短周期元素Q、R、T、W在元素周期表中的位置如右图所示,期中T所处的周期序数与主族序数相等,请回答下列问题: (1)T的原子结构示意图为 。
(2)元素的非金属性为(原子的得电子能力):Q W(填“强于”或“弱于”)。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为 。
(4)原子序数比R多1的元素是一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是 。
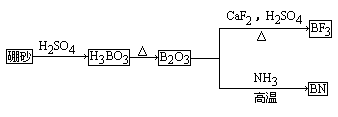
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是 。 25.(2011辽宁)(10分)氮化硼(BN)是一种重要的功能陶瓷材料,以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
请回答下列问题:
两种碱,该反应的化学方程式是____________________;
高中化学选修3第二章章节测试第3页(共4页)
(1) 由B2O3制备BF3、BN的化学方程式依次
是 、 ;
(2) 基态B原子的电子排布式为 ;B和N相比,电负性较大的是 ,
BN中B元素的化合价为 ;
(3) 在BF3分子中,F—B—F的键角是 ,B原子的杂化轨道类型为 ,BF3
和过量NaF作用可生成NaBF4,BF—4的立体结构为 ;
26.(2009山东)(6分) C和Si元素在化学中占有极其重要的地位。 (1)写出Si的基态原子核外电子排布式 。
从电负性角度分析C、Si和O元素的非金属活泼性由强至弱的顺序为 。 (2)SiC的晶体结构与品体硅的相似,其中C原子的杂化方式为 ,向存在的作用力
是 。
(3)C、Si为同一主族的元素,CO2和SiO2:化学式相似,但结构和性质有很大不同。CO2中
C与O原子间形成σ键与π键,SiO2中Si与O原子间不形成上述π键。从原子半径大小的角度分析,为何C,O原子间能形成,而S、O原子间不能形成上述π键。
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
27.(2012全国大纲)(6分)原子序数依次增大的短周期元素a、b、c、d和e中,a的最外层电子数为其周期数的二倍;b和d的A2B型氢化物均为V形分子,c的+1价离子比e的-1价离子少8个电子。 回答下列问题:
(1) 元素a为________;c为_______
(2) 由这些元素形成的双原子分子为__________________。
(3) 由这些元素形成的三原子分子中,分子的空间结构属于直线形的是_______,非
直线形的是_______________________。(写2种) 28.(3分)W、X、Y、Z为短周期内除稀有气体外的四种元素,它们的原子序数依次增大,其中只有Y为金属元素。已知Y和W的最外层电子数相等;Y、Z两种元素的质子数之和为
W、X两种元素质子数之和的3倍。
(1)由Y、X、W组成的物质是由__________________(填化学键类型)形成的__________化合物。
(2)下列关于W、X、Y、Z的说法中正确的是_____________(填字母) a.W2Z是由共价键形成的分子 b.ZX2是由离子键形成的分子 c.W2X2与Y2X2的化学键类型相同
d.X的最高价氧化物的水化物能与X的氢化物反应生成盐 e.W、Y同主族,X、Z也同主族 f.W、Y不同主族,X、Z也不同主族 g.W、Y不同主族,X、Z同主族 h.W、Y同主族,X、Z不同主族
高中化学选修3第二章章节测试第4页(共4页)
参考答案
1-5ABBAD6-10CDBDD11-15ACBBA16-20BBCDA 21.Ⅰ(1)
非极性
(4)2F2+2OH=2F+OF2+H2O
——
24. (1)(2)弱于 (3)S+2H2SO4(浓)
(2)S Cl F 三 IA (3)a
(4)①不一定容易 ②除F2外,键长增长,键能减小 (合理即给分)
【解析】(1)同一元素组成的双原子分子为非极性分子,不同种元素组成的分子为极性分子,HCl分子中共用一对电子,可直接写出。
(2)短周期主族元素中与氯元素相邻的有F和S,根据同周期和同主族元素原子的半径变化规律可知,三者的原子半径从大到小的顺序是S>Cl>F。与氯同周期,金属性最强的元素位于该周期的最左侧,为Na元素。
(3)随着原子半径增大,卤代氢的键长逐渐增大,b项错误。自上而下,卤代氢的还原性依次增强,C项错误。卤素单质与氢气化合的难易取决于卤素非金属性的强弱,自上而下为由易到难,D错。
Ⅱ⑴1s2s2p;⑵π σ;⑶小 b;⑷Cu
22. (1)SO3 (2)Cl,HClO HClO2 HClO3 HClO4(任写 3种酸) (3)直线形 (4)共价键 原子晶体
(5)Mg3N2 Mg3N2十8H2O = 3Mg(OH)2↓+2NH3·H2O(Mg3N2十6H2O = 3Mg(OH)2↓+2NH3↑) 23. (1)(2)
S=C=S(2分);H2S (3)Si3N4
CaCl2;
2
2
6
3SO2↑+2H2O
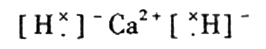
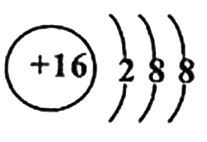
(4)2H2O2 2H2O+O2↑(或其他合理答案:)
(5)NaNO2

25.
26. (1)1s2ssp3ssp
2
2
6
2
2
O C Si(2) sp 共价键
3
(4)C原子半径较小,C,O原子能充分接近,p—p轨道肩并肩重叠程度较大易形成较稳定的π键;Si原子半径较大,Si,O原子间距较大,p—p轨道肩并肩重叠程度较小,不易形成较稳定的π键

27.
28.(1)极性共价键、离子键 离子 (2)ae
高中化学选修3第二章章节测试第5页(共4页)
