如皋市江安中学高三化学
高中化学选修四知识点
1. 常见的吸热反应:C与CO2、C与H2O蒸汽、CaCO3的分解、NH4Cl与Ba(OH)2·8H2O
晶体等大多数的分解反应、盐类的水解、弱电解质的电离、键的断裂。
3.弱酸或弱碱电离要吸收热量,所以它们参加中和反应时的中和热小于57.3kJ/mol。
2.化学腐蚀:金属和接触到的干燥气体(如O2,Cl2,SO2等)或非电解质(如石油)等直接发生化学反应而引起的腐蚀。如钢管被原油中的含硫化合物腐蚀等。
3.电化学腐蚀:不纯的金属跟电解质溶液接触时,会发生原电池反应,比较活泼的金属失去电子而被氧化。
4.铁锈的主要成分:Fe2O3·XH2O。铁锈疏松的覆盖在钢铁表面,不能阻止继续被腐蚀。
5.金属的电化学防护:牺牲阳极的阴极保护法(原电池原理) ,外加电流的阴极保护法(电解池原理)
6.参加反应的物质为固体和液体,由于压强的变化对浓度几乎无影响,认为反应速率不变。
7. ①恒温恒容时:充入惰性气体→总压增大,但是各分压不变,各物质浓度不变→反应速率不变
②恒温恒压时:充入惰性气体→体积增大→各反应物浓度减小→反应速率减慢
8.勒夏特列原理:只适用于判断改变一个条件时平衡移动的判断。
9.改变压强不能使无气态物质存在的化学平衡发生移动
10.气体减压或增压与溶液稀释或浓缩的化学平衡移动规律相似
11.化学平衡常数:K越大,反应物转化率越大,一般K>10,该反应进行得就基本完全了。 反应物或生产物中有固体或纯液体存在时,由于其浓度是固定不变的,可以看做是“1”而不代入公式。稀溶液中进行的反应,如有水参加,水的浓度不必写在平衡关系式中。
12.①电解质、非电解质都是化合物②SO2、NH3、CO2等属于非电解质
③强电解质不等于易溶于水的化合物(如BaSO4不溶于水,但溶于水的BaSO4全部电离,故BaSO4为强电解质)——电解质的强弱与导电性、溶解性无关。
13.加水升温促进电离.同一温度下,不同弱酸,电离常数越大,其电离程度越大,酸性越强。如:H2SO3>H3PO4>HF>CH3COOH>H2CO3>H2S>HClO
14..滴定管的刻度,O刻度在上,全部容积大于它的最大刻度值,因为下端有一部分没有刻度。滴定管可以读到小数点后两位。滴定中不用石蕊,因为溶液颜色变化不明显。滴定终点溶液不一定呈中性,呈中性时,甲基橙、酚酞都可做指示剂。呈酸性时,甲基橙做指示剂。呈碱性时,酚酞做指示剂。滴定终点溶液颜色最好由浅入深。选滴定终点的判断:溶液由*色变成*色,30内不恢复到原来的颜色。
15.NaHSO4电离呈酸性;NaHSO3中HSO3—的电离程度大于水解程度呈酸性;NaHCO3中HCO3的水解程度大于电离程度呈碱性。双水解:部分弱酸根与弱碱的阳离子水解相互促进,反应进行彻底,故用“═”同时有“↓”“↑”。如:Al与S、HS、CO3、HCO3、AlO2-。Fe3+与AlO2-、CO32-、HCO3-。NH4+与AlO2-、SiO32-。
16.去油污用热碱水冼油污物品CO32-的水解.配制Na2CO3溶液时常加入少量NaOH
1 3+2--2--—5
如皋市江安中学高三化学
17.加热灼烧盐溶液时:考虑盐溶液的分解、氧化、水解等变质的特点。
18.在配置易水解的盐溶液时,如FeCl3水溶液,为了抑制水解需要加入少量的盐酸
19.调pH值除某些易水解的金属阳离子:如加MgO除去MgCl2溶液中FeCl3。
20.电离呈酸性或碱性时,抑制水的电离。水解呈酸性或碱性时,促进水的电离。
21.溶度积:Qc< Ksp 沉淀未完全, Qc=Ksp 溶解平衡, Qc﹥Ksp 无沉淀析出
22.掌握三种微溶物质:CaSO4、Ca(OH)2、Ag2SO4
23.沉淀的转化:AgNO3→AgCl(白色沉淀)→AgBr(淡黄色)→AgI(黄色)→Ag2S(黑色)
24.产生电流的反应发生在化学电池中,是自发的,向外输送能量。
借助电流而发生的反应发生在电解池中,是由外界输入的能量推动的。
25.电解质溶液导电的过程就是其被电解的过程。电解质导电—化学变化,金属、石墨导电—物理变化
26.阴极放电顺序:Ag+>Fe3+>Cu2+>H+>Fe2+>Zn2+>Al3+
阳极放电顺序:活泼电极S2->I->Br->Cl->OH->含氧酸根离子>F-
27.电镀目的:使金属增强抗腐蚀的能力,增加美观和表面硬度。
28.电镀的条件:阴极:待镀的制品。阳极:镀层金属。电镀液:含镀层金属离子的溶液
29.粗铜的精炼:阳极:粗铜 阴极:纯铜 电解液:硫酸铜溶液
注:粗铜中的多数杂质沉积在电解槽的底部,这些杂质叫阳极泥,可作为提炼金,银等贵重金属的原料
30.钠,钙,镁,铝,电解法几乎是唯一可行的方法。如:电解熔融NaCl、MgCl2、Al2O3
2
第二篇:高中化学选修4知识点
选修4重难点知识常考点
一、有关反应热(涵义及盖斯定律)
1. 沼气是一种能源,它的主要成分是CH4.0.5molCH4完全燃烧生成CO2和水时放出445KJ热量.下列有关热化学方程式正确的是(C)
A.2CH4(g)+4O2(g)=2CO2(g)+4H2O(l);ΔH=+890KJ/mol
B.CH4(g)+ 2O2(g)= CO2(g)+2H2O(l);ΔH=+890KJ/mol
C.CH4(g)+ 2O2(g)= CO2(g)+2H2O(l);ΔH=-890KJ/mol
D.1/2 CH4(g)+O2(g)=1/2 CO2(g)+H2O(l);ΔH=-890KJ/mol
2.已知有下列热化学方程式:
Zn(s)+1/2O2(g)== ZnO(s); △H= -351.1KJ/mol ,
Hg(l)+ 1/2O2(g)== HgO(s) ; △H= -90.7KJ/mol,由此可知:
Zn(s)+ HgO(s)== ZnO(s)+ Hg(l),在相同条件下的△H为( D )
A.-441.8KJ/mol B.+260.4KJ/mol
C.+441.8KJ/mol D.-260.4KJ/mol
二、原电池及电解池
1.下列关于铜电极的叙述正确的是( C )
A.铜锌原电池中,铜是负极
B.用电解法精炼粗铜,粗铜作阴极
C.在镀件上电镀铜时,可用金属铜作阳极
D.电解稀硫酸制氢气、氧气时,铜作阳极
2.银锌电池(钮扣式电池)的两个电极分别是由氧化银与少量石墨组成的活性材料和锌汞合金构成,电解质为氢氧化钾溶液,电极反应为 Zn+2OH--2e-=ZnO+H2O;
Ag2O+H2O+2e- = 2Ag+2OH- ;总反应为:Ag2O+Zn=2Ag+ZnO,下列判断正确的是( BC )
A、锌为正极,Ag2O为负极
B、锌为负极,Ag2O为正极
C、原电池工作时,负极区PH减小
D、原电池工作时,负极区PH增大
3、新近研制的溴—锌蓄电池的基本结构是用碳棒作两极,用ZnBr2溶液作电解液,现有四个电极反应:①Zn – 2e = Zn2+ ②Zn2+ + 2e = Zn ③Br2 + 2e = 2Br- ④2Br- - 2e = Br2 ,充电时的阳极和放电时的负极反应分别依次为(A)
A、④① B、②③ C、③① D、②④
4.用铂作电极电解一定浓度的下列物质的水溶液。电解结束后,向剩余电解液中加适量水,能使溶液和电解前相同的是( C )
A.AgNO3 B.HCl C.NaOH D.NaCl
5.在盛有饱和Na2CO3溶液的烧杯中插入惰性电极,保持温度不变,通直流电一段时间后,
则( C )
A.溶液的pH增大 B.溶液的浓度增大,有一定量的晶体析出
C.溶液的浓度不变,有晶体析出 D.溶液的pH减小
 6.如右图所示,在盛有水的烧杯中,等质量的铁圈和银圈的连接处,吊着一根绝缘的细丝,使之平衡。小心地在 烧杯中央滴入CuSO4溶液。
6.如右图所示,在盛有水的烧杯中,等质量的铁圈和银圈的连接处,吊着一根绝缘的细丝,使之平衡。小心地在 烧杯中央滴入CuSO4溶液。
⑴经过一段时间后,观察到的现象是(指金属圈) 。
A.铁圈和银圈左右摇摆不定
B.保持平衡状态不变
C.铁圈向下倾斜 D.银圈向下倾斜
⑵产生上述现象的原因是 。
答案⑴D (3分)
⑵Fe和Ag形成原电池,Fe极Fe溶解, Ag极析出Cu增重。(3分)
三、有关化学反应的方向、速率及限度
1.下列反应在常温下均为非自发反应,则在高温下仍为非自发的是( A )
A. 2CO(g)====2 C(s)+ O2(g)
B. 2CuO(s) ====Cu2O(s)+1/2O2(g)
C. MgCO3(s)====MgO(s)+CO2 (g)
D.SnO2(s)+C(s) ==Sn(s)+ CO2 (g)
2.反应:A + 3B  2C + D,在四种不同情况下的反应速率分别为:
2C + D,在四种不同情况下的反应速率分别为:
① ②
②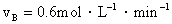
③ ④
④
该反应进行得最快的是(B )
A.① B.④ C.①④ D.②③
 3.已知反应:3A + 4B C + 2D 其反应速率可以分别用V(A)、V(B)、V(C) 、V(D) [mol/(L·min)]表示,则正确的关系是( B )。
3.已知反应:3A + 4B C + 2D 其反应速率可以分别用V(A)、V(B)、V(C) 、V(D) [mol/(L·min)]表示,则正确的关系是( B )。
A.V(A)=1/3V(C) B.V(B)=4/3V(A)
C.V(C)=4V(B) D.V(D)=1/2V(C)
 4.对于反应N2 + O2 2NO在密闭容器中进行,下列条件哪些不能加快反应的化学反应的化学反应速率(温度不变)( CD )。
4.对于反应N2 + O2 2NO在密闭容器中进行,下列条件哪些不能加快反应的化学反应的化学反应速率(温度不变)( CD )。
A.缩少体积使压强增大 B.体积不变充入N2使压强增大
C.体积不变充入 He使压强增大 D.减少压强使体积增大
 5.下列哪种说法可以证明N2 + 3H2 2NH3已达平衡状态( C )
5.下列哪种说法可以证明N2 + 3H2 2NH3已达平衡状态( C )
A.1个N≡N键断裂的同时,有2个N—H键断裂
B.1个N≡N键断裂的同时,有3个H—H键断裂
C.1个N≡N键断裂的同时,有6个N—H键断裂
 D.1个N≡N键断裂的同时,有6个N—H键生成
D.1个N≡N键断裂的同时,有6个N—H键生成
6.对可逆反应:A(气) + B(气) 3C(气) + Q,根据
3C(气) + Q,根据
右图,从a反应历程改变为b反应历程,所采取的措施是(C )
A.增大B的浓度 B.升高温度
C.加入催化剂 D.增大压强
7.在一定条件下,在2L的密闭容器中充入2molSO2 和一定量的O2 ,发生反应2SO2+O2 2SO3,进行到4min时,测得n(SO2)=0.4mol,若反应进行到2min时,容器中n(SO2)为( D )
2SO3,进行到4min时,测得n(SO2)=0.4mol,若反应进行到2min时,容器中n(SO2)为( D )
A.1.6mol B.1.2mol C.大于1.6mol D.小于1.2mol
8.CO2和H2的混凝土合气体加热到1023K时,可建立下列平衡:CO2+H2 CO+H20(g),在该温度下,平衡时有90%的氢气变成水蒸气(K=1),则原混合气体中CO2和H2的分子数之比是( D )
CO+H20(g),在该温度下,平衡时有90%的氢气变成水蒸气(K=1),则原混合气体中CO2和H2的分子数之比是( D )
A.1:1 B.1:5 C.1:10 D.9:1
9.在水溶液中橙红色的Cr2O72-与黄色的CrO42-有下列平衡关系.
Cr2O72-+H2O 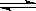 2CrO42-+2H+,把K2Cr2O7溶于水配成稀溶液是橙色。
2CrO42-+2H+,把K2Cr2O7溶于水配成稀溶液是橙色。
(1)向上述溶液中加入NaOH溶液,溶液呈___________色,因为__________。
(2)向已加入NaOH溶液的(1)中再加入过量稀H2SO4,则溶液呈___________色,
因为__________。
(3)向原溶液中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀)则平衡___________,
溶液颜色将__________。
(答案⑴黄;中和H+平衡向正反应方向移动⑵橙红色;增加生成物浓度平衡向逆反应
方向移动⑶正反应移动;变浅)
10.(12分)两只密闭容器A和B,A能保持恒压,B能保持恒容。起始时向容积相等的A、B中分别通入体积比为2∶1的等量的SO2和O2,使之发生反应:2SO2+O2 2SO3,并达到平衡。则(填>、=、<;左、右;增大、减小、不变)。
2SO3,并达到平衡。则(填>、=、<;左、右;增大、减小、不变)。
⑴达到平衡所需要的时间:t(A) t(B),SO2的转化率:a(A) a (B)
⑵起始时两容器中的反应速率:v(A) v(B),反应过程中的反应速率:v(A) v(B)。
⑶达到平衡时,在两容器中分别通入等量的AV气。A中的化学平衡向 反应方向移动,B中的化学反应速率 。
⑷达到平衡后,向两容器中分别通入等量的原反应气体,再次达到平衡时,A容器中SO2的百分含量 ,B容器中SO2的百分含量
答案⑴<、> ⑵=、> ⑶逆、不变 ⑷不变、增大
11.反应2A(g)+ B(g) 3C(g),起始时按5:2的体积比把A、B两气体混合后,充入一体积不变的密闭容器中,在恒定温度下使之反应,达平衡时混合气体中C的体积分数为60%。(已知A、B的相对分子质量分别为a、b)求:
3C(g),起始时按5:2的体积比把A、B两气体混合后,充入一体积不变的密闭容器中,在恒定温度下使之反应,达平衡时混合气体中C的体积分数为60%。(已知A、B的相对分子质量分别为a、b)求:
(1)A、B的转化率(2)平衡时混合气体的平均相对分子质量。(3)平衡时压强与起始时相比,有何变化?
答案(1)56%,70%(2)[(5a+2b)/7 ] mol/l(3)相等
四、电解质在水溶液中的行为
1.下列物质的稀溶液中,溶质的阴、阳离子个数之比为1∶2的是 ( B )
A. Na2HPO4 B. NaHSO4 C. (NH4)2SO4 D. K2S
2.pH=11的NaOH溶液和pH=3的醋酸溶液以等体积混合后,所得溶液中c(Na+) c(CHCOO-)的正确关系是 ( C )
A. c(Na+)>c(CHCOO-) B. c(Na+)=c(CHCOO-)
C. c(Na+)<c(CHCOO-) D. 不能确定
3.关于小苏打水溶液的表述正确的是(AD)
A. c(Na+) = c(HCO3—)+ c(CO32—)+ c(H2CO3)
B.c(Na+) + c(H+)= c(HCO3—)+ c(CO32—)+ c(OH—)
C.HCO3—的电离程度大于HCO3—的水解程度
D.存在的电离有:NaHCO3 == Na+ + HCO3—,HCO3— H+ + CO32—,
H+ + CO32—,
H2O  H+ + OH—
H+ + OH—
4.下列各组离子,在指定环境中能大量共存的是(AC)
A. 在 的溶液中,
的溶液中,
B. 在 的溶液中,
的溶液中,
C. 在 的溶液中,
的溶液中,
D.在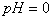 的溶液中,
的溶液中,
5.某氨水的pH=X,某盐酸的pH=Y,已知X+Y=14,将上述氨水与盐酸等体积混合后,所得溶液中各种离子浓度的关系正确的是 (AD )
A. c( )>c(Cl-)>c(OH-)>c(H+) B. c(
)>c(Cl-)>c(OH-)>c(H+) B. c( )>c(Cl-)>c(OH-)>c(H+)
)>c(Cl-)>c(OH-)>c(H+)
C. c(Cl-)>c( )>c(H+)>c(OH-) D. c(
)>c(H+)>c(OH-) D. c( )+c(H+)=c(Cl-)+c(OH-)
)+c(H+)=c(Cl-)+c(OH-)
6.用标准氢氧化钠溶液中和醋酸溶液,当溶液的pH值等于7,则此时 (D )
A. 醋酸和氢氧化钠物质的量相等 B. 醋酸和氢氧化钠恰好中和
C. 氢氧化钠过量 D. 醋酸有剩余
7.下列各组物质能一起混合施用的是 ( B )
A. 铵态氮肥和草木灰(含K2CO3)混合施用
B. 化肥和农家肥(如绿肥)混合施用
C. 重钙施入碱性土壤中
D. 复合肥(如磷酸氢二铵)和生石灰一起施用
8.水玻璃在工业上可作粘合剂,当它与NH4Cl溶液接触时,会很快凝结。原因是
(NH4Cl溶液因NH4+ 发生水解而呈酸性,水玻璃与其接触时,SiO2与H+结合生成硅酸胶体而凝结。)
9.Na2S的水溶液洗患处可以用来治疗由一种小芥虫在皮肤内生活引起的皮肤病,而且用热水配制的Na2S溶液治疗效果更好。请说明原因,并写出有关的化学方程式。
(因为Na2S水解生成的H2S有毒,可杀虫; 水解是吸热反应,热水溶解Na2S时促使平衡右移动,增大H2S的浓度。有关化学方程式为Na2S +H2O  NaHS+ NaOH,NaHS +H2O
NaHS+ NaOH,NaHS +H2O  NaOH +H2S )
NaOH +H2S )
10.已知pH=2的高碘酸(H3IO5)溶液与pH=l2的NaOH溶液等体积混合,所得混合溶液呈酸性, 0.01mol/L的碘酸(HIO3)或高锰酸(HMnO4)溶液与pH=l2的NaOH溶液等体积混合,所得混合溶液均呈中性, 请回答下列问题:
(1) 高碘酸是_____(填写“强酸”或“弱酸”),原因是__________________________
______________________________________________________________________。
(2)已知高碘酸和硫酸锰在溶液中反应生成高锰酸和碘酸及硫酸, 此反应的氧化剂是________,反应的离子方程式为___________________________________________
________________________________________________________________________。
答案(1)弱酸(2分),由于高碘酸溶液的c(H+)与NaOH溶液的c(OH-)相等,二者等体积混合后,混合液显酸性,说明酸过量,原高碘酸溶液中只有一部分高碘酸的分子发生了电离,所以高碘酸是弱酸。(2分)(2)高碘酸(2分)
5H3IO5+2Mn2+=2MnO4-+5IO3-+2H2O+11H+ (2分)
