高一化学必修二第二章知识点对应练习
一. 化学反应与能量:
1. 知道化学反应中能量变化的主要原因?
例1. 1 molH–I 键的键能是299KJ。 1mol I – I 键的键能是151KJ, 1mol H–H键的键能是436KJ, 则H2(g)+I2(g)=2HI(g)的反应是
A. 吸热反应 B. 放热反应 C. 分解反应 D. 可逆反应
例2. 2C + O2 = 2CO,2CO + O2 = 2CO2 都是放热反应。据此推断,下列说法不正确的是
A. 12gC所具有的能量一定高于28gCO所具有的能量
B. 56gCO和32gO2所具有的总能量大于88gCO2所具有的总能量
C. 12gC和32gO2所具有的总能量大于44gCO2所具有的总能量
D. 将一定质量的碳燃烧,生成CO2比生成CO时放出的热量多
2. 知道反应吸热还是放热取决于什么?
例3.下列说法正确的是
A. 物质发生化学反应都伴随着能量变化
B. 伴有能量变化的物质变化都是化学变化
C. 在一个确定的化学反应关系中,反应物的总能量与生成物的总能量一定不同
D. 在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量
3. 知道常见的吸热反应和放热反应?
例4.下列反应属于放热反应的是
A.氢气还原氧化铜 B.氢气在氧气中燃烧
C.氢氧化钾和硫酸中和 D.碳酸钙高温分解成氧化钙和二氧化碳
4. 需要加热的反应都是吸热反应吗?
5. 物质能量越低越稳定?
例5.金刚石和石墨都是碳的单质,石墨在一定条件下可以转化为金刚石。已知12g石墨完全转化为金刚石时,要吸收EkJ的能量,下列说法正确的是
A.金刚石与石墨互为同位素 B.石墨不如金刚石稳定
C.金刚石不如石墨稳定
D.等质量的石墨与金刚石完全燃烧,石墨放出的能量多
6. 充分燃烧的条件?
例6.下列关于燃料充分燃烧的说法,不正确的是
A.空气量越多越好 B.应通入适量空气
C.固体燃料燃烧前要粉碎 D.液体燃料燃烧时可以以雾状喷出
二. 化学反应与电能:
1. 什么样的化学反应可以设计成原电池?
2. 原电池的反应原理?
例7.由铜、锌和稀硫酸组成的原电池工作时,电解质溶液的pH怎样变化
A.不变 B.先变小后变大 C.逐渐变大 D.逐渐变小
3. 原电池正负极判断?
例8.银锌电池广泛用做各种电子仪器的电源,它的充电和放电过程可以表示为:2Ag+Zn(OH)2 Ag2O+Zn+H2O,在此电池放电时,正极上发生反应的物质是( )
Ag2O+Zn+H2O,在此电池放电时,正极上发生反应的物质是( )
A.Ag B.Zn(OH)2 C.Ag2O D.Zn
4. 金属性强弱判断?
例9.X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X与Y组成的原电池时,Y为电池的负极,则X、Y、Z三种金属的活动顺序为
A. X > Y > Z B. X > Z > Y C. Y > X > Z D. Y > Z > X
5. 会设计原电池装置?
例10.某原电池总反应离子方程式为2Fe3+ + Fe = 3Fe2+能实现该反应的原电池是
A.正极为铜,负极为铁,电解质溶液为FeCl3溶液
B.正极为铜,负极为铁,电解质溶液为Fe(NO3)2溶液
C.正极为铁,负极为锌,电解质溶液为Fe2(SO4)3
D.正极为银,负极为铁,电解质溶液为CuSO4
6. 构成原电池,反应速率加快?
例11.实验室中欲制氢气,反应速率最快的是
A.纯锌与稀硫酸反应 B.纯锌与浓硫酸反应
C.纯锌与稀盐酸反应 D.粗锌(含铅、铜杂质)与稀硫酸反应
例12.将等质量的两份锌粉a和b,分别加入两个盛过量的稀硫酸的烧杯中,并向加入a的烧杯中再加入少量CuO粉末。下列各图表示氢气体积V(H2)与反应时间t的关系,其中正确的是

7. 燃料电池的电极方程式的书写? 2H2 + O2 = 2H2O
电解质是酸性:
电解质是碱性:
8. 常见的几种的电池? ① 干电池 ② 蓄电池 ③燃料电池
9. 有关原点池的计算问题?
例13.在由铜片、锌片和200 mL稀硫酸组成的原电池中,若锌片只发生电化学腐蚀,当在铜片上放出3.36 L(标准状况)的H2时,硫酸恰好用完,则:
(1)产生这些气体消耗的锌的质量是多少?
(2) 通过导线的电子的物质的量是多少?
(3)原稀硫酸的物质的量浓度是多少?
三. 化学反应速率和限度:
1. 化学反应速率的计算?
例14.在2 L的密闭容器中,充人2 molN2和3 molH2,在一定条件下发生反应,3 s后测得N2为1.9 mol,则以H2的浓度变化表示的反应速率为 。
2. 会比较化学反应速率的大小?
例15. 反应A(g)+3B(g) 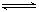 2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是( )
2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是( )
A.υ(D)=0.4 mol / (L·s) B.υ(C)=0.5 mol / (L·s)
C.υ(B)=0.6 mol / (L·s) D.υ(A)=0.15 mol / (L·s)
例16.把下列四种X溶液分别加入四个盛有10mL 2mol/L盐酸的烧杯中,均加水稀释到50mL,此时,X和盐酸缓慢地进行反应,其中反应最快的是( )
A.10℃20mL 3mol/L的X溶液 B.20℃30mL 2mol/L的X溶液
C.20℃10mL 4mol/L的X溶液 D.10℃10mL 2mol/L的X溶液
3. 影响化学反应速率的因素?
例17.在反应:C+CO2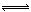 2CO中,可使反应速率增大的措施是( )。
2CO中,可使反应速率增大的措施是( )。
①增大压强 ②升高温度 ③通入CO2 ④增加碳的量 ⑤降低压强
A.①②③④ B.②③④⑤ C.①②③ D.②③④
4. 会判断可逆反应?
例18.下列反应不属于可逆反应的是:( )
A.氯气与水反应生成盐酸与次氯酸
B.N2与H2在一定条件下可以生成NH3,同时NH3又可分解为N2和H2
C.电解水生成H2和O2,氢气和氧气转化成H2O
D.SO2溶于水和H2SO3分解
5. 知道可逆反应是有限度的?
例19.对化学反应限度的叙述,错误的是
A.任何可逆反应都有一定的限度 B.化学反应达到限度时,正逆反应速率相等
C.化学反应的限度与时间的长短无关 D.化学反应的限度是不可改变的
6. 化学平衡标志的判断?
例20.在一定温度下,反应A2(g) + B2(g) 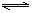 2AB(g)达到平衡的标志是( )
2AB(g)达到平衡的标志是( )
A、单位时间内生成nmolA2同时生成nmolAB
B、容器内的总物质的量不随时间变化
C、单位时间内生成2nmolAB的同时生成nmolB2
D、单位时间内生成nmolA2的同时生成nmolB2
例21.一定条件下,X(g)+3Y(g)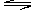 2Z(g)达到化学平衡的标志是
2Z(g)达到化学平衡的标志是
A.Z的分解速率和生成速率相等 B.X、Y、Z的浓度不再变化
C.反应体系的总质量保持不变 D.单位时间内生成nmolZ,同时生成nmolX
7. 化学平衡的计算:
例22.将等物质的量的A,B混合于2L的密闭容器中,发生反应3A(气)+B(气)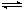 xC(气)+2D(气)。经5min后达到平衡时,测知D的浓度为0.5mol/L,[A]:[B]=3:5,C的平均反应速率为0.1mol/L·min。试求
xC(气)+2D(气)。经5min后达到平衡时,测知D的浓度为0.5mol/L,[A]:[B]=3:5,C的平均反应速率为0.1mol/L·min。试求
(1)A的平衡浓度是多少?
(2)B的平均反应速率?
(3)x=?
第二篇:高一化学必修一第三章、第四章知识点复习 及练习题
金属及其化合物
一. 金属的物理性质:
钠:银白色,有金属光泽,质软,密度小于水,大于煤油,熔点低,电和热的良导体。
铝:银白色,有金属光泽,质软,有良好的延展性,是热和电的良导体。
铁:纯铁是银白色的有金属光泽的固体,有磁性,可以被磁铁吸引,有延展性,是电和热的良导体。
单质
1、与非金属反应(O2、Cl2、S):表现强还原性,被氧化
1)常温下:4Na + O2=== 2Na2O (白色)
常温下金属钠在空气中表面变暗,生成氧化膜,说明钠比Al、Fe活泼得多
(应用)钠保存在石蜡油或煤油中,因为钠易与水或者空气中的氧气反应,而钠不与煤油反应,且钠的密度大于煤油的密度,所以保存在煤油中。
2)受热时:2Na + O2=== Na2O2 (淡黄色)
(现象)钠在空气中受热后,先熔化成闪亮的小球后剧烈燃烧产生黄色火焰,生成淡黄色固体
2、与水反应:2Na + 2H2O == 2NaOH + H2↑ (分析电子得失)
现象:

(应用)钠燃烧引起火灾,怎么办?(一般用砂土盖灭)
3、与酸反应:2Na + 2HCl == 2NaCl + H2↑(比水更剧烈)
小练:
1、将一小块新切的不规则形状的金属钠投入到滴有酚酞溶液的水中,观察到下列现象,其中可说明钠与水反应放出气体的现象是( )
A、金属钠浮在水面上 B、金属钠形成小球状
C、金属钠在水面上迅速游动 D、反应后的溶液呈现红色
2、将一小块钠投入到盛有煤油和水的试管中(煤油和水均足够多),可以观察到的现象是 ( )
A.钠浮在煤油层上,不反应
B.钠沉在煤油层下,不反应
C.钠沉在煤油层下,浮在水层上,在交界处剧烈反应
D.钠沉在水层下剧烈反应
3、能正确表示下列反应的离子方程式的是( )
A.钠与水反应:2Na+2H2O===2Na++2OH-+H2↑
B.钠与CuSO4溶液反应:2Na+Cu2+===Cu+2Na+
C.钠与盐酸反应:Na+2H+===Na++H2↑
D.钠跟氯化钾溶液反应:2Na+2H2O===2Na++2OH-+H2↑
典型例题:1、将Na、Mg、Al各0.3mol分别放入100ml1mol/L
的盐酸中,同温同压下产生的气体体积比是 ( )
A.1:2:3 B.6:3:2 C.3:1:1 D.1:1:1
2. 金属钠露置在空气中最后生成什么物质?用图表示之。
3、在盛有5mL饱和石灰水的试管中放入一小块块钠,不可能观察到的现象是 ( )
A.钠熔成小球并在液面上游动 B.有气体生成
C.试管底部有银白色物质生成 D.溶液变浑浊
4. 相同质量的铝,分别与足量的强酸、强碱反应,产生氢气体积比为__________.
5. 某无色溶液中放入铝片后有氢气放出,则下列离子在该溶液中肯定可以大量共存的是( )
 A.Na+ B.Mg2+ C.S2- D.HCO3-
A.Na+ B.Mg2+ C.S2- D.HCO3-
6.如图在玻璃管中放入还原铁粉和石棉绒的混合物.加热并通入水蒸气.用试管收集产生的经干燥的气体,并靠近火焰点火。
(1)所观察到的现象是 ____________________,有关反应的化学方程式是 ____________________。
(2) 干燥管内可装入的试剂是___________,其作用是___________。干燥管还可用___________(装置)代替。
(3) 玻璃管中石棉绒的作用是__________________。实验开始时应先点燃____________,实验结束时,应先熄灭____________________。
三、金属氧化物的性质
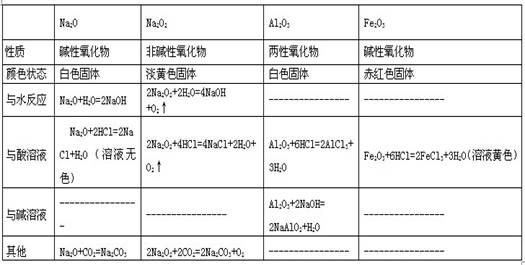
四.金属氢氧化物
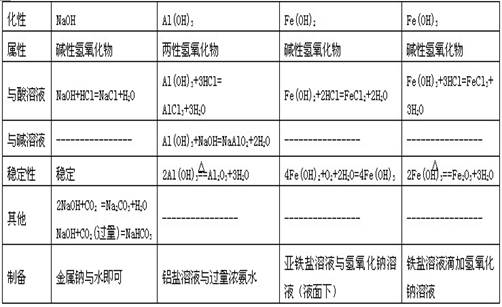
典型例题:1不能用NaOH溶液 除去括号中的杂质的是( )
A. Mg( Al2 03) B.MgCl2( AlC13)
C. Fe(Al) D.Fe2O3( Al203)
2、向Al2(SO4)3溶液中滴加下列试剂,有沉淀产生,且沉淀不会因加入试剂过量而消失的是( )
A、NaOH溶液 B、氨水 C、NaCl溶液 D、BaCl2溶液
3、往100ml 0.1mol/L 的Al2(SO4)3溶液中加入 0.5mol/L的NaOH溶液,得到1.17克沉淀,则加入的NaOH溶液的体积是( ) )
A.70ml B.90ml C . 130ml D.160ml
4、CO和H2的混合气体共3 g,与足量的过氧化钠置于密闭容器中,通入足量氧气用电火花点燃,则固体的质量增加了 ( )
A.3 g B.3.2 g C.4.4 g D.5.6 g
5、在一定条件下,将钠与氧气反应的生成物1.5 9溶于水,所得溶液恰好能被80 ml。浓度为0.50 mol/L的HCl溶液中和,则该生成物的成分是 ( )
A.Na2O B.Na2O2
C.Na2O和Na2O2 D.Na2O2和NaO2
6、在含有Fe3+、Fe2+、Al3+、NH4+的稀溶液中,加入足量的Na2O2固体,充分反应后,再加入过量的稀盐酸,完全反应后,离子数目几乎没有变化的是( )
A.Fe3+ B. Al3+ C. NH4+ D .Fe2
五、盐
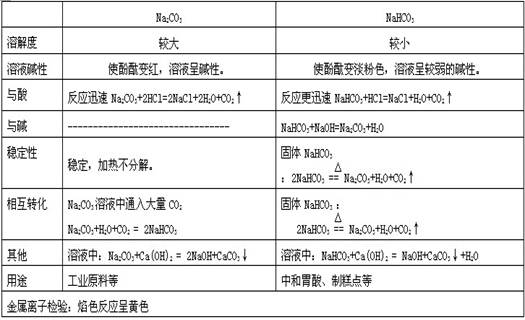
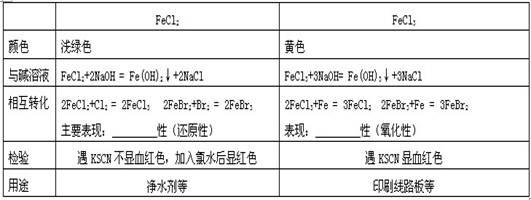
典型例题:1.下列物质中能通过化合反应制取的是( )
①Fe3O4 ②Fe(OH)3 ③FeCl2 ④FeCl3
A.①④ B.①②④ C.①③④ D.①②③④
2.下列物质跟铁反应后的生成物与KSCN溶液作用一定会产生红色溶液的是( )
A.盐酸 B.Fe2(SO4)3溶液 C.氯气 D.CuSO4溶液
3.在电子工业中,制印刷电路时,常用氯化铁溶液作为铜的“腐蚀液”,该过程发生的反应为:2FeCl3+Cu=2FeCl2+CuCl2。该反应利用了铜的什么性质 ( )
A .氧化性 B.还原性 C.导电性 D. 导热性
4. 在FeCl3、CuCl2的混合溶液中,加入一定量的铁屑,反应完全后将固体滤出,下列说法中正确的是( )
A .若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe2+,一定不含Cu2+ ;
B.若滤出的固体中含有铁和铜,则溶液中一定含有的阳离子是Fe2+,一定不含Cu2+和Fe3+
C.若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe2+,可能含有Cu2和Fe3+
D.若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe3+和Fe2+,一定不含Cu2
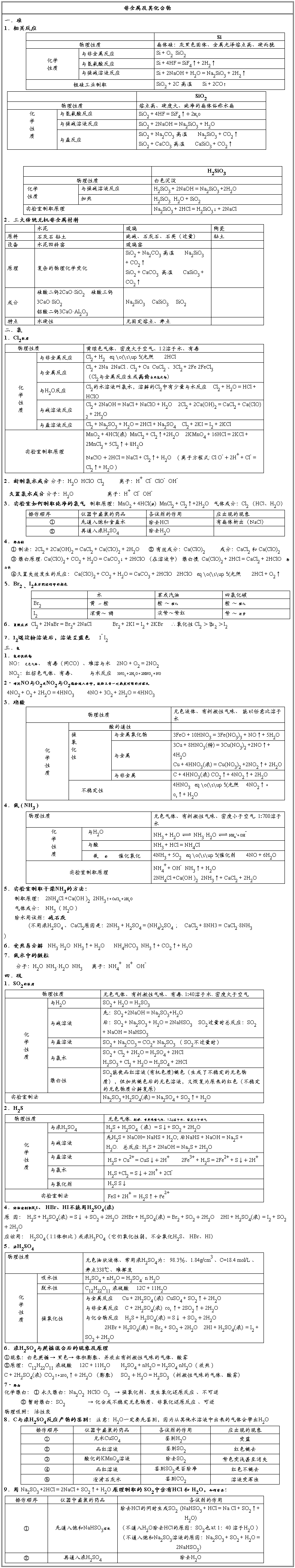
课后练习题:
1.下列实验能证明某无色气体为SO2的是( )
①能使澄清石灰水变浑浊 ②能使湿润的蓝色石蕊试纸变红
③能使品红溶液褪色,加热后又显红色
④能使溴水褪色,再滴加酸化的BaCl2溶液有白色沉淀产生
A.①②③④ B.①③④
C.③④ D.②③④
2.为了加速漂白粉的漂白作用,最好的方法是( )
A.加入苛性钠溶液 B.用水湿润
C.加少量稀盐酸 D.加热干燥使用
3.下列化学反应的离子方程式正确的是( )
A.在稀氨水中通入过量CO2:NH3·H2O+CO2===NH4++HCO3-
B.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-===CaSO3↓+2HClO
C.用稀HNO3溶解FeS固体:FeS+2H+===Fe2++H2S↑
D.氢氧化钙溶液与等物质的量的稀硫酸混合:
Ca2++OH-+H++SO42-===CaSO4↓+H2O
4.在不同的化学反应里,既能表现酸性,又能表现氧化性和还原性的酸是( )
A.浓H2SO4 B.HNO3
C.HCl D.H2O
5.请用下列装置设计一个实验,证明Cl2的氧化性比I2的氧化性强。

请回答下列问题:
(1)若气流从左到右,则上述仪器的连接顺序为D接E,____________接____________,____________接__________。
(2)圆底烧瓶中发生反应的化学方程式为__________________________。
(3)证明Cl2比I2的氧化性强的实验现象是____________________________,反应的离子方程式是__________________________。
(4)装置②的作用是__________________。
(5)若要证明Cl2的氧化性比Br2强,则需做的改动是__________________________。
5.黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。
(1)冶炼铜的反应为8CuFeS2+21O28Cu+4FeO+2Fe2O3+16SO2。若CuFeS2中Fe的化合价为+2,则反应中被还原的元素是__________(填元素符号)。
(2)对上述冶炼过程中产生的大量SO2,下列处理方案中合理的是__________(填字母)。
a.高空排放 b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO3
(3)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。
炉渣NaOH溶液,过滤Ⅰ沉淀盐酸、H2O2Ⅱ溶液NaOH溶液ⅢFe(OH)3△ⅣFe2O3
①步骤Ⅰ中发生的两个反应的离子方程式分别为
____________________________________________、
____________________________________________。
②步骤Ⅱ的目的是将铁的氧化物溶解并将Fe2+氧化成Fe3+,则Fe2+发生氧化反应的离子方程式为________________________________________________________________
