纳米氧化锌的制备
实验报告
班级:应101-2
组号:8
组员:
指导老师:
一、实验目的
1.了解ZnO的广泛用途,良好性能及主要应用;
2.初步学会ZnO的评价和表征;
3.掌握从硫酸锌溶液中,除去铁、铜、镍和镉等杂质离子的原理和方法;
4.运用无机化学基本原理和知识,查阅相关资料,提高综合运用所学知识解决实际问题的能力;
5.初步了解ZnO的工业生产并培养经济成本意识和环保意识。
二、实验原理
氧化锌(ZnO),俗称锌白,相对分子质量81.39,是锌的一种氧化物,白色或浅黄色微细粉末。难溶于水,可溶于酸和强碱。氧化锌是一种常用的化学添加剂,易分散在橡胶和乳胶中,是天然橡胶、合成橡胶的补强剂,活性剂及硫化剂,也是白色胶料的着色剂和填充剂。胶料中加入活性氧化锌后,能使橡胶具有良好的耐磨性,耐撕裂性和弹性。在化妆品中添加活性氧化锌,既能屏蔽紫外线起到防晒作用,又能抗菌除臭。因此氧化锌广泛地应用于塑料、硅酸盐制品、合成橡胶、润滑油、油漆涂料、药膏、粘合剂、食品、电池、阻燃剂等产品的制作中。
氧化锌的能带隙和激子束缚能较大,透明度高,有优异的常温发光性能,在半导体领域的液晶显示器、薄膜晶体管、发光二极管等产品中均有应用。此外,微颗粒的氧化锌作为一种纳米材料也开始在相关领域发挥作用。
活性氧化锌和普通氧化锌在化学成分上是相同的,它们的差异主要表现在物理性质上。活性氧化锌具有力度小、比表面积大、荧光性、压电性以及较强的吸水性和散射紫外线能力等许多独特的物理、化学性质,因此显示出优越的性能和广泛的应用前景。
氧化锌的制备方法有很多,工业上常用氢氧化锌、碳酸锌或碱式碳酸锌分解法。本实验以锌焙砂(主要成分为氧化锌、锌并含有少量铁、铜、铅、镍、镉等杂志,杂志均以氧化物形式存在)和硫酸为主要原料,制备七水合硫酸锌,以碳酸氢铵为沉淀剂,采用碱式碳酸锌分解法制备活性氧化锌。
硫酸锌或ZnO含量采用配位滴定法测定,用NH3-NH4Cl缓冲溶液控制溶液pH值约为10,以铬黑T为指示剂,用EDTA标准滴定溶液进行滴定,其主要反应如下:
在氨性溶液中:
Zn2++4NH3DZn(NH4)4 2+
加入EBT(铬黑)
Zn(NH4)4 2+ +EBT(蓝色)DZn-EBT(酒红色)+ 4NH3
滴定开始~计量点前:
Zn(NH4)4 2++EDTADZn-EDTA+ 4NH3
计量点时:
Zn-EBT(酒红色) +EDTAD Zn-EDTA+EBT(蓝色)
三、实验仪器试剂
1.仪器
分析天平、电子天平、烧杯、洗瓶、玻璃棒、滤纸、抽滤装置、pH试纸(1~14)、
蒸发皿、表面皿、锥形瓶(250ml)、石棉网、电炉、水浴锅、烘箱、锥形瓶、容量瓶、胶头滴管、碱式滴定管、筛子
2.试剂
锌焙砂10g、H2SO4 (3mol/L)、HCl(6mol/L)KMnO4 (0.1mol/L)、锌粉0.1g、NH4HCO3 (s)、氧化锌粉末、EDTA二钠盐标准滴定溶液、铬黑T指示剂、NH3?H2O、NH3-NH4Cl缓冲溶液、Ag、AgNO3、水合肼、凡士林、TiO2、CaCO3、滑石粉
四、实验步骤
1.酸解
(1)称取10g锌焙砂于锥形瓶中,加入35ml 3mol/L的 H2SO4 ;
(2)放在80℃水浴锅中加热约50min,加热过程中隔二三分钟摇晃锥形瓶,直至锥形瓶中有极少量残渣,反应停止;
(3)加15ml去离子水,加热煮沸后过滤,若滤纸上还有未反应完的原料,称重并记录数据
2.除Fe
(1)在硫酸锌溶液(粗溶液)中滴加0.1mol/L的KMnO4至颜色不再消失为止;
(2)调节pH值:加入0.5g左右氧化锌粉末,至用pH试纸测得溶液pH达到4~5,加入的氧化锌粉末要计量称重;
(3)溶液煮沸3min后,减压过滤;
3.除重金属
(1)过滤后的溶液加入锌粉0.1g;
(2)80℃水浴锅加热,不断搅拌10min;
(3)过滤;
4.制备ZnO
(1)在上述溶液中加入蒸馏水稀释至100ml,然后在低于35℃下,加入9g NH4HCO3 (分批加入),不断搅拌10min;
(2)减压过滤,充分洗涤滤饼;
(3)将洗涤后的滤饼在烘箱内240℃烘干;
(4)将干燥后的半成品放入高温炉里煅烧2h;
(5)去除成品氧化锌,冷却至室温,称重;
5.定量分析
产品含量的测定:精确称取0.40~0.41g产品ZnO,用6mol/L的HCl溶解,然后定容至250ml容量瓶中,取25ml溶液,用10%氨水调pH值7~8,加入NH3-NH4Cl缓冲溶液调pH≈10,加入两滴铬黑T指示剂,摇匀,用用已经标定好的EDTA溶液滴定至终点,平行测定两次,同时做空白试验。
6. ZnO的用途
(1)除异味的药水
称取一定量的ZnO产品,按照ZnO:Ag为50:1的比例加入0.05mol/L AgNO3 溶液,水浴上挥发至干,然后加入3ml水合肼,水浴挥发至干,得到干的产品,即ZnO表面附上了一层银。
用得到的产品配成5%的水溶液,即得到除异味的药水。
(2)治疗脚气的药膏
用前一步得到的一定量的产品与凡士林混合,得到治疗脚气的药膏。
(3)防晒粉
按照ZnO:TiO2:CaCO3:滑石粉为0.4:0.6:1:3的比例混合后,在研钵里研磨几分钟,然后过筛,得到防晒粉。
五、实验现象及数据记录
1.实验数据记录及处理
(1)ZnO的制备

产量计算:m(ZnO)=m(产品)-m(添加ZnO)
=(2.19-2.0)g
=0.19g
m(锌焙砂)实=m(锌焙砂)—m(杂质)
=(10.0-0.45)g
=9.55g
产率= m(ZnO)/m(锌焙砂)实×100%
=0.19/9.55×100%
=1.68%
(注:半成品氧化锌ZnO在高温炉里煅烧时盛放在表面皿里在加热过程中炸裂,向外取的过程中洒在了地上,致使产品大量减少)
(2)ZnO含量的测定
mZnO=0.4004g
CEDTA=0.01795mol/L

根据ZnO:EDTA=1:1
VEDTA平均=1/2×(26.25+26.30)—0.05=26.23ml
mZnO纯=81.39×(0.01795×26.23×10-3)×10=0.3832g
ZnO含量=0.3832/0.4004×100%=95.70%
(3) ZnO的应用
制备脚气治疗产品及除异味用液体喷剂:
mZnO=1.36g
V(AgNO3溶液(0.05mol/L))=7.25ml
V(水合肼)=3ml
制备防晒粉:
mZnO=0.4025g mTiO2=0.6055g
mCaCO3=1.0g m滑石粉=3.0g
2.实验现象记录
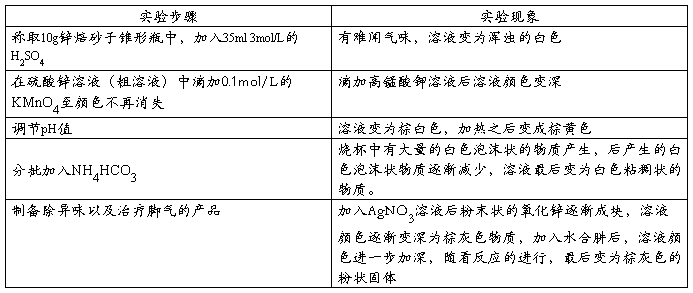
六、注意事项
(1)蒸馏水的质量是否符合要求,是配位滴定应用中十分重要的问题:
①若配制溶液的水中含有Al3+、Cu2+等,就会使指示剂受到封闭,致使终点难以判断;
②若水中含有Ca2+、Mg2+、Pb2+、Sn2+ 等,则会消耗EDTA,在不同的情况下会对结果产生不同的影响。因此,在配位滴定中,必须对所用的蒸馏水的质量进行检查,为保证质量,经常采用二次蒸馏水或去离子水来配制溶液。
(2)EDTA溶液应当贮存在聚乙烯塑料瓶或硬质玻璃瓶中,若贮存于软质玻璃瓶中,会不断溶解玻璃中的Ca2+ 形成CaY2- ,使EDTA的浓度不段降低。
(3)金属指示剂往往是有机多元弱酸或弱碱,兼具pH指示剂之功能,因此,使用时必需注意选择合适的pH范围。
七、思考题
1.用KMnO4溶液除铁过程中,理论上PH应控制在什么范围?你认为在实际生产过程中应控制在什么范围?若溶液PH低于或高于你想要的PH范围,应如何处理?
答:
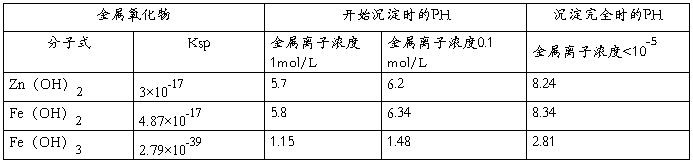
理论上要使Fe3+完全沉淀而Zn2+不至于形成沉淀,pH应控制在3.2~5.28之间。实际生产中PH应控制在5.0~5.4;因为酸度太高会严重腐蚀生产设备。若溶液的pH低于想控制的范围可以加入适量 的ZnO调节,若高于想控制的范围,可加入适量的稀硫酸调节。
2. KMnO4的量如何控制?若不小心加入的KMnO4过量太多,应如何处理?
答:在Zn2SO4粗溶液中逐滴加入KMnO4溶液并震荡,滴至溶液呈微红色。若不小心加入的KMnO4过量太多,应加入适量的H2O2,发生反应:
2 MnO4-+5 H2O2+6H+→5O2↑+2Mn2++8H2O
3.除铁过程中是否需要加热?原因何在?
答:需要。因为氢氧化铁胶体抽滤时易堵塞滤纸,加热可使氢氧化铁聚沉。
4.用KMnO4氧化Fe2+为Fe3+时,在酸性和微酸性条件下,反应产物是否一样?是写出它们的反应式。
答:反应产物不一样。
在酸性条件下:5Fe2+ + MnO4- + 8H+ =5Fe3+ + Mn2+ + 4H20
在微酸性条件下:3Fe2+ + MnO4- + 4H+ =3Fe3+ + MnO2 + 2H2O
5. 如何定性鉴定硫酸锌溶液中是否存在Fe2+(或Fe3+)和Mn2+?
答:Fe2+,Fe3+:滴加稀HNO3酸化,加入KSCN溶液,如果变为红色,存在Fe2+或Fe3+。
6.用锌粉置换法除去硫酸锌溶液中的Cu2+、Cd2+和Ni2+时,如果检验Ni2+已除尽,是否可以认为Cu2+、Cd2+也已除尽?
答:查表比较EZn2+/Zn、ECd2+/Cd、ENi2+/ni、ECu2+/Cu的大小,就能看出锌粉加入后能否除去杂质。然后再从组成原电池E的比较、确定离子的还原次序。
查表得:E(Zn2+/Zn)= 0.7628 V ;E(Cd2+/Cd) = 0.4026 V ;E(Ni2+/Ni) = 0.23 V E(Cu2+/Cu)= +0.3402 V
从标准电极电位的数值可知:E(Zn2+/Zn)<E(Cd2+/Cd)<E(Ni2+/Ni)<E(Cu2+/Cu)
这里锌为较强的还原剂,而Cd2+、Ni2+、Cu2+为较强的氧化剂,所以下列除杂离子的氧化还原反应是可以进行的。
Zn + Cd2+ = Zn2+ + Cd
Zn + Ni2+ = Zn2+ + Ni
Zn + Cu2+ = Zn2+ + Cu
同时反应后Zn变为Zn2+ 离子,又不引进新的杂质,因此用锌粉除杂质离子是较理想的。
由于杂质离子含量相同,可用标准电极电位来判断离子的还原次序。
在铜锌电池中 EMF = E (Cu2+/Cu)- E(Zn2+/Zn )= 0.3402-( -0.7628)= 1.1030 V,在镍锌电池中 EMF= E(Ni2+/Ni)- E(Zn2+/Zn) = 0.23 -(- 0.7628)= 0.5328 V。
在镉锌电池中 EMF= E(Cd2+/Cd)-E(Zn2+/Zn)= 0.4026 -(- 0.7628)= 0.3602 V
EMF铜锌电池>EMF镍锌电池>EMF镉锌电池
所以Zn首先还原Cu2+,其次才是Ni2+、Cd2+,故还原次序为Cu2+、Ni2+、Cd2+。因此检验Ni2+已除尽,不可以认为Cu2+、Cd2+也已除尽。
7.EDTA配位滴定中为什么要使用缓冲溶液?多加缓冲溶液对测定有影响吗?
答:为了控制溶液pH,因为有H+释放,使得H+浓度升高,降低了络合物的条件稳定系数,滴定突越变小,破坏了指示剂变色的最适酸度。所以要加缓冲溶液。若多加缓冲溶液则会影响指示剂到达终点时的灵敏度。
8.在配位滴定中,指示剂应具备什么条件?
答:金属指示剂一般是具有酸碱指示剂性质的染料,同时又是一种配位剂,能与金属离子形成一种与染料本身颜色明显不同的配合物,从而指示滴定终点。
(1)配合物的颜色与指示剂本身必须明显不同
(2)配合物的稳定性要适中
(3)配合物最好能有较好的水溶性
(4)指示剂与金属离子的反应必须迅速,并具有良好的可逆性
9.怎么用氨水溶液(10%)调节溶液PH至7~8?
答:Zn2+和氨水生成了络合物,所以看不到白色沉淀。沉淀要在PH=7左右才会出现,所以滴加氨水的时候速度要慢,要一滴一滴的加,这样才可以看到白色沉淀,继续滴加,当沉淀会消失,PH就已调节到7~8。
10,工业中选取缓冲剂的选择所要考虑的问题?
(1)安全环保
(2)成本核算
(3)考虑缓冲剂是否简易操作,安全。
八、总结
1.实验经济成本计算
按照实验室中的合成过程,将其放大一万倍计算成本如下:
原料成本:锌焙砂10.0g×10000×4元/Kg=400元
H2SO4、HCl、KMnO4、锌粉、NH4HCO3、氧化锌粉末、EDTA二钠盐标准滴定溶液、铬黑T指示剂、NH3?H2O、NH3-NH4Cl缓冲溶液、Ag、AgNO3、水合肼、凡士林、TiO2、CaCO3、滑石粉等等算为100元
水电消耗:水费=0.5t×3元/t=1.5元
电费=5度×1.0元/度=5元
劳动力报酬:6.3元/h×8h×3人=151.2元
收益:3.5g×10-3×10000×25元/kg=875元
利润=收益-原料成本-水电消耗-劳动力报酬=875-400-1.5-5-151.2=317.3元
2.感悟
(1)在除铁的时候,滴加的氧化剂理论上比Eθ(Fe3+/Fe2+)的电动势高就可以工业生产中用H2O2,无任何副产物,而且安全环保、效率高,但是在实验室中终点颜色判断不明显,在实验室还可以用重铬酸钾、O3、Cl2、HClO4、HNO3、CrO2,但是重铬酸钾、CrO2中的铬有毒,具有致癌作用,HClO4 易爆炸,HNO3 产生氮氧化物,污染大气,本实验用的是KMnO4。
(2)除铁过程中调节pH值时,若使用氨水,不仅具有臭味,而且易造成局部温度过高,造成Zn(OH)2沉淀或络合物;本实验加入ZnO和H2SO4反应,当pH达到4~5时(用pH试纸检测),ZnO不与H2SO4 发生反应,Fe在pH=2.6时开始沉淀,从而可以出去溶液中的Fe。
(3)通过本实验初步了解到了工业生产与实验室做实验的差别,实验室注重的是结果,但是在工业生产中要考虑多方面因素,例如成本、环保的问题。
九、附表(产品照片)

第二篇:ZnO的实验报告
实验报告
纳米氧化锌的制备
一、实验目的:
1、了解纳米ZnO的性质及应用。
2、掌握制备纳米ZnO的原理和方法,并比较不同方法的优缺点。
3、掌握检验纳米ZnO光催化性能的一般方法。
4、查阅资料,计算产品的利润。
二、纳米ZnO的性质:
纳米级ZnO同时具有纳米材料和传统ZnO的双重特性。与传统ZnO产品相比,其比表面积大、化学活性高,产品细度、化学纯度和粒子形状可以根据需要进行调整,并且具有光化学效应和较好的遮蔽紫外线性能,其紫外线遮蔽率高达98%。同时,它还具有抗菌抑菌、祛味防酶等一系列独特性能。
纳米ZnO粒子为球形,粒径分布均匀,平均粒径20~30纳米,所有粒子的粒径均在50纳米以下。纳米ZnO粉体的BET比表面积在35m2/g以上。
由于纳米ZnO具有比表面积大和比表面能大等特点,自身易团聚;另一方面,纳米ZnO表面极性较强,在有机介质中不易均匀分散,这就极大地限制了其纳米效应的发挥。因此对纳米ZnO粉体进行分散和表面改性成为纳米材料在基体中应用前必要的处理手段。
三、实验原理:
制备纳米ZnO的方法有很多。按物质的原始状态分为固相法、液相法、气相法3类。固相法包括沉淀法;气相法包括化学气相沉积法、 气相反应合成法、化学气相氧化法、喷雾热分解法; 3液相法包括溶胶—凝胶法、微乳液法、水解加热法、水热法等。
本次试验采用沉淀法制备纳米ZnO。本实验以锌焙砂(主要成分为氧化锌、锌并含有少量铁、铜、铅镍、镉等杂质,杂志均以氧化物形式存在)和硫酸为主要原料,制备七水硫酸锌,以碳酸氢铵为沉淀剂,采用碱式碳酸锌分解法制备活性氧化锌。
四、实验仪器与试剂:
仪器:
分析天平、托盘天平、温度计、蒸发皿、胶头滴管、马弗炉、烧杯、量筒、玻璃棒、恒温水浴锅、布氏漏斗、抽滤机、坩埚、研磨、200目筛子、石棉网、药匙、锥形瓶、洗瓶、滤纸、真空泵、PH试纸。
试剂:
锌焙砂、去离子水、3mol/l硫酸溶液、碳酸氢铵、0.1mol/l高锰酸钾溶液、锌粉、氧化锌、二氧化钛粉、碳酸钙、滑石粉、凡士林、0.05mol/lAgNO3溶液、水合肼。
五、实验步骤:
1、酸解
取10.0g锌焙砂加入到锥形瓶中,加入45ml 3mol/l的硫酸溶液,将锥形瓶放到70℃左右的水浴锅中,并不断搅拌①。反应50min后用布氏漏斗抽滤②,得滤液待用。主要的反应有:
ZnO+H2SO4→ZnSO4+H2O;Fe+H2SO4→FeSO4+H2↑
2、除铁
(1) 在溶液中加入0.1mol/L的KMnO4溶液并不断搅拌至溶液变为粉红色为止③。主要的反应为:
(2) 加入约3gZnO调节PH值在5~6(大约加入了2.1g),煮沸2~3分钟,用布氏漏斗过滤④,保留溶液待用。
主要的反应为:
2KMnO4+10FeSO4+8H2SO4→K2SO4+2MnSO4+5Fe2(SO4)3+8H2O
Fe2(SO4)3+3ZnO+3H20→3ZnSO4+2Fe(OH)3↓
3、除重金属,制ZnSO4·7H2O
向溶液中加入锌粉0.1g,水浴70℃下不断搅拌,10min后用布氏漏斗抽滤,得到过滤溶液⑤。
4、制备ZnO
(1) 在上述滤液中先加入100ml蒸馏水稀释,在温度小于35℃下分批加入9g NH4HCO3,不断搅拌,加压过滤,充分洗涤滤饼(洗涤2~3次)。
(2) 将洗涤后的滤饼在烘箱内240℃烘干10min,制成半成品。
(3) 将干燥后的半成品放于600℃温度下煅烧2h,得到成品即纳米ZnO⑥(图1所示)。
主要的反应为:
3ZnSO4·7H2O+6NH4HCO3→ZnCO3·2Zn(OH)2·H2O↓+3(NH4)2SO4+5CO2+20H2O
 ZnCO3·2Zn(OH)2·H2O→2ZnO+CO2+4H2O
ZnCO3·2Zn(OH)2·H2O→2ZnO+CO2+4H2O
5、ZnO-Ag的制备
取4.0042g ZnO于坩埚中加入19.8ml 0.05mol的AgNO3溶液(按照物质的量比为Zn:Ag=100:2),然后在水浴上蒸干。再在蒸干后的坩埚中加入3.0ml的水合肼还原Ag+⑦,再在水浴上蒸干得到ZnO-Ag。
6、5% ZnO水溶液的制备
用电子天平称取2.0g负载Ag的ZnO溶解在38ml的去离子水中⑧。
7、药膏的制备
用电子天平称取2.0g负载Ag的ZnO放于表面皿上加入一定量的凡士林搅拌均匀,装入小瓶(图2所示)。
8、防晒霜的制备
分别用天平称取ZnO1.0g、二氧化钛粉末1.2g、碳酸钙2.0g、滑石粉10.0g混合于研钵中研细,用200目的筛子筛选,得到粉末状的防晒霜(图3所示)。
六、实验现象:
①处液体变成灰褐色且不断有气泡冒出。
②过滤后滤纸上出现白色ZnSO4·7H2O晶体,加水后溶解。
③目的是将Fe2+转化为Fe3+。
④目的是出去Fe(OH)3 和 Cu(OH)2。
⑤制备氧化锌抽滤过程后得到乳白色滤饼。
⑥焙烧后得到产品为白色粉末,底部产品略发红(坩埚底部的原因),得到5.5174g纳米ZnO。
⑦加入AgNO3溶液后蒸干得到灰色固体,加入水合肼后蒸干得到青绿色固体。
⑧5%ZnO水溶液中ZnO-Ag主要以固体形式存在。
七、实验数据处理:
(1)、锌焙砂中氧化锌的含量未知,实验过程中用氧化锌调节PH,导致无法准确计算产率。
(2)、成本合算:
锌焙砂产品市场价格走势每吨价格:
通过老师对我们的产品分析后估价为25元/kg,那么我们的产品为25000元/吨。如果每吨除去10000元的其他成本费,并且锌焙砂按6500元/吨,那么每吨的剩余价值就是8500元。如果每个月能产100吨,那么利润为85万,这对于一家企业来说才可以运行。
八、实验小结:
(1)用ZnO调节PH而不用氨水,加氨水容易使PH太高而锌离子沉淀。
(2)AgNO3中Ag+的还原:可以采用紫外光来对银离子还原,但是由于需要紫外光照射时间比较长,所以在本实验我们采用水合肼来还原银离子(水合肼比较廉价)。
(3)5%ZnO水溶液除异味液效果分析:
将其喷入鞋中然后放于太阳光下照射对除异味效果更好(由于ZnO-Ag主要以固体形式存在于水中所以不易喷出,对除异味效果有一定的影响,并且这样的产品不已销售。应考虑溶解性)。
(4)防晒粉效果不明显,可能与近期日照不强烈有关。
九、注意事项:
1.煅烧温度要适当。煅烧温度过高,时间过长,易使产品烧结,影响产品的活性;温度太低,时间过短,又不能使其完全分解。
2.锌焙砂在称取使应尽可能选取颗粒小的,否则影响溶解速度。
3.在抽取滤饼时,由于颗粒较小所以在向布氏漏斗中倒时要注意倒速。
4.在煅烧之前的烘干阶段应经可能使样品中的水分烘干,如果不敢可能影响产品质量。
图1:纳米ZnO

图2:药膏

图3:防晒粉

