实验一利用流动细胞仪测定植物DNA含量
一、实验目的
1、了解流动细胞仪的基本构造、原理与应用。
2、熟悉流动细胞仪的基本操作。
3、学会流动细胞仪样品制备及结果处理。
二、实验原理
单个细胞、细胞群或其他生物微粒经过特异的荧光染料染色(DAPI或PI或免疫荧光标记)之后,在气体压力下,通过样品管引入到喷嘴内形成样品流,样品流经过激光束(488、405等)照射,样品流中的细胞吸收光能后发射出荧光,然后经相应的检测器检测,检测结果以直方图、二维散点图或三维立体图的形式显示出来。根据荧光强度与胞内生物大分子含量的比例关系,对细胞进行定量分析。
三、实验步骤
1、从野外取新鲜幼嫩的叶片(或竹笋) 。
2、将新鲜的叶片(或竹笋)切取1平方厘米大小,放进干净玻璃培养皿中。
3、加入500μL PARTEC公司流式细胞仪自带的cystain UV precise P Nuclei Extraction Buffer滴于样品上。
4、用双面刀片将样品剁碎,核提取2-3分钟。
5、然后再加入2mL 仪器自带的cystain UV precise P stain Buffer进行细胞核染色4分钟。
6、利用移液枪吸取染色后的样品,经公司自带的滤膜过滤到5mL的测量管中,进行测量。
四、实验结果
水稻平均峰值25.25,用所测竹种的数值除以水稻平均峰值25.25就是该竹种的DNA含量所对应的DNA含量。水稻(2C=1pg)
获得类似下图结果

白纹阴阳竹平均峰值为(104.71+108.5+109.37)/3=107.53
白纹阴阳竹DNA含量:2C=107.53÷25.25×1pg=4.26pg
实验二石蜡切片技术
一、实验目的
在有关植物胚胎发育和组织器官的形态建成研究的过程中,都需要应用到石蜡切片技术。在植物杂交育种、作物病虫害防治、药用植物的培育和鉴别,以及林木材性鉴别等方面的研究和教学工作中,由于各作物器官的性质差异以及研究目的的不同,就需要用不同的制片方法。开展本实验,要求学生熟悉石蜡切片从材料固定到材料观察分析的整个石蜡切片的全过程。
二、实验步骤
1、取材与固定
选取新鲜的植物材料,本实验用杨梅雌、雄花,迅速固定于FAA固定液中。
2、脱水
材料→25%酒精→35%酒精→50%酒精→70%酒精→85%酒精→95%酒精→100%酒精1→100%酒精2,每级2h。
3、透明
材料→100%酒精→2/3酒精+1/3二甲苯→1/2酒精+1/2二甲苯→1/3酒精+2/3二甲苯→100%二甲苯1→100%二甲苯2,每级1.5h。
4、浸蜡
倒去部分二甲苯,将材料和少量二甲苯转入35℃恒温箱中,逐渐向装有材料的烧杯中加入碎蜡,12h后更换为纯蜡,同时将恒温箱温度调到58℃,然后每4h更换一次纯蜡,共换3次后静置12h即可包埋。
5、埋蜡
所用石蜡,质地必须纯净透明,溶点通常在48~56℃范围内,以52℃的石蜡用得更多。在材料不硬、天气不热时,宜用较低熔点的蜡。材料硬、天气热的情形下,宜用高溶点的蜡。
石蜡选定后,将石蜡切成小块,置瓷皿中加热溶蜡,待石蜡近于全部熔化时,置于温箱中。封埋过程中,石蜡的温度总以高于溶点2℃为宜,过低石蜡凝固,过高伤害材料。
6、切片与粘片
将含有材料的蜡块修整为长方体,材料处于一端。
安装切片刀,刀的斜度,非常重要,最好先切除的蜡块试刀,以确定刀的斜度,一经调度适合后,就不要随便变动,以免每次试刀的麻烦。
修整蜡块,刀片斜度调好后,将刀片移近蜡块,使小蜡块的下边与刀锋平行,然后把它固定,再转下蜡块.呈矩形才行。只有平整的蜡块,才能切出平整的蜡带。
最后根据需要,调整控制切片厚度的机制。调度后,把它固定下来。上述四步骤完成后,就可进行切片,将切出的蜡带,平展于盒内以供粘片。
粘片时,以记号笔在载玻片上编号,滴加1或2滴1%明胶溶液,用胶头滴管将溶液涂匀,滴加1或2滴展开剂,然后将切好的蜡带平整地放置在溶液上,置烤片机上的烘片台上,使切片展开烫平,材料不现皱纹为度,烤片温度为42℃。1~2min 后用滤纸吸去多余液体,再放置于烘片台上烘烤1~2min,待材料和蜡带干后装入切片盒中。
7、脱蜡
一般粘片后的材料需放置2~3天后方可脱蜡、染色。
将粘有材料的载玻片放入纯二甲苯中,然后逐级过渡到蒸馏水中。
载玻片→100%二甲苯1→100%二甲苯2→1/2二甲苯+1/2酒精→100%酒精1→100%酒精2→95%酒精→85%酒精→70%酒精→50%酒精→蒸馏水,每级5min。
8、染色
本实验选用番红与固绿色法:
番红用l%的水溶液,固绿用0.5%的酒精液(用95%的酒精配制),染色步骤如下:切片在二甲苯中脱蜡(下降至蒸馏水)→1%番红水溶液→50%酒精→70%酒精→85%酒精→0.5%固绿→95%酒精→100%酒精1→100%酒精2→1/2纯酒精+1/2二甲苯→100%二甲苯1→100%二甲苯2,脱水过程停留时间为5min,番红染色时间2~4h,固绿染色时间为20min,固绿染色后的停留时间为10s。
9、胶封
用中性树胶封片。向材料中滴加1~2滴中性树胶,从一端开始逐渐盖上盖玻片,晾干镜检并拍照。
四、实验结果
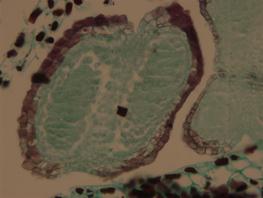
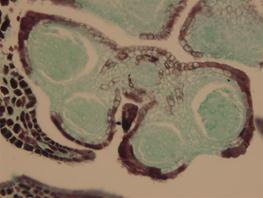
A B
杨梅雄花花药发育不同时期图(20×)
图A为花粉母细胞减数分裂过程中的二分体时期,图B为四分体时期。
实验三 植物染色体标本的制备
一、实验目的
不同植物染色体数目及大小会存在很大的差异,因此针对不同的植物有不同的染色体制备方法,本实验用酶解去壁的染色体制备方法,对毛竹、山核桃染色体进行制备,观察制片效果。
二、实验材料
秋水仙素、8-羟基喹啉、甲醇、乙酸、双蒸水。纤维素酶、果胶酶,均购置sigama公司。
新鲜的毛竹根尖和山核桃茎尖。
三、实验步骤
1、取材
作为染色体研究材料,取材部位必须准确,必须少而精,切忌多而杂,同时材料要新鲜,尽可能保持其生活状态。
2、预处理
采集新鲜的根尖立即放入预处理药品秋水仙素中。预处理时间一般3-4小时为宜。
3、材料固定
将根尖从预处理液中取出,用滤纸吸干,用固定液(甲醇:乙酸=3:1)固定,-20℃冰箱保存。
4、前低渗
将根尖直接从固定液中转入0.075摩/升KCL溶液进行低渗处理,在25℃左右低渗30分钟。可适当提前些时间对材料进行切割,材料切割大小一般控制在1毫米左右。
5、酶解去壁
吸去KCL溶液,加入2.5%的混合酶液,37℃条件下酶解2-3小时,酶解过程中将材料轻轻摇1-2次,使酶液充分起作用。
6、后低渗
吸去酶液,向材料中加入重蒸水轻轻的冲洗2-3次,根据酶解消化的程度,在重蒸水中停留10-30分钟进行后低渗处理。
7、制片
吸出重蒸水,向材料中加入固定液(甲醇:乙酸=3:1),-20℃固定30分钟。取出3-4个根尖置预冷的载玻片上,用镊子迅速夹碎,滴一滴固定液,将载玻片一端抬起,让细胞迅速散开,在酒精灯上烤干。
8、镜检
相差显微镜下镜检制片效果,选取染色体形态比较好,分散比较开的染色体制片进行后续研究。
四、实验结果
在相差显微镜下进行镜检,选取染色体形态比较好、分散比较开的染色体制片保存,以进行后续研究。
实验四 植物染色体C-分带技术
一、实验目的
染色体分带(chromosome banding)是60年代后期发展起来的一项细胞学技术,借助于某些物理、化学处理使中期染色体显现出深浅不同的带纹,各物种的每一条染色体其带纹的数目、位置、宽度及深浅都有相对的恒定性。因此,染色体分带是染色体识别的重要依据。这种技术已经成为鉴别基因组中各个染色体或较大染色体片段、追踪外源染色体的有效手段。
二、设备、药品
1、实验设备
(1)相差显微镜、荧光显微镜,配有显微照相系统。
(2)磁力搅拌器、水浴锅、温度计、计时器。
(3)其它用具:脱水缸、500ml烧杯、三角瓶、漏斗、移液管、吸尔球、镊子、滤纸、吸水纸、容量瓶等。
2、药品
(1)饱和Ba(OH)2溶液(现配现用)、NaCL 、Na3-citraate、盐酸。2×SSC溶液、0.2N HCL。
(2)Giemsa染液母液:购置sigama公司。
(3)二甲苯、镜油。
三、实验步骤
(1)将2N HCL和20×SSC溶液均稀释10倍,分别取出50ml于脱水缸中,置水浴锅中水浴至60℃。
(2)将搅拌好的饱和Ba(OH)2溶液通过漏斗过滤,去除未溶固体Ba(OH)2。
(3)将分散良好的中期染色体制片,在60℃0.2N HCL中酸变性2分钟30秒。
(4)从盐酸中取出,自来水中涮一下,移至饱和Ba(OH)2溶液中碱变性7分钟。
(5)自来水冲洗干净,转入2×SSC溶液中,60℃处理1小时。
(6)将制片转入新配制的Giemsa染液中染色。(一般2小时左右观察一次,看染色体带纹情况及染色速度)。
(7)染色结束后,将制片从染液中取出,气干,滴一滴二甲苯,盖上盖玻片,Olympus BX60显微镜100倍油镜观察拍照。分析带型特征。
四、实验结果
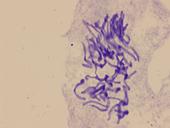
由于各物种的每一条染色体其带纹的数目、位置、宽度及深浅都有相对的恒定性,染色体分带是染色体识别的重要依据,所以可用来鉴别基因组中各个染色体或较大染色体片段、追踪外源染色体。
实验五植物染色体荧光原位杂交技术
一、实验目的
1、了解和掌握荧光原位杂交技术的基本程序
2、学习对荧光原位杂交的结果进行分析
3、掌握荧光原位杂交制片的显微摄影技术
二、实验原理
根据核酸分子碱基互补配对的原则,将有放射性和非放射性的外源核酸探针与染色体上经过变性后的单链DNA在适宜条件下互补配对,结合成专一的核酸杂交分子,再经过相应的检测手段将待测核酸在染色体上的位置显示出来。
三、实验步骤
1、探针标记-标记探针-反应液配制

反应液混匀,放在PCR仪中,15℃温育2小时15分钟,加入Stop buffer(0.5M EDTA)5μl,通过过柱的方法进行探针纯化,纯化后的探针放入-20℃冰箱备用。
2、杂交液配制—探针变性

当加热块温度升至103℃时,将放离心机混匀后的杂交液放置于加热块上变性13min,取下后立即置于碎冰中冰浴至少10min 。
3、杂交-制片变性
(1)制片用RNA酶、胃蛋白酶及多聚甲醛进行预处理,之后,制片在78℃条件下于70%甲酰胺(FA)中变性1分10秒,立即置-20℃的70%、95%、100%酒精中梯度脱水各5分钟,气干。
(2)将杂交液滴加在制片上,盖上18 x 18mm的盖玻片,置于保湿盒(1xPBS)中37℃杂交过夜(时间至少6h)。
4、洗片

DAPI染色(500μl DAPI缓冲液+2.5μl DAPI染液)或PI染色(500μl 1 x PBS缓冲液+1.2μl PI染液)3-4min。
加抗褪色剂(Vectashield)8μl,缓慢盖上22 x 22mm盖玻片,4℃保存或直接于荧光显微镜下镜检,拍照。
四、实验结果

上图为茶秆竹原位杂交图。根据核酸分子碱基互补配对的原则,有放射性外源核酸探针与染色体上经过变性后的单链DNA在适宜条件下互补配对,结合成专一的核酸杂交分子,再经过荧光检测显示出了待测核酸在染色体上的位置,即有荧光标记的位置。
实验六利用荧光染色法测定植物花粉活力
一、实验目的
花粉携带了父本的遗传物质,在被子植物有性繁殖中发挥着重要作用,采集的花粉和储存的花粉在使用前必须做生活力测定。花粉活力测定方法有离体萌发法、荧光染色法、氯化三苯基四氮挫法(TTC)等。本实验主要利用荧光染色(FCR fluorochrome reaction)来测定杨梅的花粉活力,通过本实验让大家学习了解花粉活力的测定方法。
二、实验原理
利用荧光染料本身不产生荧光,无极性,可以自由地透过完整的原生质膜。当荧光染料进入原生质后,被酯酶作用而形成一种能产生荧光的极性物质——荧光素,而荧光素不能自由地出入原生质膜,而只在细胞内积累,可以根据花粉产生荧光的强弱情况判断花粉的生活力强
弱。
三、实验步骤
1、配制母液1 (SSl) : 1. 75mo1/L蔗糖,3. 32mmol/L硼酸,3. 05mmol/L硝酸钙,3.33mmol/L硫酸镁,1. 98mmo 1 /L硝酸钾,蒸馏水定容后,置4℃低温保存备用。另外,为了避免由渗透压引起的花粉破裂,可以适当增加蔗糖浓度,还可以通过增加盐的浓度增强荧光效果。
2、配制母液2 (ss2) : 双乙酸荧光素(fluorescein diacetate)溶于丙酮中,配成浓度为7.2lmmol/L后,置棕色玻璃瓶,4℃低温保存备用。
3、工作液: 使用时,取8 - 12滴SS2于l0m1SSl中,混匀直到混合液变为轻乳状即为工作液。操作时,取2-3滴工作液滴于花粉上,盖上盖玻片,2min后置荧光显微镜下观察即可。
四、实验结果


上图中,绿色荧光强的花粉活力大,荧光弱的则活力小,呈现红色的花粉已失活。
第二篇:实验报告2
南 通 大 学
实 验 报 告 簿
姓名学号
学院班级
实验课程名称
—学期
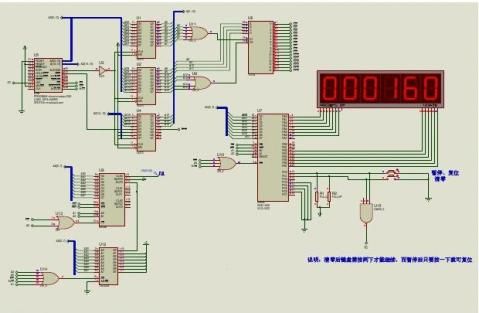
13.2 电 子 秒 表
13.2.1 功能说明
本例综合使用8255A和定时器,实现了电子秒表的计时、暂停和清零功能。
该电路用到的主要仿真原件清单:
QTY PART-REFS VALUE CODE
--- --------- ----- ----
Resistors
---------
2 R1,R2 PULLUP
Integrated Circuits
-------------------
3 U1,U2,U4 74273
1 U3 NOT
1 U5 8086
1 U6 74154
1 U7 8255A
1 U8 OR_4
1 U9 8253A
1 U10 OR_3
2 U11,U14 OR_5
1 U12 74LS245
1 U13 OR
1 U15 NAND_3
13.2.2 Proteus 电路设计
本例实现了电子秒表的计时、暂停和清零功能。计时功能由定时器8253控制实现。

13.2.3 代码设计
本例利用8253 实现定时,利用NMI中断,实现了暂停和清零功能,程序代码如下: a1 equ 0000h
b1 equ 0002h
c1 equ 0004h
ctr1 equ 0006h ;8255各端口地址
a2 equ 0200h ;8253计数器0端口地址
ctr2 equ 0206h ;8253控制端口地址
a3 equ 0100h
data segment
; keynum
0EEH,0DEH,0BEH,7EH,0EDH,0DDH,0BDH,7DH,0EBH,0DBH,0BBH,7BH,0E7H,0D7H,0B7H,77H tab db 3FH,06H,5BH,4FH,66H,6DH,7DH,07H,7FH,6FH,77H,7CH,39H,5EH,79H,71H buf db 0,0,0,0
buf1 db 0,0,0,0,0,0,0,0
buf2 db 0,0 ;前为第一开关次数
buf3 db 80 dup(?)
data ends
code segment 'code'
assume ds:data,cs:code
start: mov ax,data
mov ds,ax
;设中段入口地址设置
mov ax,0 db
mov es,ax mov di,08
mov ax,offset intr_key cld
stosw
mov ax,seg intr_key stosw
mov ax,data mov es,ax
;8255写入控制字 mov al,10001001b mov dx,ctr1 out dx,al
n3: call jishu jmp n3
n2: lea si,buf2
mov bh,00h mov bl,1h[si] lea di,buf3 add di,bx
add bl,8
mov 1h[si],bl lea si,buf1 cld
mov cx,8
rep movsb n4: call dis
jmp n4
n5: lea si,buf2
mov bh,00h mov bl,1h[si] cmp bl,0
jz n1
lea di,buf1
sub bl,8
mov 1h[si],bl lea si,buf3
add si,bx
cld
mov cx,8
rep movsb
n6: call dis
jmp n6 ;A口B口输出显示,C口高四位低四位输入
n1: call qinlin
jmp n1
;jmp start
jishu proc near ;计数子程序 lea si,buf
mov bl,[si] cmp bl,100 jnz s6
s1: mov bl,0
mov [si],bl mov ah,1h[si] cmp ah,59 jz s2
inc ah
mov 1h[si],ah jmp s6
s2: mov ah,0
mov 1h[si],ah mov ah,2h[si] cmp ah,59 jz S4
inc ah
mov 2h[si],ah jmp s6
s4: mov ah,0
mov 2h[si],ah mov ah,3h[si] cmp ah,23 jz s6
inc ah
mov 3h[si],ah s6:call chu
mov cx,3
s5:call dis
loop s5
call delay1s inc byte ptr[si] ret
jishu endp
chu proc ;rukou al push si
push bx ;数处理子程序
mov bl,4 lea di,buf1 lea si,buf next:lodsb
mov ah,00 mov cl,10 div cl xchg ah,al stosb mov al,ah stosb dec bl jnz next pop bx pop si ret
chu endp
dis proc near push bx push cx lea bx,tab lea di,buf1 mov cx,8 mov ah,7Fh loop1: mov al,[di] xlat mov dx,a1 out dx,al mov dx,b1 mov al,ah out dx,al mov bh,1 call delay call qp lea bx,tab ror ah,1 inc di
loop loop1 pop cx pop bx ret dis endp
;显示buf1中的值;换码
delay1s proc near ;8253延时子程序
push dx
push ax
mov dx,ctr2 ;8253 kongzi
mov al,00110000b
out dx,al ;8253计数器0控制字 方式0 out端作为中断请求信号 mov dx,a2
mov al,01h
out dx,al
mov al,00h
out dx,al
mov dx,a3
M1: in al,dx
test al,01h
jz M1
pop ax
pop dx
ret
delay1s endp
qp proc near ;清频子程序
mov al,0ffh
mov dx,b1
out dx,al
ret
qp endp
delay PROC NEAR ;内部延时之程序
PUSH bx
PUSH CX
wait0: MOV CX,06h
wait1: LOOP wait1
DEC bh
JNZ wait0
POP CX
POP bx
RET
delay ENDP
intr_key proc near ;中断服务子程序
call key
test al,2h
jz n1
test al,4h
jz n5
lea di,buf2
mov bh,[di]
inc bh
mov [di],bh
test bh,1h
jnz n2
jmp n3
iret
intr_key endp
qinlin proc ;键盘清零子程序 mov ax,0 lea di,buf
mov cx,14
cld
rep stosb
call dis
qinlin endp
key proc ;读取键盘程序 mov dx,c1
in al,dx
ret
key endp
code ends
end start
13.2.4 仿真分析与思考 本实例电路的仿真运行结果