实验一 溶解度实验
一、实验目的
掌握不同的溶剂对有机化合物进行分组的方法
二、实验原理
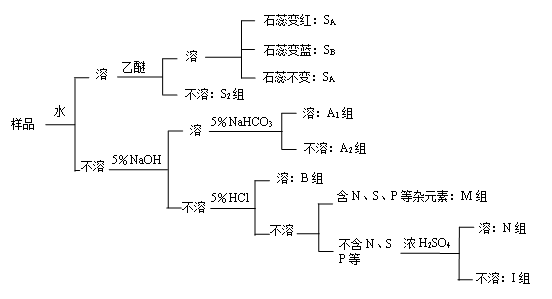
利用“相似相溶”原理,根据化合物在水、乙醚、5%NaOH、5%NaHCO3、5%HCl、浓H2SO4这六种溶剂中的溶解行对有机化合物进行分组。
三、仪器及试剂
仪器:干燥试管、试管夹、滴管
试剂:蒸馏水、乙醚、5%氢氧化钠、5%盐酸、5%碳酸氢钠、浓硫酸
乙醇、甘油、环己烯、氯苯、苯甲酸、乙酰苯胺、苯酚、未知物
四、实验步骤
1.水溶度试验
取0.2mL(4~5滴)液体或0.1g固体试样于试管中,加1mL水振荡后,如不溶解可加至3mL观察是否溶解,若液体试样与水分层应注意试样与水的相对密度,固体试样微溶要继续做下面的溶度试验,水溶性试样应用pH试纸试其酸碱性。
2.乙醚溶度试验
若试样溶于水,可做乙醚试验,方法同水溶度试验,但必须用干燥试管及纯净的乙醚。
若试样溶于乙醚列入S1组。
若试样不溶于乙醚列入S2组。
3.5%盐酸溶度试验
取不溶于水而含氮的试样0.1g或0.2mL,分3次加入3mL5%HCl,振荡后,试样溶解的为含氮的碱性化合物,属于B组。可再做5%NaOH的溶度试验,试其是否为两性化合物。
不含氮的水不溶物不必做此试验。
4.5%NaOH溶度试验
取不溶于水和5%HCl的试样0.1g或0.2mL按照上法分3次加入3mL5%NaOH溶液,振荡后溶解者为酸性化合物,可再做5%NaHCO3溶度试验。
5.5%NaHCO3溶度试验
另取溶于5%NaOH试样0.1g或0.2mL按照上法分3次加入3mL5%NaHCO3溶液,振荡(注意观察是否有CO2气体放出)溶解为A1强酸性组,不溶解为A2弱酸性组。
6.浓H2SO4溶度试验
在干燥试管中加3mL冷浓H2SO4,慢慢加入0.1g或0.2mL试样,随时振荡,观察所起变化:是否放热?颜色变化?有无沉淀生成?有无气体放出?溶者为中性化合物属N组不溶者属惰性组I组。
对以上试验均为负性反应,且不含N、S、P等杂元素的化合物列为惰性化合物属I组。
以(1)乙醇、(2)甘油、(3)环己烯、(4)氯苯、(5)苯甲酸、(6)乙酰苯胺、(7)苯酚为例下表列出溶度测定试验的报告格式:
表1-3 试验报告表

注:表中“+”表示溶解;“-”表示不溶解;若介于溶解和不溶解之间的现象,则用符号“±”表示;“/”表示不需试验的项目。
五、注意事项
1. 实验时溶剂必须按顺序进行,不能前后颠倒。当试样找到溶解度组后不再试验其在其它溶剂中的溶解情况。
2. 所有实验均在室温下进行,不能加热。
3. 如果溶质与溶剂发生作用,不论是否形成均匀溶液,均认为溶解。
4. 注意两性物质。
六、实验讨论
1. 水溶性化合物以pH试纸试酸碱性。
2溶质在非反应性溶剂中溶解度的大小,主要取决于溶质分子之间,溶剂分子之间及它们相互之间作用力的大小。溶质与溶剂的极性愈相近,则该溶质在该溶剂中的溶解度愈大;反之,溶解度就愈小。
3. 在有机化合物的分子中引入卤原子后,卤代物的水溶性随卤素相对原子质量的增大而减小。往往成为难溶于水或不溶于水的化合物。
4. 形成氢键的效应,对于化合物在水中溶解度的影响,往往比化合物分子的极性对溶解度的影响更为显著。
5. 含有支链的化合物,分子间的引力减小,溶解度增大。并且支链愈多,溶解度就愈大。
6.通过实验大体确定某物质的组成性质,为其提取或纯化确定条件提供依据。
7.溶质的介电常数愈大它在介电常数大的溶剂中就愈易溶解,溶质的介电常数愈小,则它在介电常数愈小的溶剂中愈易溶解。
8.熔沸点高的化合物,分子间的作用力较大,溶解度较小;熔沸点低的化合物,分之间的作用力较小,溶解较大。
附表:
溶度分组表

第二篇:CO2在水中溶解度的测定 实验报告
CO2在水中溶解度的测定
1.取2000ml蒸馏水,加热至沸腾,加盖放置到室温,备用。
2.制备Ca(OH)2饱和溶液:取11.1gCaCl2和8.0gNaOH,将二者放入500ml大烧杯中,加煮沸的蒸馏水500ml,用玻璃棒搅拌,加盖放置过夜,取上层清液备用。
3.将800ml煮沸过的蒸馏水放入1000ml带塞广口瓶中。如图连接实验装置。锥形瓶A中放入适量煮沸过的蒸馏水,取10.6gNa2CO3和10ml 2%的HCl溶液,将NaCO3放入吸滤瓶中,在吸滤瓶上方放置一只长颈漏斗,迅速将HCl溶液倒入漏斗中,待导管另一端有气流流出时,将橡胶管插入盛有800ml水的广口瓶中,插入水中的导管一端有气泡冒出。待碳酸钠和盐酸反应结束,拆除吸滤瓶,保留锥形瓶A,静置10分钟,把导管移动到水面上方,在A中加入4gNaOH,以吸收广口瓶水面上方未被水吸收的二氧化碳气体,再静置10分钟。拆除锥形瓶A,广口瓶塞上胶塞。
4.取下广口瓶上的胶塞,迅速将150ml氢氧化钙饱和溶液倒入广口瓶中,再迅速盖上胶塞。
5.倒入饱和氢氧化钙溶液后,溶液中有颗粒状沉淀产生。静置,过夜。
6.静置过夜后,广口瓶底有薄薄的白色沉淀,上层为澄清液体。小心地迅速地将上层清液倒出,注意不要干扰到底层沉淀。倒至底层液体约有3-4cm时,停止。
7.准备漏斗和滤纸,过滤剩余液体和沉淀。用煮沸过的蒸馏水反复洗涤滤纸,以洗去附着在碳酸钙上的氢氧化钙。
8.取滤纸放入大烧杯中,在烧杯中滴加10ml36%的盐酸,轻轻摇晃烧杯使沉淀溶解。用镊子将滤纸取出。
9.将烧杯中的液体放入100ml容量瓶中,反复洗涤烧杯。用煮沸过的蒸馏水定容。
10.取适量氯化钙放在蒸发皿上,放入炉中,调节炉内温度至200摄氏度,烘干一小时。
11.取出烘干的氯化钙,称取氯化钙试剂2g,放入1L的容量瓶中,加入
100ml36%的盐酸,用煮沸过的蒸馏水定容。
12.配置标准溶液:取30ml36%的盐酸放入烧杯中,再加入270ml煮沸过的蒸馏水,用玻璃棒搅拌均匀,加盖备用,命名该溶液为H。从1L的容量瓶中用移液管分别取0.5ml,1ml,1.5ml,2.0ml,2.5ml的氯化钙-盐酸溶液至50ml容量瓶中,用上述H溶液定容。标准溶液的浓度分别为0.02g/l,0.04g/l,0.06g/l,0.08g/l,0.10g/l。
13.用原子吸收分光光度计测定试样浓度。得到标准曲线方程y=7.40x-0.046,r=0.996。试样的y值为1.672,可求出x=0.232。即试样浓度为0.232g/l。
14.由上述数据求出,CO2在水中的溶解度为 (0.232*0.1)
/111*44/800=0.0115g/L。
15.理论溶解度为1.96g/L。相差原因为在实验中水中C02没有溶解到饱和。
