均相酸催化蔗糖水解反应
学生姓名: 学号: 20102221234
专 业 : 化学(师范) 年级、班级:
合作者:
实验日期:20##年3月 日指导老师:孙艳辉老师
一、 实验目的
1、根据物质的光学性质研究蔗糖水解反应,测量其反应速率常数。
2、了解旋光仪的基本原理,掌握使用方法。
3、研究不同种类酸催化对蔗糖水解反应反应速率常数的影响,验证布朗斯特德定律。
4、研究不同浓度酸对蔗糖水解反应反应速率常数的影响,了解催化剂的比活性概念。
二、 实验原理
1、蔗糖的水解反应和利用旋光法测水解速率常数的原理
蔗糖在水中转化为葡萄糖和果糖:
C12H22O11 + H2O —→ C6H12O6 + C6H12O6
(蔗糖) (葡萄糖) (果糖)
其中, 20℃时,蔗糖的比旋光度〔α〕=66.6°;葡萄糖比旋光度〔α〕=52.5°;果糖的比旋光度〔α〕=-91.9° 蔗糖水解反应,开始体系是右旋的角度大,随反应进行,旋光角度减少,变成左旋。
蔗糖水解反应是一个二级反应,在纯水中此反应的速率极慢,通常在H+催化作用下进行,由于反应时水是大量存在的,尽管有部分水分子参加了反应,仍可近似地认为整个反应过程中水的浓度是恒定的,而且H+是催化剂,其浓度也保持不变。因此,蔗糖转化反应可作为一级反应。
如果以 c 表示到达 t 时刻的反应物浓度,k 表示反应速率常数,则一级反应的速率方程为:
- dc / dt = kt
对此式积分可得:
ln c = - kt + ln c 0
式中 c 为反应过程中的浓度,c 0为反应开始时的浓度。当 c = c 0 / 2 时,时间为 t 1/2,称为半衰期。代入上式,得:
t 1/2 = ln 2 / k = 0.693 / k
测定反应过程中的反应物浓度,以 ln c 对 t 作图,就可以求出反应的速率常数 k。但直接测量反应物浓度比较困难。在这个反应中,利用体系在反应进程中的旋光度不同,来度量反应的进程。
用旋光仪测出的旋光度值,与溶液中旋光物质的旋光能力、溶剂的性质、溶液的浓度、温度等因素有关,固定其它条件,可认为旋光度α与反应物浓度c成线性关系。物质的旋光能力用比旋光度来度量:
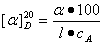
蔗糖的比旋光度[α]D20=66.6°,葡萄糖的比旋光度[α]D20=52.5°,果糖是左旋性物质,它的比旋光度为[α]D20=-91.9°。因此,在反应过程中,溶液的旋光度先是右旋的,随着反应的进行右旋角度不断减小,过零后再变成左旋,直至蔗糖完全转化,左旋角度达到最大。
当t=0时,蔗糖尚未开始转化,溶液的旋光度为:
α0 = β反应物c0 ...... 1
当蔗糖已完全转化时,体系的旋光度为:
α∞ = β生成物c0 ...... 2
此处,β 为旋光度与反应物浓度关系中的比例系数。
时间 t 时,蔗糖浓度为 c,旋光度应为:
αt = β反应物c + β生成物(c0 - c) ...... 3
由1、2式:

由2、3式:
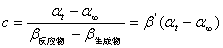
代入 ln c = - kt + ln c 0 式,可得:
ln (αt - α∞) = - kt + ln (α0 - α∞)
根据实验测得的反应过程中的旋光度值计算 ln (αt - α∞),再对时间作图,可得一条直线,根据直线斜率可求得反应速率常数。
2、均相酸催化布朗斯特德定律
在酸催化反应中包含了催化剂分子把质子转移给反应物,因此催化剂的效率常与酸催化剂的酸强度有关。在酸催化时,酸失去质子的趋势可用它的解离常数K来衡量:
HA + H2O = H3O+ + A-
酸催化反应速率常数ka应与酸的解离常数Ka成比例,实验表明,两者有如下的关系:
ka =GaKaα
或 lg ka = lgGa +αlgKa
式中Ga ,α均为常数,它决定于反应的种类和反应条件。
对于碱催化的反应,碱的催化作用速率常数kb同样与它的解离常数Kb有如下的关系:
kb =GbKbβ
式中Gb ,β均为常数,它决定于反应的种类和反应条件。
3、催化剂的比活性
催化活性是指催化剂催化物质发生反应的能力,是催化剂的重要性质之一。物质的催化活性是针对给定的化学反应而言的。通常,催化剂并不按照化学方程式计量关系进行作用,其用量可以是任意的。在相同条件下,反应速率与催化剂用量成正比,在均相催化中可以用生成中间化合物来解释。为了描述不同物质催化活性的差异,工业生产上常以每单位容积(或质量)催化剂在单位时间内转化原料反应物的数量来表示,如每立方米催化剂在每小时内能使原料转化的千克数。对于液相催化反应,通常用速率常数与催化剂浓度之比来表示比催化剂活性。比催化活性表明,催化剂的催化作用取决于其本性,而与用量无关。
三、 仪器药品
旋光仪 1 台; 停表 1 块
锥形瓶(100 ml) 2 个; 移液管(20 ml) 2 支
蔗糖(分析纯);HCl 溶液(6M);HCl 溶液(3M);HAC(4 M);磷酸(4 M);硫酸(4M);
四、实验操作步骤
1.测定不同浓度盐酸(6M和3M) 催化蔗糖水解的速率常数,计算盐酸的比催化活性。
(1)在室温下进行实验。
(2)旋光仪零点校正:开启旋光仪,将光源开关拔至交流(AC),钠灯亮,经 20 分钟预热后使 之发光稳。按测量开关,仪器进入待测状态。将装有蒸馏水的旋光管放入样品测量室,盖好箱盖,待显示读数稳定后,按清零钮完成校零。
(3)6MHCl催化蔗糖水解过程中at的测定:用移液管取30mL蔗糖溶液置于100mL带塞三角瓶中,然后再移取30mL6mol/LHCl溶液于另100mL带赛三角瓶中。将HCl溶液迅速倒入蔗糖溶液中,来回倒三次,使之充分混合。并在加HCl时同时启动秒表以记录反应时间, 立即用少量反应液荡洗旋光管两次,然后将反应液装满旋光管,旋上端盖,外部用滤纸擦干后放进旋光仪内,盖好箱盖,先记下时间,再读取旋光度值。每隔一定时间,读取一次旋光度,开始时,可每3分钟读一次,30min后,每5min读一次。
(4)a∞的测定:将步骤(3)剩余的混合溶液置于近60℃的水浴中,恒温30min以加速反应,然后冷却至实验温度,按上述操作,测定其旋光度,此值即可认为是a∞。
(5)3MHCl催化蔗糖水解过程中at的测定:将步骤(3)的6MHCl换成3MHCl,重复步骤(3)、(4)。
2.测定不同种类酸对催化速率常数的影响,包括HAC(4 M)、磷酸(4 M)、硫酸(4M)、 验证布朗斯特德定律: lg ka = lgGa +αlgKa 。
(6)不同种类酸催化蔗糖水解过程的测定:将6MHCl分别换成4 MHAC、4 M磷酸、4M硫酸按照步骤(3)测定水解过程中at ,然后再按照步骤(4)测定a∞。
五、数据记录与处理
1、6mol/L HCl催化蔗糖水解数据记录与处理:
(1)蔗糖溶液完全水解旋光度 a∞=-3.680
(2)6mol/L HCl催化蔗糖水解数据记录:
温度:室温 盐酸浓度:6mol/L
表1 6mol/L HCl催化蔗糖水解数据记录

(3)以ln(at-a∞)对t作图如图1:
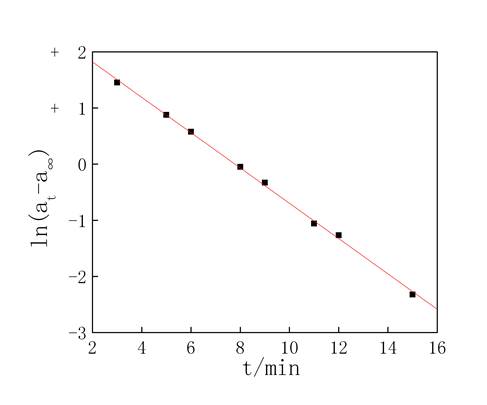
图1 6mol/L HCl催化蔗糖水解
由图1得ln(at-a∞)对t所做图的直线为ln(at-a∞)=2.4483-0.3145t R2=0.9987可见直线的斜率为-0.3145,则反应的速率常数为0.3145。
2、3mol/L HCl催化蔗糖水解数据记录与处理:
(1)蔗糖溶液完全水解旋光度 a∞=-3.210
(2)3mol/L HCl催化蔗糖水解数据记录:
温度:室温 盐酸浓度:3mol/L
表2 3mol/L HCl催化蔗糖水解数据记录
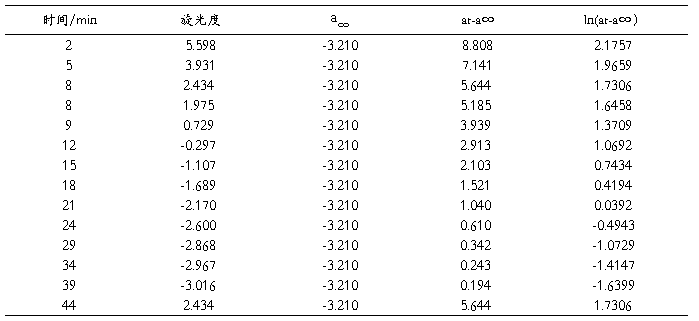
(3)以ln(at-a∞)对t作图如图2:
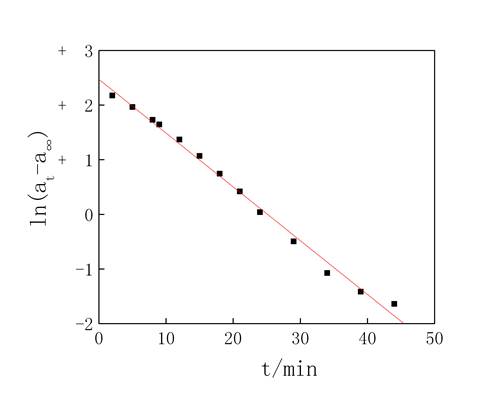
图2 3mol/L HCl催化蔗糖水解
由图2得ln(at-a∞)对t所做图的直线为ln(at-a∞)=2.4716-0.0984t R2=0.9934可见直线的斜率为-0.0984,则反应的速率常数为0.0984。
3、4mol/L H2SO4催化蔗糖水解数据记录与处理:
(1)蔗糖溶液完全水解旋光度 a∞=-3.650
(2)4mol/L H2SO4催化蔗糖水解数据记录:
温度:室温 硫酸浓度:4mol/L

表3 4mol/L H2SO4催化蔗糖水解数据记录
(3)以ln(at-a∞)对t作图如图3:
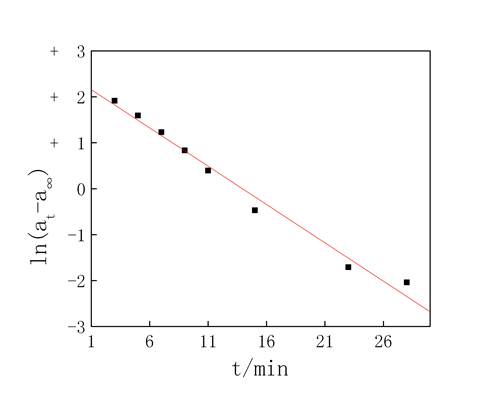
图3 4mol/L H2SO4催化蔗糖水解
由图3得ln(at-a∞)对t所做图的直线为ln(at-a∞)=2.3248-0.1668t R2=0.9838可见直线的斜率为-0.1668,则反应的速率常数为0.1668。
4、4mol/L H3PO4催化蔗糖水解数据记录与处理:
(1)蔗糖溶液完全水解旋光度 a∞=-3.714
(2)4mol/L H3PO4催化蔗糖水解数据记录:
温度:室温 磷酸浓度:4mol/L
表4 4mol/L H3PO4催化蔗糖水解数据记录
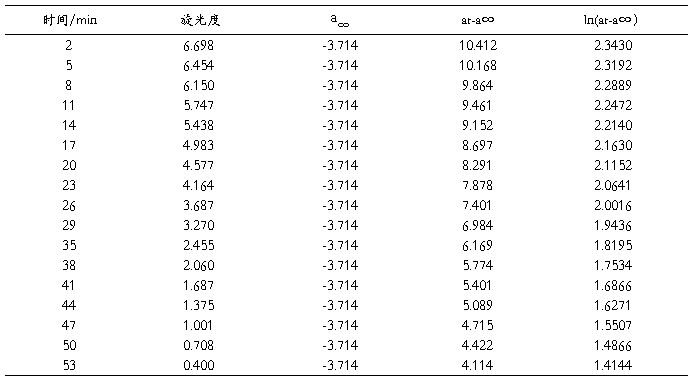
(3) 以ln(at-a∞)对t作图如图4:
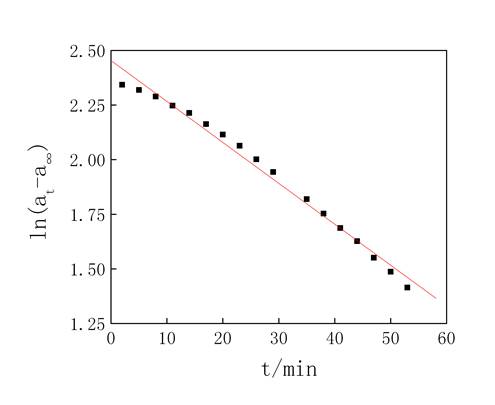
图4 4mol/LH3PO4催化蔗糖水解
由图4得ln(at-a∞)对t所做图的直线为ln(at-a∞)=2.4538-0.0187t R2=0.9883可见直线的斜率为-0.0187,则反应的速率常数为0.0187。
5、4mol/L HAC催化蔗糖水解数据记录与处理:
(1)蔗糖溶液完全水解旋光度 a∞=0.472
(2)4mol/L HAC催化蔗糖水解数据记录:
温度:室温 醋酸浓度:4mol/L
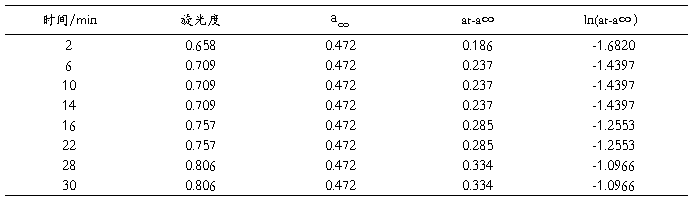
表5 4mol/L HAC催化蔗糖水解数据记录
(3)以ln(at-a∞)对t作图如图5:
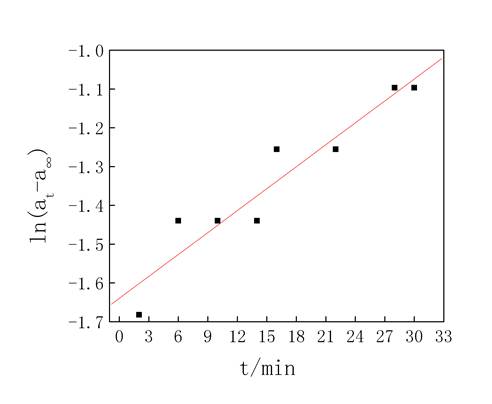
图5 4mol/LHAC催化蔗糖水解
由图5得ln(at-a∞)对t所做图的直线为ln(at-a∞)=1.6397+0.0188t R2=0.9046可见直线的斜率为0.9046,则反应的速率常数为-0.9046。
通过实验求得的醋酸的反应速率常数-0.9046<0,可见醋酸对蔗糖的催化基本不起作用,而由于仪器本省的误差,导致旋光度的数值反而偏大,所以测得的反应速率常数反而小。
7、布朗斯特德定律的应用:
由于醋酸基本对蔗糖水解基本不起作用,而且由于实验条件的限制导致数据不理想,所以仅用硫酸和磷酸两组数据来计算Ga、a。查阅硫酸和醋酸的解离常数,其中磷酸只考虑一级电离,所得数据如下表:
表6 硫酸、磷酸相关数据

按照公式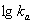 =lgGa+algKa作图,如下图6:
=lgGa+algKa作图,如下图6:
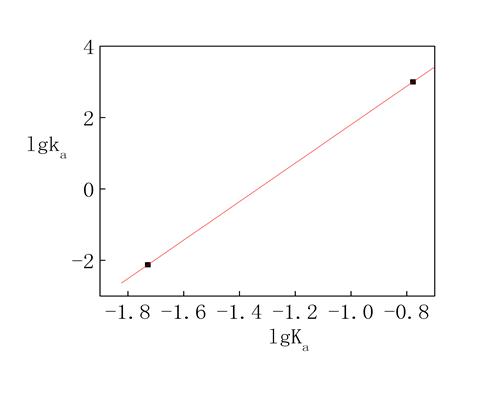
图6 蔗糖在硫酸、磷酸水解过程中,布朗斯特德关系图
由图6可知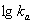 =7.1935+5.3914lgKa,则Ga=7.1935,a=5.3914。
=7.1935+5.3914lgKa,则Ga=7.1935,a=5.3914。
8、不同浓度盐酸条件下的比催化活性:
用不同浓度盐酸的反应速率常数除于盐酸浓度求得比催化活性,如下表7:
表7 不同盐酸浓度的比催化活性
根据lgk=lgk'-pH做图得图7:
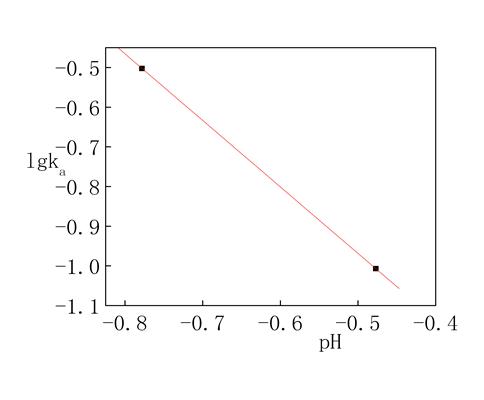
图7 不同盐酸浓度的比催化活性
由图7所得的不同盐酸浓度的比催化活性得:lgk=-1.8068-1.6763pH
9、不同酸根离子的比催化活性比:
计算硫酸的比催化活性与盐酸比较,如下表8:
表8 不同酸根离子比催化活性的比较
七、分析与讨论
1、不同浓度盐酸比催化活性:
催化活性是指催化剂催化物质发生反应的能力,是催化剂的重要性质之一。为了描述液相催化反应催化活性的差异,通常用速率常数与催化剂浓度之比来表示比催化剂活性。
由表7、图7得出的不同浓度盐酸的比催化活性基本相同,(在实验允许误差之内),所以比催化活性表明,催化剂的催化作用取决于其本性,而与用量无关。
加大酸的浓度可以加快反应速率,但是并不是酸的浓度越高越好,因为酸的浓 度过大可能使得逆反应加快反而减慢反应速率。
2、不同酸根离子比催化活性比较:
通过表的数据,可见均相酸催化蔗糖中酸根离子不影响催化,只与氢离子的浓度有关,故硫酸也使用公式:lgk=lgk'-pH。
3、催化反应的酸强度敏感:
布朗斯特德定律: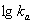 =lgGa+algKa其a 值为0~1。根据表6、图6可得蔗糖在硫酸和硫酸遵循布朗斯特德定律,且:
=lgGa+algKa其a 值为0~1。根据表6、图6可得蔗糖在硫酸和硫酸遵循布朗斯特德定律,且: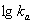 =7.1935+5.3914lgKa,即a=5.3914,接近1,表明蔗糖的水解对催化剂强度敏感,只有强酸才能催化该反应,这与实验所得结论是一样的。
=7.1935+5.3914lgKa,即a=5.3914,接近1,表明蔗糖的水解对催化剂强度敏感,只有强酸才能催化该反应,这与实验所得结论是一样的。
实验中,利用相同浓度不同强度的酸催化蔗糖的水解反应,实验所得的各种酸的反应速率常数如下表9:
表9 不同强度酸的催化反应速率常数

实验得出酸强度最强的硫酸反应速率最大,次之是中强酸磷酸,醋酸基本不起催化作用。
4、蔗糖水解反应:
观察图1~4,可见以ln(at-a∞)对t做图,并不是完全的直线,而是有稍稍的弯曲,这是因为蔗糖浓度比较高,水的浓度无法远远大于蔗糖的浓度,不属于稀溶液的范畴,因此不可以看成是一级反应,因此是弯曲的线。
5、实验中,在测6MHCl的a∞时候发现其右旋性比at 还要厉害,分析原因可能是由于仪 器所造成的,这也可以从测定醋酸旋光性的时候看出,数值普遍右旋,另外也有可能是由于副反应的发生,具体什么产物我没查到,但是实验中确实观察到加热后的溶液变黄色了,也就是说蔗糖除了苷键锻炼还有其他。
八、注意事项
1、本实验均在室温条件下操作。
2、因反应液为酸性,测量旋光度之前,切记将旋光管外侧的液体擦拭干净,以免腐蚀仪器。
九、思考题
1、为什么可以用蒸馏水校正仪器零点?
答:主要是因为蒸馏水没有旋光性,其旋光度为零,其次是因为它无色透明,方便可 得,化学性质较为稳定。另外实验中的蔗糖溶液是使用蒸馏水来配制,且看成是稀溶液处理。
2、本实验可否不进行零点校正?为什么?
答:实验中所测的旋光度αt可以不校正零点,因为实际上在处理数据时αt-α∞ , 已将系统的零点误差消除掉。
3、为什么配制溶液可用上皿天平称量?
答:蔗糖水解为一级反应,反应物起始浓度不影响反应速度常数,又因为蔗糖浓度大用 量较多,量值的有效数字位数较多,故不需要精确称量,只要用上粗天平称量就可以了。
4、为什么用ln(αt-α∞)对t作图就可得到k1?
答:因为蔗糖转化反应对蔗糖为一级反应,以ln(αt-α∞)对t作图求k,不需要α 0的数值。
5、蔗糖反应是真一级还是假一级反应?
答:蔗糖反应时假一级反应。蔗糖在水中转化为葡萄糖和果糖,反应的方程式是:
C12H22O11 + H2O —→ C6H12O6 + C6H12O6 ,可见蔗糖水解反应是一个二级反应,但由于反应时水是大量存在的,所以尽管有部分水分子参加了反应,仍可近似地认为整个反应过程中水的浓度是恒定的,因此,蔗糖转化反应可作为一级反应。
6、在测量过程中,为什么旋光度逐渐减小?为什么α∞为负值?
答:蔗糖在水中转化为葡萄糖和果糖。蔗糖、葡萄糖为右旋,而果糖为左旋,且果糖的左旋能力比葡萄糖的强。当反应开始时,t=0,溶液只有蔗糖的右旋,旋光度为正值,随着反应的进行,蔗糖溶液浓度减少,葡萄糖和果糖浓度增大,由于果糖的左旋能力强于葡萄糖的右旋。整体来说,溶液的旋光度随着时间而减少。当反应进行完全时,蔗糖溶液为零,溶液中只有葡萄糖和果糖,这时,溶液的旋光度为负值。
九、参考文献
[1] 张 俊,李云平,王保玉.经典物理化学实验-蔗糖转化反应的改进与综合[M]. 博士专 家论坛,6.
[2] 何广平,南俊民,孙艳辉.物理化学实验[M].化学工业出版社, 2008, 170-174.
[3] 傅献彩, 沈文霞, 姚天扬. 物理化学[M]. 高等教育出版社, 2008.
[4] 尚宏利,桑雪梅,李军.酸催化蔗糖水解反应动力学的研究[M].理论与探 索.2007,6:44-45.
