淮 海 工 学 院
综合大实验报告书
题 目: 生物化学大实验
系(院): 海洋学院
专 业: 生物技术
班 级: 生技101
姓 名:
学 号:
20##年12月
酶的特异性及温度、pH对酶活性的影响
班级:生技101 姓名: 学号:
【摘要】
唾液淀粉酶是生物催化剂,在人体内有着重要作用。现代科学研究在酶添加壳聚糖的基础上,开发了一代有创新性的产品—加酵素壳聚糖健康食品。本文通过比较在不同条件下唾液淀粉酶对淀粉的水解情况,进而了解不同温度、pH对酶活性的影响以及酶的特异性。
【关键词】唾液淀粉酶,温度,pH,特异性
1前言
酶[1]是人体内新陈代谢的催化剂,人体内才能进行各项生化反应它们支配着生物的新陈代谢、营养和能量转换等许多催化过程,与生命过程关系密切。酶与一般催化剂的最主要区别就是具有高度的特异性, 即专一性。所谓特异性是指酶对所作用的底物有严格的选择性,即一种酶只能对一种化合物或一类化合物起一定的催化作用。酶的特异性实验是生物化学实验之一,适用于临床、妇产、中医、康复、药学、检验等专业。由于大多数酶是蛋白质,其活性受温度、pH等多种因素的影响。
2材料及方法
2.1材料
主要材料为人的唾液以及淀粉溶液
2.1.1试剂[2]
蒸馏水,
NaCl(分析纯,中国上海试剂一厂),
可溶性淀粉(化学纯,广州医药站化学试剂公司),
蔗糖(分析纯,国药集团化学试剂有限公司),
CuSO4(分析纯,上海试一化学试剂有限公司),
柠檬酸钠(分析纯,中国上海试剂一厂),
无水Na2CO3(分析纯,南京化学试剂一厂),
KI(化学纯,南京化学试剂有限公司),
Na2HPO4·2H2O(分析纯,江苏省连云港市化学试剂厂),
浓HCl(分析纯,南京化学试剂有限公司),
NaOH。
2.1.2配制试剂
①唾液淀粉酶的制备:
用烧杯取蒸馏水或自来水,含于口中,1—2分钟后,吐入50mL烧杯中,备用。
②Benedict试剂
A、取CuSO417.3g溶于100mL热蒸馏水中,冷后稀释至150mL;
B、取柠檬酸钠173g及无水Na2CO3100g,加水600mL加热使之溶解,冷后稀释至850mL;
C、将A液缓慢注入B液中,混匀备用。(可长期保存)。
③pH1.5溶液:
取0.2M Na2HPO4·2H2O溶液41.2mL加入0.1M柠檬酸钠38.8mL,然后用浓HCl调至pH1.5左右;
④pH6.8溶液:
取0.2M Na2HPO4·2H2O溶液61.8mL加入0.1M柠檬酸钠18.2mL;
⑤pH9.8溶液:
取0.2M Na2HPO4·2H2O溶液77.8mL加入0.1M柠檬酸钠2.2mL,然后用0.1MNaOH调至pH9.8左右;
⑥0.3%NaCl的0.5%的淀粉液:
称取可溶性淀粉1.25g、NaCl0.75g于烧杯中,加入200mL水,于电炉上加热,边加热边用玻璃棒搅拌,直至液体澄清。待冷却后转移至250mL容量瓶,定容。
⑦0.5%的蔗糖溶液:
称取蔗糖0.5g,加水溶解,定容至100mL。
⑧KI-I溶液:
称取碘化钾3g溶于蒸馏水中,待全部溶解后再加I1g,振荡溶解,定容至100mL。
2.1.3仪器
试管(8支) 移液管(7支)
胶头滴管,小烧杯(2个,100ml) 大烧杯(1000ml)
BP221S型电子天平 HW·YS型电子恒温水浴(37℃)
A型50Hz 220V—800W双层铁皮电炉 石棉网
pH试纸, 洗耳球
容量瓶 玻璃棒
2.2实验方法
2.2.1酶的特异性
①取两支试管编号1、2,1号加入0.5%的淀粉液2mL,2号加入0.5%的蔗糖液2mL;
②与两支试管各加入制备好的唾液1mL;
③将两支试管同时放入37℃恒温水浴锅中保温;
④15分钟后,取出两试管,各加入Benedict试剂1mL;
⑤将两试管同时放入沸水中煮沸6分钟;
⑥取两支试管,观察记录颜色的变化,并注意是否有红棕色产生。
表1 酶的特异性验证

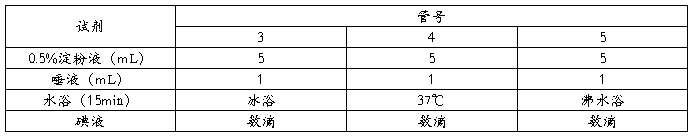
2.2.2温度对酶活性的影响
①取三支试管并编号3、4、5,同时加入5mL0.5%淀粉液及1mL唾液混匀;
②将管3、管4、管5同时分别放入冰浴、37℃水浴、沸水浴中;
③15分钟后,取出各管,分别加入碘液数滴,观察并记录各管颜色变化。
表2 温度对酶活性的影响
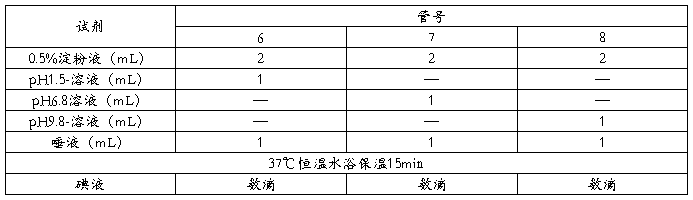
2.2.3pH对酶活性的影响[4]
①取试管3支编号6、7、8,按下表加入试剂;
②3支试管同时放入37℃恒温水浴锅内保温;
③15分钟后,取出3支试管,分别加入碘试剂数滴,每加一滴,注意摇匀,观察并记录颜色变化。
表3 pH对酶活性的影响
3结果与分析
3.1实验结果
3.1.1酶的特异性
实验现象:1号试管经沸水浴后颜色逐渐变为黄色、棕褐色最终变成砖红色并产生砖红色沉淀;2号试管经沸水浴后颜色没有发生变化(仍为浅蓝色)。(如图1)。

图1 酶的特异性
实验现象表明:唾液淀粉酶能水解淀粉,而不能水解蔗糖。说明唾液淀粉酶具有特异性。
3.1.2温度对酶活性的影响[3]
实验现象:3号试管加5滴碘液并混匀后变成深蓝紫色;4号试管加5滴碘液并混匀后变成酒红色;5号试管加5滴碘液并混匀后变成深蓝紫色。(如图2)。

图2 温度对酶活性的影响
实验现象表明:经过冰水浴和沸水浴后,唾液淀粉酶活性降低,不能将淀粉分解成葡萄糖;而在37℃条件下唾液淀粉酶活性较高,将被淀粉分解成葡萄糖。说明温度对唾液淀粉酶活性有一定影响。温度为0℃(低温)条件下酶活性受抑制;温度为100℃(高温)条件下酶变性失活;而37℃(人体正常温度)条件下酶的活性最高。
3.1.3pH对酶活性的影响[4]
实验现象:6号试管逐滴加入3滴碘液并混匀后变成深蓝紫色;7号试管逐滴加入3滴碘液并混匀后变成酒红色;8号试管逐滴加入3滴碘液并混匀后变成深蓝紫色,但颜色浅于6号试管。(如图3)。

图3 pH对酶活性的影响
实验现象表明: pH为1.5(强酸性)条件下,唾液淀粉酶不能水解淀粉;pH为6.8(接近中性)条件下,唾液淀粉酶活性较高,能水解淀粉;pH为9.8(碱性)条件下,唾液淀粉酶不能水解淀粉。说明唾液淀粉酶水解淀粉的最适pH为6.8左右,pH过大或过小都会影响唾液淀粉酶的活性,使其变性失活。
3.2结果分析
本实验研究酶的特异性及温度、pH对酶活性的影响得到以下结果:比较1、2号试管可知,唾液淀粉酶只能水解淀粉而不能水解蔗糖,验证了酶的特异性,与理论相符。比较3、4、5号试管可知,酶的作用活性受温度的影响,只有在特定温度下酶活性最强,低温或高温条件下酶的活性受到抑制,酶作活性最强时的温度为最适温度,唾液淀粉酶的最适温度为37℃。比较6、7、8号试管可知,酶的作用活性受pH的影响,只有在特定pH下酶活性最强,过酸或过碱条件下酶的活性受到抑制,酶作活性最强时的pH为最适pH,唾液淀粉酶的最适温度为6.8。
总体而言,本次实验是比较成功的,实验现象较明显;但在一些方面仍然存在着不足之处:
成功之处:
①实验过程中仪器使用正确,操作正确;
②实验加入试剂准确,按实验步骤进行;
③实验中反应颜色变化较大,实验现象明显。
不足之处:
① 在做温度对酶活性影响实验时,滴加碘液较多,导致颜色较深;
② 配制pH9.8溶液时,加入NaOH过少,导致pH小于9.8,实验结果受影响;
4讨论
通过实验发现唾液淀粉酶具有高度特异性,其活性受温度、pH值等多种因素影响。人体唾液淀粉酶在37℃活性最强,但低温条件下酶活性并没有完全丧失,而是活性受到影响, 0℃ 时酶活性受影响比较大,其活性比较弱;而在高温条件下酶活性丧失。由此可知很多水果、蔬菜中的酶在低温时活性比较低,有利于保鲜。同时发现中性环境中淀粉酶活性最强,这也适应了人的口腔内pH值。
酶在日常生产生活中有着重要作用:由于没得广泛存在,酶的提取与研究成了重要科研课题。在生产上可以用固定化酶酿酒或制作其他食品。研究了温度、pH对酶活性的影响,从而找出酶的最适温度和最适pH,使酶在最是条件下作用,提高生产效率。
5参考文献
[1]郭勇.2005.酶工程原理与技术.高等教育出版社
[2]陈电容.生物化学与生化药品[M].郑州:郑州大学出版社,2004
[3] 刘进增,李为兰.一道关于温度对酶活性影响的实验设计题.生物学通报.2011
[4]许冰,原媛,赵文献.pH值对酶活性影响的实验观察
血红蛋白凝胶过滤层析
班级:生技101 姓名:陈帅 学号:521002101
【摘要】
本实验利用凝胶过滤的特点,先向层析柱中加入FeSO4 溶液,形成一个还原带,然后加入血红蛋白样品(血红蛋白与高铁氰化钾的混合液)。由于血红蛋白分子量大,在凝胶床中流速快,当其流经还原带时,褐色的高铁血红蛋白立即变为紫红色的亚铁血红蛋白。亚铁血红蛋白继续下移,与缓冲液溶解的O2结合,形成鲜红色的氧合血红蛋白。铁氰化钾是小分子量化合物,呈黄色带远远地落在后边。这样,就可以形象直观地观察到凝胶过滤的分离效果。
【关键词】 凝胶过滤,层析,血红蛋白
1前言
凝胶过滤层析又称分子排阻层析、分子筛层析等,它是利用某些化学惰性的多孔网状结构的物质(凝胶) 为填料,通过洗脱液的连续洗脱,使混合物中的各种物质按其分子体积大小和形状的差异而得到分离,已广泛应用于大分子物质的去盐、溶液的浓缩、分离提纯及分子量测定等方面[1]。凝胶过滤层析具有设备简单、操作方便、分离迅速和不影响样品生物活性等优点,但凝胶过滤层析对蛋白混合物的最佳分离效果受许多因素的影响。通过本实验的学习,了解凝胶柱层析的原理及应用,掌握凝胶柱层析的基本操作技术,为进一步掌握离子交换柱层析、亲和层析及吸附层析等其它分离方法打下良好基础。
2材料与方法
2.1材料
2.1.1实验材料
鸡血
2.1.2药品
Na2HPO4·2H2O(分析纯,江苏省连云港市化学试剂厂);
NaH2PO4·2H2O(分析纯,天津市福晨化学试剂厂);
蒸馏水;
乙二胺四乙酸二钠(EDTA-Na2)(分析纯,国药集团化学试剂有限公司);
硫酸亚铁(FeSO4·7H2O)(分析纯,江苏徐州试剂二厂);
Sephadex G-25,或G-75[2];
固体铁氰化钾〔K3Fe(CN)6〕;
柠檬酸钠(分析纯,中国上海试剂一厂)
2.1.3配置试剂
①磷酸缓冲液(pH7.0):
称取Na2HPO4·2H2O2.172g,NaH2PO4·2H2O1.076g,溶于蒸馏水中,定容至1000mL。
②Na2HPO4—EDTA—Na2溶液:
称取2.69gEDTA—Na2,3.56gNa2HPO4·2H2O,加蒸馏水溶解并定容至100mL。
③40m mol/L FeSO4溶液:
称取FeSO4·7H2O1.11g溶于100mL水中(现配现用)。
④抗凝血:
哺乳动物血样,以1:6的比例加入2.5%柠檬酸钠,置于4℃冰箱中保存
2.1.4仪器
BP221S型电子天平 层析柱(Φ1cm×40cm)
玻璃棒 烧杯(50ml,100ml,500ml)
容量瓶(50ml,100ml,500ml,1000ml) 胶头滴管
洗耳球 移液管(1mL,5mL)
2.2方法
2.2.1凝胶溶胀[2]
取10g Sephadex G-25,加200mL蒸馏水充分溶胀(在室温下约需6小时或在沸水浴中溶胀5小时)。待凝胶溶胀平衡后,用倾泻法除去细小颗粒,再加入与凝胶等体积的pH 7.0磷酸缓冲液,在真空干燥器中减压除气,准备装柱。
2.2.2装柱
将层析柱垂直固定,旋紧柱下端的螺旋夹,在柱内加入少量磷酸缓冲液或直接把处理好的凝胶连同适当体积的缓冲液用玻棒搅匀,然后边搅拌边倒入层析柱中,同时开启螺旋夹,控制一定流速。最好连续装完凝胶,若分次装入,需用玻棒轻轻搅动柱床上层凝胶,以免出现界面影响分离效果。装柱后形成的凝胶床至少长30cm,使胶床表面保持2-3cm液层。
注意:整个操作过程中凝胶必须处于溶液中,不得暴露于空气,否则将出现气泡和断层,应当重新装住。
2.2.3平衡
继续用磷酸缓冲液洗脱,调整缓冲液流速,平衡20-30分钟。
2.2.4样品制备
(1)取1mL鸡的抗凝血放入小烧杯中,加5mL pH7.0 的磷酸缓冲液,再加入27.5mg K3Fe(CN)6 固体,用玻棒搅动使其溶解,即得褐色的高铁血红蛋白溶液。
(2)吸取 lmL FeSO4 溶液和 lmL EDTA-Na2-NaHPO4 溶液,于小烧杯中混匀。(注意:还原剂混合液要新鲜配制,尽可能缩短其与空气接触的时间)。
2.2.5上样
旋开层析柱上端旋扭,待胶床上部的缓冲液几乎全部进入凝胶(即缓冲液液面与胶床平面相切)时,立即加入0.4mL上述混合液,待其进入胶床表面仅留约lmm液层时,加入0.5mL缓冲液,再当胶床表面仅留约lmm液层时,吸取0.5mL血红蛋白样品溶液,小心地注入层析柱胶床面中央,注意切勿冲动胶床。慢慢打开螺旋夹,待大部分样品进入胶床、床面上仅有lmm 液层时,用乳头滴管加入少量缓冲液,使剩余样品进入胶床,然后用液管小心加入3—5cm 高的洗脱缓冲液。
2.2.6洗脱
继续用磷酸缓冲液洗脱,调整流速,使上下流速同步保持每分钟约6滴。等有红色液体滴出时开始收集液体,直至滴出液体颜色变浅。
2.2.7凝胶的回收。
实验完毕用洗脱液把柱内有色物质洗脱干净,保留凝胶柱重复使用或回收凝胶。
3结果与分析
3.1实验结果

凝胶经溶胀、装柱、沉降后形成胶床,用磷酸缓冲液平衡后,沿层析柱内壁加入FeSO4、EDTA-Na2-NaHPO4 混合溶液,等其进入胶后往胶床面中央加入鸡血血红蛋白,等其进入胶床后加入磷酸缓冲液。血红蛋白在胶床中缓慢层析,分为三层:下层呈现黄色,是铁氰化钾;中层呈现红色,是血红蛋白;上层呈现墨绿色。收集层析柱中的红色的液体部分即为血红蛋白。本次实验收集的血红蛋白的量大约1.3mL。
3.2结果分析
本次实验中,曾新的样品在胶床内分三层,这符合理论;在实验过程中,样品洗脱速度极为缓慢,流速小于每分钟6滴,仅为每分钟2—3滴。这可能是由于葡聚糖凝胶有污染,层析柱的高度、直径等一些因素的影响。由于鸡血的存放时间较长,对最终血红蛋白的产量以及层析的速度均可能有影响。
总体而言,本实验是比较成功的,但在一些方面仍需要改进:
成功之处:
① 层析速度虽然缓慢,但是在层析过程中,样品的条带清晰,分层清楚;
② 层析过程中操作规范,加样准确,层析结果较好,经SDS聚丙烯酰胺凝胶电泳检测后条带清晰。
不足之处:
① 层析过程中由于一些因素的影响,层析速度极为缓慢;
② 配制FeSO4溶液时,由于操作不及时,导致FeSO4被氧化,进而重新配制;
③ 有血红蛋白层析出时未能及时收集,导致部分血红蛋白损失。
4讨论
通过本次实验,发现凝胶过滤层析的操作条件比较温和,可在相当广的温度范围下进行,葡聚糖凝胶的吸附力弱,不需要有机溶剂,并且对分离成分理化性质的保持有独到之处。对于高分子物质有很好的分离效果。
凝胶过滤层析在很多方面都有着很好的应用:凝胶过滤层析可以广泛用于酶、蛋白质、氨基酸、多糖、激素、生物碱等物质的分离提纯[3]。也可用于去除高分子物质(如核酸、蛋白质、多糖等)中的一些小分子杂质。测定已知分子量的物质通过凝胶过滤层析洗脱体积,再测定未知分子量的大分子物质体积,从而测定高分子物质的分子量。总而言之,凝胶过滤层析在分离纯化大分子物质方面有着重要作用。
5参考文献
[1] 安春菊,李德森,赵素然,杜荣骞.凝胶过滤层析参数对家蝇蛋白粗提液分离效果的影响.昆虫学报.2005
[2] 王璞,林红,朱滨.凝胶过滤层析实验中Sephadex的溶胀与回收保存. 中国科技论文统计源期刊.2006
[3] 时晓明,郭秀丽. 一种新型提取SOD的方法———串联凝胶过滤层析法. 药物分析杂志.2010
SDS聚丙烯酰胺凝胶电泳—蛋白质分子量的测定
班级:生技101 姓名:陈帅 学号:521002101
【摘要】
SDS聚丙烯酰胺凝胶电泳是分析蛋白质和多肽、测定其分子量等常用的方法。本实验利用SDS聚丙烯酰胺凝胶电泳对未知蛋白质待测样进行测定,主要目的是测定来自凝胶层析过滤分离的鸡血血红蛋白的分子量。样品在经过浓缩胶和分离胶之后,其相对迁移率为0.53,分子量大小大约66KD
【关键词】SDS聚丙烯酰胺凝胶电泳,迁移率,蛋白质分子量
1前言
SDS-聚丙烯酰胺凝胶电泳(PAGE)是根据蛋白质亚基分子量的不同从而用于分开蛋白质的技术。在测定蛋白质的分子质量时,由于聚丙烯酰胺的分子筛作用,小分子的蛋白质可以容易的通过凝胶孔径,阻力小,迁移速度快;大分子蛋白质则受到较大的阻力而被滞后,这样蛋白质在电泳过程中就会根据其各自分子量的大小而被分离。因而SDS聚丙烯酰胺凝胶电泳可以用于测定蛋白质的分子量。只需知道蛋白质在SDS—聚丙烯酰胺凝胶电泳中的迁移率就可以了。
SDS-PAGE在蛋白质研究领域有着重要作用。常用于蛋白质分子量的测定,蛋白质纯度的分析,蛋白质浓度的检测,免疫印迹(Western Blot)的第一步,蛋白质修饰及免疫沉淀蛋白的鉴定等[1] [2]。
2材料与方法
2.1材料
牛血清蛋白,鸡血血红蛋白
2.1.1试剂
SDS(十二烷基硫酸钠)(化学纯,国药集团化学试剂有限公司)
丙烯酰胺(Acr)(化学纯,北京拜尔迪生物技术有限公司)
N,N’甲叉双丙烯酰胺(Bis)(化学纯,北京拜尔迪生物技术有限公司)
Tris(化学纯,北京拜尔迪生物技术有限公司)
甘氨酸(Gly)(分析纯,国药集团化学试剂有限公司)
NaH2PO4(分析纯,天津市福晨化学试剂厂)
Na2HPO4(分析纯,江苏省连云港市化学试剂厂)
考马斯亮蓝R—250(分析纯,国药集团化学试剂有限公司)
50%甲醇(分析纯,国药集团化学试剂有限公司)
冰乙酸(分析纯,国药集团化学试剂有限公司)
蒸馏水
过硫酸铵(化学纯,国药集团化学试剂有限公司)
HCl(分析纯,南京化学试剂有限公司)
巯基乙醇(化学纯,国药集团化学试剂有限公司)
甘油(分析纯,宜兴市钮家化学试剂厂)
溴酚蓝(分析纯,上海化学试剂总厂)
四甲基乙二胺(TEMED)(化学纯,国药集团化学试剂有限公司)
2.1.2配置试剂
①10%过硫酸铵:
称取1.002g过硫酸铵固体粉用蒸馏水溶解,转移至2000mL容量瓶中,用蒸馏水定容。
② 凝胶注液:
称取Acr 29g,Bis 1g于烧杯中,然后加蒸馏水溶解,转移至100mL容量瓶中,用蒸馏水定容至刻度线,盖上瓶塞倒转摇匀。
③ 样品溶解液:
SDS 4.02g,巯基乙醇0.4mL,甘油4mL,溴酚兰0.01g,pH7.2磷酸缓冲液2mL。加蒸馏水溶解,转移至1000mL容量瓶中,用蒸馏水定容至刻度线,盖上瓶塞倒转摇匀。
④ 4X浓缩胶buffer:
称取Tris 6.0153g,用HCl调pH到6.8,然后加入SDS0.4070加水至100mL。
⑤4X分离胶buffer:
称取Tris 36.3598g,用80mL蒸馏水溶解,再用浓HCl调pH到8.8,然后加入SDS0.808g,60℃水浴溶解,加蒸馏水至200mL。
⑥电泳buffer:
称取Tris 12.1875g,Gly 57.748g和柠檬酸4.0149g,放入到500mL大烧杯中,加蒸馏水60℃水浴溶解,转移至2000mL容量瓶中,用蒸馏水定容至刻度线,盖上瓶塞倒。
⑦0.2mol/L,pH7.2磷酸盐缓冲溶液:
取280mol/L.0.2mol/L磷酸二氢钠溶液,加入720mL0.2mol/L磷酸氢二钠溶液,混匀后在pH计上调至pH7.2。
⑧染色液:
称取0.25g考马斯亮蓝R-250,454mL50%甲醇,46mL冰乙酸于烧杯中,转移至500mL容量瓶中。
⑨ 脱色液:
75mL冰乙酸,875mL蒸馏水与50mL甲醇混合。
2.1.3仪器
DYC2-24D型垂直板型电泳槽; DYY-2C型直流稳压电泳仪;
移液管(1mL、5mL、10mL); 烧杯(25mL、50mL、100mL);
微量进样器(50μL); 细长滴管;
培养皿(直径120mm); 手术刀片;
电吹风 ; 电炉。
2.2方法
2.2.1安装垂直板电泳槽、凝胶制备
先把垂直平板电泳槽和两块玻璃板洗净,晾干。这种电泳槽两侧为有机玻璃制成的电极槽,两个电极槽中间夹有一个凝胶模,该模由1个U形硅胶框、长与短的玻璃板及样品槽模板(梳子)所组成。先把垂直平板电泳槽和两块玻璃板洗净,晾干。通过U形胶带将两块玻璃板封好,由此便形成一个“夹心”凝胶腔,再将封好的玻璃板插入电泳槽。注意操作过程中勿用手接触灌胶的玻璃面。
为了检验装好的电泳槽是否漏胶,可以先加少量水检验封好的玻璃板是否会漏胶,确定不漏后将水倒出,并用吸水纸吸干凝胶腔中的水分。
按照表1所示制备凝胶
表1 凝胶制备方法
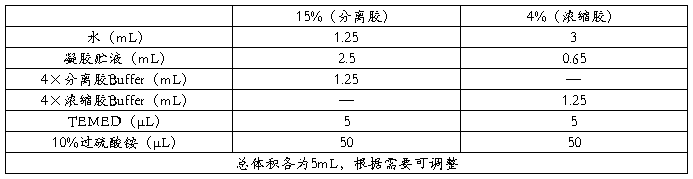
用吸管吸取分离胶,沿壁缓缓注入已准备好的胶室中,胶液加到离胶室顶部1.5厘米处。注胶后应立即覆盖3-5毫米的水层,垂直静止聚合30分钟左右。聚合后将覆盖的水层倒出,并吸干。
2.2.2 加样
一般每个凹形样品槽内,只加一个种样品或已知分子量的混合标准蛋白质,将样品与已知分子量的标准蛋白加在同一块凝胶上,加样体积要根据凝胶厚及样品浓度灵活掌握,本实验加样体积为20μL。如样品槽中有所泡,可用注射器针头挑除。加样时,将微量注射器的针头通过电极缓冲液伸入加样槽内,尽量接近底部,轻轻推动微量注射器,注意针头勿碰破凹形槽胶面。由于样品溶解液中含有比重较大的蔗糖或甘油,因此样品溶液会自动沉降在凝胶表面形成样品层。
2.2.3 电泳
加样后,将电极缓冲液分别倒入上下电泳槽,连接电泳仪与电泳槽,上槽接负极,下槽接正极。打开电源,先将电流调至25mA,10min候,将电流调至75mA,待染料前沿迁移至距硅橡胶框底边1-1.5cm处停止电泳,关闭电源,一般电泳过程需5-6h。
2.2.4 染色[3]与脱色
电泳结束后,取下凝胶模,卸下硅橡胶框,用解剖刀撬开短玻璃板,在凝胶板切下一角作为加样标志,将凝胶从玻璃板上取下,放入大的培养皿中染色30~60min,用蒸馏水漂洗数次,然后放入脱色液中脱色。勤换脱色液,12小时后可清晰地辨认出蛋白质区带,48小时后可脱至背景无色。若蛋白质区带清晰,可将电泳图谱照相保存。
2.3Mr的计算
通常以相对迁移率Mr来表示迁移率,相对迁移率的计算方法如下:
用直尺分别量出样品区带中心及铜丝与凝胶顶端的距离,按下式计算:

以标准蛋白质Mr的对数对相对迁移以标准蛋白质Mr的对数对相对迁移率作图,得到标准曲线,根据待测样品的相对迁移率,从标准曲线上查出其Mr。
3结果与分析
3.1实验结果
点样时,从左往右的顺序依次为:Marker;1号、2号:牛血清蛋白;3号、4号:鸡血血红蛋白(样品由陈帅、马杰、陆晓霜层析得出);5—9号:鸡血血红蛋白(样品由邓文杰、崔佳慧、董歆层析得出);Marker。
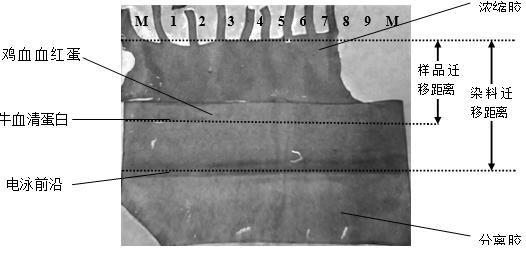
将电泳后的胶经染色、脱色后可见,1号、2号、3号、4号有条带出现,1号、2号条带较清楚,3号、4号条带较不明显。两个Marker可能受某些因素的影响,均未跑出条带。通过分析测量胶图得出:样品迁移距离为1.86cm,染料迁移距离(即电泳前沿)为3.53cm.
通过计算可得,相对迁移率
样品蛋白质的分子量为66KD
3.2结果分析
本次实验过程中,牛血清蛋白电泳效果较好,说明配置的浓缩胶和分离胶没有问题。而鸡血血红蛋白效果较不明显,这是由凝胶过滤层析中的一些因素引起的(比如:鸡血不新鲜、凝胶层析缓慢等)。在跑胶结果中,Marker未能跑出条带,这是由于Marker与胶的浓度不匹配所造成的。对于实验结果中,样品蛋白的相对迁移率约为0.53,说明样品的分子量较大,达到66KD,这跟实际情况相符合。
本次实验虽有成功的方面,但存在很多不足之处,对结果产生一定的负面影响:
成功之处:
① 牛血清蛋白,样品鸡血血红蛋白能够在凝胶中跑出条带,说明配胶准确无误;
② 在倒胶后,胶凝固的时间足够长,胶孔整齐;
③ 点样准确规范,均点进了胶孔里。
不足之处:
① 在电泳过程中,由于溴酚蓝还没能到分离胶中就改电压为120V,电泳结果中溴酚蓝出现两条可能与此有关;
② 在剥胶时用力过大,导致胶的一个角落损坏;
③ Marker未能跑出条带,可能与Marker跟胶的匹配程度有关;
④ 电泳时间不够长,样品蛋白分离不够彻底。
4讨论
SDS聚丙烯酰胺凝胶电泳原理简单,操作简便,是蛋白质研究中极为常用的研究方法。然而,其也有着一定的不足。
首先 ,由亚级组成的蛋白质多聚体与SDS作用后,解离成亚级,结果测定的肽链分子量实际上是亚级的分子量。要得到完整的分子量,必须参照其他方法测定的结果,如聚丙烯酰胺浓度梯度凝胶电泳、葡聚糖凝胶过滤、氨基酸组成的分析、离子沉降平衡等。
第二,蛋白质与SDS作用后,空间结构破坏,失去活性,绝大多数情况下,这一失活过程是不可逆的。
第三,有少量的蛋白质,由于带电荷的性质和构型的特殊,或含有非蛋白质的成份,如糖蛋白和脂蛋白,使电泳迁移率偏高或偏低,使测定误差较大,这也需要与其他测定方法相配合,才能得到可靠的结果。
尽管如此,SDS聚丙烯酰胺凝胶电泳分析蛋白质仍是科学研究中常用的方法,而这一方法需要我们不断探索创新,从而对其改良[4],以发挥其优越性,避免其不好方面。
5参考文献
[1]方丽莎,谢珍茗,余倩,余林. SDS.聚丙烯酰胺凝胶电泳在拟糖蛋白检测中的应用. 分析化学.20##年10月
[2]石继红,赵永同.SDS—聚丙烯酰胺凝胶电泳分析小分子多肽.第四军医大学学报.20##年第6期
[3]胡晓倩,陈来同,赵健.SDS-聚丙烯酰胺凝胶电泳染色方法.中国生化药物杂志.20##年第32卷第2期
[4]胡承香,张玉纯,李磊,顾长国.SDS—聚丙烯酰胺凝胶电泳技术的改良及其应用第三军医大学学报.1996年2月第l8卷第1期
