第十八章 铬、锰、钛、钒
一、教学要求:
1.掌握过渡元素的价电子构型的特点及其元素通性的关系。
2.掌握重要过渡元素钛、钒、铬和锰的单质及化合物的性质和用途;一般了解同多酸、杂多酸的知识。
3. 了解第二、三过渡系元素性质的递变规律。
4.了解钛、钨的冶炼原理。
二、重点与难点
重点:掌握第四周期Ti 、V、Cr、Mn 金属元素氧化态、最高氧化态氧化物及其水合物的酸碱性、氧化还原稳定性、水合离子及其含氧酸根颜色等变化规律。掌握过渡元素的价电子构型特点及其与元素通性的关系。
难点:过渡元素的价电子构型特点及其与元素通性的关系,第二、三过渡系元素性质的递变规律。
三、精选例题解析
1.d区元素原子的电子能级是(n-1)d>ns,但氧化时首先失去的是ns轨道上的电子,这是因为( )。
A. 能量最低原理不适用于离子的电子排布
B. 次外层d轨道的电子是一整体,不能部分丢失
C. 生成离子或化合物时,各轨道的能级顺序是可以变化的
D. 只有最外层s轨道电子才能参与成键
答:在多电子原子中,由于屏蔽效应和钻穿效应使轨道能级出现了(n-1)d>ns和能级交错现象,因此在进行核外电子填充时,首先填充ns轨道,后填充(n-1)d轨道,但原子在失去电子时,由于(n-1)d电子云分布在ns电子云里, ns电子云就不能再屏蔽(n-1)d电子了,于是电子能级顺序又发生变化,即(n-1)d < ns,所以原子失电子时,首先失去ns电子,再失去d电子(d电子可部分或全部参与成键)。正确答案为C。
2.在酸性介质中使Mn2+离子氧化为MnO4-离子应选用的氧化剂为( )。
A. PbO2 B. K2Cr2O7 C. NaBiO3 D. H2O2
答:因为在酸性介质中,Mn2+是稳定的,只有在高酸度的热溶液中,与强氧化剂反应,才能使 Mn2+氧化为MnO4-,所以应选用的氧化剂为PbO2或NaBiO3 。正确答案为A、C。
3.按下列要求填空:
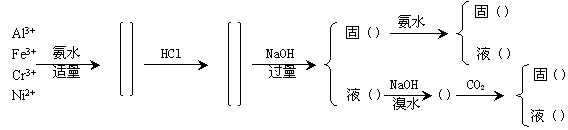 答:若使Al3+、 Fe3+、 Cr3+、Ni2+进行分离,主要掌握它们的不同点:
答:若使Al3+、 Fe3+、 Cr3+、Ni2+进行分离,主要掌握它们的不同点:
(1)与适量氨水作用,都可生成氢氧化物,而与过量氨水作用时, Cr3+和Ni2+可形成氨配合物,而Al3+和Fe3+则不能被氨配合。
(2)与过量NaOH作用,Al(OH)3和Cr(OH)3可溶解,而Fe(OH)3和Ni(OH)2则不具有两性,不能溶解。
(3)与氧化剂作用,只有Cr(Ⅲ)→Cr(Ⅵ),而Fe(Ⅲ)、Al(Ⅲ)、Ni(Ⅱ)遇氧化剂则不可能形成高价离子。

4.已知:
Fe3+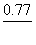 Fe2+,当用KMnO4在酸性介质中氧化Fe2+时,若KMnO4过量会发生什么现象?根据锰元素的电势图加以解释.
Fe2+,当用KMnO4在酸性介质中氧化Fe2+时,若KMnO4过量会发生什么现象?根据锰元素的电势图加以解释.
答:根据电极电势分析,由于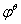 ( MnO4-/ Mn2+)>
( MnO4-/ Mn2+)>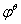 ( Fe3+/ Fe2+),所以当KMnO4在酸介质中氧化Fe2+时,首先发生的反应是:
( Fe3+/ Fe2+),所以当KMnO4在酸介质中氧化Fe2+时,首先发生的反应是:
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
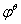 ( MnO4-/ MnO2) =
( MnO4-/ MnO2) =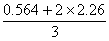 =1.69 V
=1.69 V
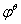 ( MnO4-/ MnO2) >
( MnO4-/ MnO2) >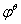 ( MnO4-/ Mn2+),若KMnO4过量时,可发生如下反应:
( MnO4-/ Mn2+),若KMnO4过量时,可发生如下反应:
2MnO4-+3Mn2++2H2O=5MnO2↓+4H+
5.根据实验现象,写出有关化学反应方程式:
(1)四氯化钛暴露在空气中会发烟;
(2)在Cr2(SO4)3溶液中逐滴加入NaOH溶液至过量,再加溴水;
答:(1)TiCl4+3H2O=H2TiO3+4HCl
(2) Cr2(SO4)3+6NaOH= 2Cr(OH)3↓+3Na2SO4
Cr(OH)3 +NaOH=NaCrO2+2H2O
2NaCrO2+3Br2+8NaOH=6NaBr+2 Na2CrO4+4H2O
6.试讨论过渡元素的下列性质(1)原子电子层结构的特点;(2)氧化态的表现,各族元素的最高氧化态稳定性变化规律;(3)原子半径的变化;(4)主要的物理性质.
答:(1)它们的共同特点是都具有未充满的(n-1)d轨道(Pd除外),最外层也仅有1-2个电子,因而它们原子的最外两个电子层都是未充满的,所以过渡元素价电子层结构通常为(n-1)d1~9ns1~2。
(2)过渡元素在形成化合物时总是先失去最外层的两个s电子,而表现为+2氧化态,由于次外层(n-1) d轨道能量与最外层ns轨道能量相近,且(n-1)d轨道还没有达到稳定结构,所以有时(n-1)d电子也可部分或全部作为价电子参加成键形成多种氧化态,从+2依次递增到与族数相近的最高氧化态,各族元素最高氧化态稳定性变化规律是同一族中从上向下高氧化态趋向于比较稳定。
(3)各周期中随原子序数的增加,原子半径依次减小,但变化得很慢,到了各周期过渡元素的末尾才稍为增大;各族中从上至下原子半径增大,但第5,6周期同族元素的原子半径却很接近(由于镧系收缩的影响而引起的)。
(4)过度元素的金属键较强,因而大多数都有较高的硬度和较高的熔、沸点,许多过渡金属及其化合物有顺磁性,过渡金属有较好的延展性和机械加工性,并且彼此间以及与非过渡金属组成具有多种特性的合金,它们都是电和热的良好导体。
7. [Fe(H2O)6]2+配离子有4个未成对的电子,是顺磁性的,而[Fe(CN)6]4-配离子是抗磁性的,类似的[CoF6]3-是顺磁性的,而[Co(CN)6]3-是抗磁性,如何解释这些事实?
答: H2O和F-都是弱场配位体,形成配离子时产生的分裂能较小,因而易形成高自旋配合物。Fe2+和Co3+的最外层结构都是3d6, [Fe(H2O)6]2+和[CoF6]3-配离子,中心离子有4个未成对d电子,因而它们具有顺磁性。而CN-是强场配位体,能产生较大的分裂能,易形成低自旋配合物。 [Fe(CN)6]4-和[Co(CN)6]3-配离子的中心离子没有未成对的d电子,因而它们具有抗磁性。
8.预测[Cr(H2O)6]2+和[Cr(CN)6]4-中的未成对电子数?
答:中心离子Cr2+的最外层结构是d4,与弱场配位体H2O形成高自旋配合物,有4个未成对电子,Cr2+与强场配位体CN-形成低自旋配合物,中心离子有2个未成对电子。
9.简述从钛铁矿提取金属钛的反应原理并写出反应方程式。
答:(1)用硫酸分解钛铁矿制取TiO2。
先用浓H2SO4处理磨碎的钛铁矿精砂,得到钛的硫酸盐;
FeTiO3+ 3H2SO4=Ti(SO4)2+ FeSO4+3H2O
FeTiO3+ 2H2SO4=TiOSO4+ FeSO4+2H2O
同时, 钛铁矿中的铁氧化物与硫酸发生反应:
FeO+ H2SO4=FeSO4+ H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
加入铁粉,使溶液中Fe3+离子还原为Fe2+,然后冷却,使FeSO4.7H2O结晶析出,除去溶液中的杂质铁。
Ti(SO4)2和TiOSO4水解析出偏钛酸白色沉淀:
Ti(SO4)2+ H2O =TiOSO4+H2SO4
TiOSO4+2H2O= H2TiO3↓+ H2SO4
煅烧偏钛酸,即可得TiO2:
H2TiO3 TiO2+ H2O
TiO2+ H2O
(2)氯化法将TiO2转化为TiCl4:
 TiO2+2C+2Cl2 TiCl4+2CO↑
TiO2+2C+2Cl2 TiCl4+2CO↑
(3)金属热还原法制金属钛:
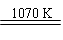 TiCl4+2MgO 2MgCl2+Ti
TiCl4+2MgO 2MgCl2+Ti
10.根据以下实验说明产生各种现象的原因并写出有关反应方程式。
(1) 打开装有四氯化钛的瓶塞,立即冒白烟; (2)向此瓶中加入浓盐酸和金属锌时,生成紫色溶液;(3)缓慢地加入氢氧化钠至溶液呈碱性,则析出紫色沉淀;(4)沉淀过滤后,先用硝酸,然后用稀碱溶液处理,有白色沉淀生成;(5)将此沉淀过滤并灼烧,最后与等物质的量的氢氧化镁共熔。
答:(1)因为TiCl4在水中或潮湿空气中都极易水解,暴露在空气中遇水蒸气发生水解产生HCl而冒白烟。
TiCl4+3H2O= H2TiO3+ 4HCl
(2) 用Zn处理TiCl4的盐酸溶液,可以得到紫色的TiCl3水溶液:
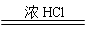 2TiCl4+Zn 2 TiCl3+ZnCl2
2TiCl4+Zn 2 TiCl3+ZnCl2
(3)在碱性条件下析出紫色的TiCl3.6H2O晶体。
(4)Ti(Ⅲ)离子具有还原性,遇到氧化性的HNO3时,被氧化为Ti(Ⅳ)离子,再用稀碱处理则得白色偏钛酸沉淀:
3Ti3++NO3-+H2O=3TiO2++2H++NO
TiO2++2OH- =TiO2.H2O↓
(5)将沉淀过滤灼烧则得到TiO2,当与氧化镁共熔时得到盐:
TiO2.H2O TiO2+H2O
TiO2+H2O
 TiO2+Mg MgTiO3
TiO2+Mg MgTiO3
11.锌汞齐能将钒酸盐中的钒(Ⅴ)还原至钒(Ⅱ),将铌酸盐中的铌(Ⅴ)还原至铌(Ⅳ),但不能使钽酸盐还原,此实验结果说明了什么规律性?
答: 锌汞齐能将钒酸盐,铌酸盐由高氧化态还原为低氧化态,而不能使钽酸盐还原,说明钒分族元素依钒、铌、钽顺序高氧化态逐渐稳定,而低氧化态化合物较少,稳定性依次降低。
12.铬的某化合物A是橙红色溶于水的固体,将A用浓HCl处理产生黄绿色刺激性气体B和生成暗绿色溶液C,在C中加入KOH溶液,先生成灰兰色沉淀D,继续加入过量的KOH溶液则沉淀消失,变成绿色溶液E,在E中加入H2O2,加热则生成黄色溶液F,F用稀酸酸化,又变为原来的化合物A的溶液。问:A、B、C、D、E、F各是什么?写出每步变化的反应方程式。
答: A为K2Cr2O7,B为Cl2,C为CrCl3,D为Cr(OH)3,E为KCrO2,F为K2CrO4,各步的化学反应方程式为:
Cr2O72-+6Cl-+14H+ 2Cr3++3Cl2↑+7H2O
2Cr3++3Cl2↑+7H2O
Cr3++3OH-= Cr(OH)3↓
Cr(OH)3+OH-= CrO2-+2H2O
2CrO2-+3H2O2+2OH-=2CrO42-+4H2O
2CrO42-+2H+= Cr2O72-+ H2O
13.举例说明Cr3+离子和Al3+离子的相似性,若Cr3+和Al3+共存时,如何分离它们?
答: Cr3+和Al3+在水溶液中都以水合离子[Cr(H2O)6]3+,[Al(H2O)6]3+的形式存在;都能形成复盐KCr(SO4)2.12H2O、KAl(SO4)2.12H2O;与碱反应都产生胶状沉淀Cr(OH)3、Al(OH)3,且均为两性,它们溶于过量碱生成CrO2-、AlO2-,都能水解产生氢氧化物沉淀。
若Cr3+ 和Al3+共存时,可加过量的氨水将它们分离, Cr3+能同氨形成配合物[Cr(NH3)6]3+溶解,而Al3+不能,只生成Al(OH)3沉淀。
14.在硫酸铬溶液中,逐渐加入氢氧化钠溶液,开始生成灰兰色沉淀,继续加碱,沉淀又溶解,再向所得碱液中滴加溴水,直到溶液的绿色转为黄色,写出各步的化学方程式。
答:Cr2(SO4)3+6NaOH= 2Cr(OH)3↓+3Na2SO4
Cr(OH)3 +NaOH=NaCrO2+2H2O
2CrO2-+3Br2+4OH-=6Br-+2 CrO42-+4H+
15.为什么在酸性的K2Cr2O7溶液中,加入Pb2+离子,会生成黄色的PbCrO4沉淀。
答: Cr2O72-在酸性溶液中存在着下列平衡:
Cr2O72- +H2O  2CrO42-+2H+
2CrO42-+2H+
虽然酸性溶液中CrO42-离子浓度很小,但由于加入Pb2+,生成的PbCrO4溶解度较小,使平衡右移,当加入足够的Pb2+离子,可使Cr2O72-最后全部转化为CrO42-,而成黄色的PbCrO4沉淀。
16.在室温或加热的情况下,为什么不要把浓硫酸和高锰酸钾固体混合?
答:因两者混合,反应生成绿色油状的高锰酸酐Mn2O7,它在273K (0℃)以下稳定,在常温下会爆炸分解成 MnO2、O2和O3,这个氧化物还有强氧化性,因此不能在室温或加热的情况下混合固体KMnO4和浓H2SO4.
2KMnO4+H2SO4(浓) =Mn2O7+K2SO4+H2O
4Mn2O7=8MnO2+3O2+2O3
17.以软锰矿为原料,制备锰酸钾、高锰酸钾、二氧化锰和锰,并写出反应方程式。
答:将软锰矿(MnO2)与KClO3,KOH的混合物加热熔融,可得绿色的锰酸钾:
 3MnO2+KClO3+6KOH 3K2MnO4+KCl+3H2O
3MnO2+KClO3+6KOH 3K2MnO4+KCl+3H2O
将锰酸钾溶于水,并通入氯气,即被氧化为高锰酸钾:
2K2MnO4+Cl2=2KMnO4+2KCl
高锰酸钾溶液在酸性条件下分解得二氧化锰:
4MnO4-+4H+=4MnO2 +3O2+2H2O
将软锰矿强热使之转变为Mn3O4,然后与铝粉混合燃烧,制得金属锰:
3MnO2 Mn3O4 +O2
Mn3O4 +O2
3Mn3O4+8Al=9Mn+4Al2O3
18.有一含磷化合物A,其分子量为137.5,该化合物能与氯发生加成反应得另一化合物B,B与水作用可得含有化合物C的溶液,向溶液中加入钼酸铵和硝酸溶液就有黄色沉淀D生成。A、B、C、D各为何物?并写出反应方程式。
答: A为PCl3,B为PCl5,C为H3PO4,D为(NH4)3[PMo12O40] .6H2O
各步反应方程式为:
PCl3+ Cl2= PCl5
PCl5+4 H2O= H3PO4+5HCl
12MoO42-+3NH4++ PO43-+24H+=(NH4)3[PMo12O40] .6H2O+ 6H2O
19.写出下列反应的方程式
(1) 重铬酸铵加热;
(2)重铬酸钾加热至高温;
(3) 向重铬酸钾的硫酸溶液中通入SO2;
(4) 氢氧化铬与盐酸反应;
(5) 在已用H2SO4酸化的重铬酸钾溶液中通入H2S;
(6) 重铬酸钾与硫一起加热。
答(1)(NH4)2Cr2O7 Cr2O3+N2↑+4H2O
Cr2O3+N2↑+4H2O
 (2) 4K2Cr2O7 4 K2CrO4+ 2Cr2O3+3O2↑
(2) 4K2Cr2O7 4 K2CrO4+ 2Cr2O3+3O2↑
(3) K2Cr2O7 +3SO2 +H2SO4= Cr2(SO4)3 +K2SO4+H2O
(4) Cr(OH)3+3HCl= CrCl3+3H2O
(5) K2Cr2O7+3H2S+4H2SO4== Cr2(SO4)3 +K2SO4+3S↓+7H2O
(6) K2Cr2O7+S Cr2O3+K2SO4
Cr2O3+K2SO4
20.有一锰的化合物,它是不溶于水且很稳定的黑色粉末状物质A,该物质与浓H2SO4反应则得到淡红色的溶液B,且有无色气体C放出。向B溶液中加入强碱,可以得到白色沉淀D,此沉淀在碱性介质中很不稳定,易被空气氧化成棕色E,若将A与KOH、KClO3一起混合加热熔融可得一绿色物质F,将F溶于水并通入CO2,则溶液变成紫色G,且又析出A,试问A、B、C、D、E、F、G各为何物?并写出相应的反应方程式。
答:A为MnO2,B为MnSO4,C为O2,D为Mn(OH)2,E为MnO(OH)2,F为K2MnO4,G为KMnO4.
各步反应方程式为:
2 MnO2+2H2SO4(浓) =2MnSO4(淡红)+ O2↑+2H2O
MnSO4+2NaOH=Mn(OH)2↓(白)+Na2SO4
2Mn(OH)2+O2=2MnO(OH)2↓(棕)
3MnO2+6KOH+KClO3=3K2MnO4(绿)+ KCl+3H2O
3K2MnO4+2CO2=2KMnO4(紫)+MnO2+2K2CO3
21.Mn2+、 Mn3+、 MnO42-和MnO4-离子各是什么颜色?并试述MnO4-离子通常的鉴定方法.
答: Mn2+为肉色, Mn3+为红色, MnO42-为绿色, MnO4-为紫色。
MnO4-的鉴定方法较多,都是基于MnO4-的强氧化性,与还原剂反应后溶液的颜色改变或有沉淀生成。例如:
(1) 在酸性溶液中加入Fe2+离子,紫色褪去:
MnO4- +5Fe2++8H+=Mn2+ +5Fe3++4H2O
(2) 加入Mn2+离子,生成褐色沉淀:
2MnO4-+3Mn2++2H2O=5MnO2↓+4H+
(3)在强碱性溶液中加入SO32-离子,溶液呈绿色:
2MnO4- +SO32-+2OH-= 2MnO42-+ SO42-+H2O
22.向一含有三种阴离子的混合溶液中,滴加AgNO3溶液至不再有沉淀生成为止,过滤,当用稀硝酸处理沉淀时砖红色沉淀溶解得红色溶液,但仍有白色沉淀,滤液呈紫色,用硫酸酸化后,加入Na2SO3 ,则紫色逐渐消失,指出上述溶液中含哪三种阴离子,并写出有关反应方程式。
答:溶液中含有Cl-、CrO42-、和MnO4-三种离子。
Ag++Cl-=AgCl↓
产生白色沉淀不溶于稀硝酸
2Ag++CrO42-=Ag2CrO4↓
砖红色沉淀溶于稀HNO3
2CrO42-+2H+= Cr2O72-+H2O
Cr2O72-为橙红色
2MnO4- +5SO32-+6H+= 2Mn2++5SO42-+3H2O
MnO4-离子紫色消失。
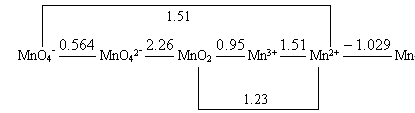
23.试利用锰的电势图,说明Mn(Ⅲ)化合物易歧化的原因,并计算它的歧化反应的平衡常数,说明歧化趋势如何?
答:锰的标准电势图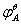 为:
为:
MnO2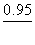 Mn3+
Mn3+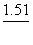 Mn2+
Mn2+
由于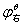 >
>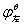 , Mn(Ⅲ)化合物易发生歧化反应:
, Mn(Ⅲ)化合物易发生歧化反应:
2Mn3++2H2O=MnO2+Mn2++4H+
平衡常数为:
lgK=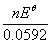 =
=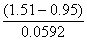 =9.46
=9.46
K=2.88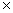 109
109
歧化反应趋势很大。
四、练习题
1. 过渡元素在性质上不同于其他类型元素,其原因是( )。
A. 过渡元素具有不全满的d电子
B. 过渡元素的金属活泼性强
C. 过渡元素的电极电势值较负
D. 过渡元素的电离势较大
2. 过渡元素氧化态的变化规律是( )。
A. 同一周期中,从左到右,氧化态先升高,后降低
B. 同一周期中,从左到右,氧化态先降低,后升高
C. 同一族中,从上到下,高氧化态趋向于较稳定
D. 同一族中,从上到下,低氧化态趋向于较稳定
3. 下列过渡元素中,最活泼的一族金属是( )。
A. Sc、Y、La B. Ti、Zr、Hf C. Mn、Tc、Re
D. V、Nb、Ta
4. 下列关于过渡元素的规律正确的是( )。
A. 一般来说,过渡元素从左到右,金属性减弱的趋势较为明显
B. 所有同族过渡元素,自上而下,金属性依次增强
C. 同一过渡系元素氧化物及其水合物,从左到右酸性减弱
D.过渡元素的离子中如果有未成对电子,其水溶液就有颜色
5. 下列各种离子中,均为无色的是( )。
A. V3+、Cr3+ B. Ti4+、Cu2+ C. Ti4+、Zn2+ D. Zn2+、Cr3+
6. 下列关于钛及其化合物反应方程式不正确的是( )。
A. 2Ti+6HCl(浓) 2TiCl3+3H2↑
2TiCl3+3H2↑
B. Ti+6HF=H2TiF6+2H2↑
C. 3Ti(OH)3+13HNO3(稀)=3Ti(NO3)4+NO↑+11H2O
D. Ti+4HNO3(浓) H2TiO3+4NO2↑+H2O
H2TiO3+4NO2↑+H2O
7. 氧化态为+4的钛在溶液或晶体中存在的形式为( )。
A. Ti4+ B. TiO2+ C. (TiO)n2n+ D. [Ti(H2O)6]4+
8. 下述说法错误的是( )。
A. V2O5溶解在强碱性溶液中,生成钒酸盐(M3VO4)
B. V2O5溶解在盐酸中,生成VOCl2,放出Cl2气
C. 用H2还原V2O5,可制得金属钒
D. 用金属在加热条件下还原V2O5可制得金属钒
9. 下列关于铬副族元素与卤素反应的叙述中错误的是( )。
A .Cr、Mo、W在常温下都能与F2剧烈反应
B. Cr在加热时能与氯、溴、碘化合
C. Mo在加热时能与氯、溴化合
D. W在加热时能与溴、碘化合
10.已知: 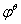 /V:
/V:
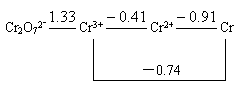
Fe3+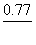 Fe2+。判断酸性溶液中,Cr2O72-与Fe2+反应的产物是( )。
Fe2+。判断酸性溶液中,Cr2O72-与Fe2+反应的产物是( )。
A. Cr2+、Fe3+ B. Cr3+,、 Fe3+ C. Cr、Fe3+ D. Cr3+、Fe2O3
11.在Cr2(SO4)3溶液中,加入Na2S溶液,产物为( )。
A. Cr2S3+ Na2SO4 B. Cr+S C. Cr (OH)3+H2S D. CrO2-+S2-
12.下列叙述中,正确的是( )。
A. 碱性溶液中,Cr2O72-最稳定
B. 酸性溶液中,Cr3+最稳定
C. 酸性溶液中, Cr2+可歧化为Cr3+和Cr
D. 酸性溶液中, Cr3+的还原性最强
13有些含氧酸是强酸,强氧化剂,但只存在于水溶液中,不能分离出游离的酸,这些酸是( )。
A.铬酸 B. 钨酸 C.钛酸 D.高锰酸
14下列物质中不属于同多酸的是( )。
A. H2S2O3 B. H2SxO6 C. H2Cr2O7 D. H5P3O10
15.依下列反应方程式所给出的条件,不能发生反应的是( )。
A. 2Mn(OH)2+O2=2MnO(OH)2
B. 2MnO2+2H2SO4(稀)=2MnSO4+2H2O+O2↑
C. 2Mn2++5S2O82-+8H2O =16H++10SO42-+2MnO4-
D. Mn(NO3)2 MnO2+2NO2↑
MnO2+2NO2↑
16.下列叙述中不正确的是( )。
A. KMnO4溶液与H2SO4反应,生成油状的Mn2O7
B. Mn2O7在常温下会爆炸分解成为MnO2、O2和O3
C. Mn2O7具有强氧化性,遇有机物燃烧
D.将Mn2O7溶于水生成MnO2
17.下列反应无气体产生的是( )。
A. MnO2+H2SO4(浓)→
B. KMnO4
C. MnO4-+SO32-+H2O→
D. MnCO3
18.根据元素电势图:
MnO4- MnO2
MnO2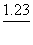 Mn2+ IO3-
Mn2+ IO3-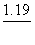 I2
I2 I-
I-
分析:当溶液pH=0时,过量的KMnO4与KI反应,主要产物为( )。
A. MnO4-和I2 B. Mn2+和IO3- C. MnO2和IO3- D. Mn2+和I2
19.锰的氧化物中,酸性最强的是( )。
A. MnO B. Mn2O3 C. MnO2 D. Mn2O7
20.下列各组金属氧化物中,常用氢还原制取高纯度金属单质的是( )。
A. TiO2、V2O5 B. WO3、 MoO3
C. CrO3、Cr2O3 D. MnO3、ZnO
21.正确的HMnO4、HTcO4、HRcO4的变化规律为( )。
A.酸性: HMnO4 > HTcO4 > HRcO4
B.酸性: HMnO4 < HTcO4 < HRcO4
C.氧化性: HMnO4 > HTcO4 > HRcO4
D.氧化性:HMnO4 < HTcO4 < HRcO4
22. TiO2与热的浓H2SO4作用析出的是( )。
A. Ti(SO4)2 B. TiOSO4 C. TiOSO4.H2O D. Ti(SO4)2.H2O
23.下列说法错误的是( )。
A. TiCl4暴露在空气中会发烟,因为它在水中或潮湿空气中都极易水解
B. TiCl4与HCl反应可生成H2[TiCl6]配合物
C.钛的硫酸盐与碱金属硫酸盐反应生成M2[Ti(SO4)3]配合物
D.在Ti(Ⅳ)的水溶液中存在有简单的水合配离子[Ti(H2O)6]4+
24. 称为金红石的物质是( )。
A. CaTiO3 B. FeTiO3 C. TiOSO4 D. TiO2
25.在下列钒的氧化物中,最稳定的是( )。
A. VO B. VO2 C. V2O3 D . V2O5
26.下列钒酸盐中,可称为高钒酸盐的是( )。
A. MVO3 B. M3VO4 C. M4V2O7 D. M3V3O9
27. Cr、Mo、W三种金属的冶炼,可以采取的方法为( )。
A. 水溶液中活泼金属置换法 B. 盐溶液电解法
C. 氧化高温分解法 D. 还原剂(H2,C活泼金属)高温还原法
28. 对于Cr(Ⅲ)化合物,下面叙述中不正确的是( )。
A. 在碱性溶液中有较强的还原性
B. 在酸性溶液中以Cr3+形式存在
C. Cr2O3、Cr(OH)3均为碱性化合物
D. 在酸性溶液中能被强氧化剂氧化为Cr(Ⅵ)
29.过渡元素原子的电子层结构特点是( )。
A. 最外两个电子层都是未充满的
B. 最外层均为ns2电子
C. 在化学反应中,仅失去最外层s电子
D. 在化学反应中,可失去最外层的全部电子
30.下列叙述错误的是( )。
A. 在同一周期中,过渡金属的标准电极电势值从左到右,基本上是逐渐增大的
B. 在同一周期中,过渡金属的金属性从左到右,逐渐增强
C. 与第一过渡系元素相比(ⅢB族除外),第二、三过渡系元素的活泼性都较弱
D. 过渡元素氧化物(氢氧化物或水合氧化物)的碱性,从左到右逐渐增强
31.水合离子呈淡紫色的是( )。
A. V2+ B. Cr3+ C. Ti3+ D. Fe3+
32. 对铬分族元素,下列不正确的叙述是( )。
A.价电子层结构为(n-1)d5ns1
B.按Cr→Mo→W顺序其最高氧化态稳定性增强
C.它们表面易形成氧化膜而成钝态
D.它们的熔、沸点较高,尤其是钨的熔、沸点是一切金属中最高的
33.下列各组离子中,可用NaOH进行分离的是( )。
A. Al3+和Cr3+ B. Zn2+和Al3+ C. Cr3+和Fe3+ D. Cr3+和Zn2+
34. Mn的电势图为:
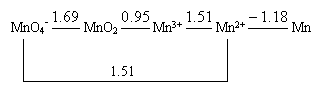
能发生歧化的是( )。
A. MnO4- B. MnO2 C. Mn3+ D. Mn2+
35. KMnO4与K2SO3作用,在中性介质中的还原产物为( )。
A. Mn2+ B. Mn C. MnO2 D. MnO42-
36.加热时,不与Br2作用的为( )。
A. V B. Cr C. Mo D. W
37.白色的NH4VO3加热后,颜色变深,其原因是生成了( )。
A. VO2+ B. VO3- C. V2O5 D. VO2-
38. 在中等酸度的钛(Ⅳ)盐溶液中,加入H2O2可生成较稳定的桔黄色的( )。
A. (TiO)n2n+ B. Ti3+ C. Ti2+ D. [TiO(H2O2)]2+
39. 在Cr2(SO4)3溶液中,加入Na2S溶液,其沉淀产物为( )。
A. Cr2S3 B. Cr C. Cr(OH)3 D. CrO2
40. 在硝酸介质中,欲使Mn2+氧化为MnO4-可加下列哪种氧化剂( )。
A. KClO3 B. K2Cr2O7
C. 王水 D.(NH4)2S2O8(△AgNO3催化)
41.有一含有Cl-、Br-、I-三种离子的混合溶液,今欲使I-氧化为I2,而不是Br-和Cl-氧化,该选用下列哪一种氧化剂( )
A. KMnO4 B. K2Cr2O7 C. Fe2(SO4)3 D. SnCl4
( 已知: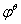 KMnO4/Mn2+=1.51V ,
KMnO4/Mn2+=1.51V , 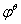 Cr2O72-/Cr3+=1.33V ,
Cr2O72-/Cr3+=1.33V ,
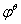 Fe3+/Fe2+=0.77V ,
Fe3+/Fe2+=0.77V ,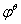 Sn4+/Sn2+=0.15V,
Sn4+/Sn2+=0.15V,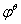 Cl2/Cl-=1.36V,
Cl2/Cl-=1.36V,
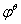 Br2/Br-=1.07V,
Br2/Br-=1.07V,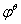 I2/I-=0.54V)
I2/I-=0.54V)
42. +3 价铬在过量强碱溶液中的存在形式为( )。
A. Cr(OH)3 B. CrO2- C. Cr3+ D. CrO42-
43. 已知:
MnO4- + 4H+ +3e® MnO2 + 2H2O 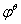 =1.695V
=1.695V
H2O2 + 2H+ +2e® 2H2O 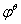 =1.77V
=1.77V
MnO2 +4H+ +2e® Mn2+ +2H2O 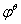 =1.23V
=1.23V
O2+2H+ +2e® H2O2 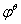 =0.68V
=0.68V
在酸性介质中,下列说法不正确的是( )。
A. MnO2可氧化H2O2 B. MnO2不能氧化H2O2
C. MnO4-可氧化H2O2 D. O2不能氧化Mn2+离子
44. 在酸性溶液中可以稳定存在的离子是( )。
A. CrO2- B. MnO4- C. Cr2O72- D. CrO42-
45. 实验室常用的洗液往往出现红色结晶,它是( )。
A. K2Cr2O7 B. CrO3 C. CrO5 D. Cr2O3
46.某化合物A是紫色晶体,化合物B是浅绿色晶体。将A、B混合溶于稀H2SO4中得黄棕色溶液C;在C中加KOH溶液得深棕色沉淀D;在D中加稀H2SO4,沉淀部分溶解得黄棕色溶液E;在E中加过量NH4F溶液得无色溶液F。在不溶于稀H2SO4的沉淀中加KOH、KClO3固体加热得绿色物质G;将G溶于水通入Cl2,蒸发结晶又得化合物A。问A、B、C、D、E、F、G各为何物质? 写出各反应的离子方程式。
47.现有一种钛的化合物A,它是无色液体,在空气中迅即冒白“烟”,其水溶液和金属锌反应,生成紫色溶液B,加入NaOH至溶液呈现碱性后,产生紫色沉淀C,过滤后,沉淀C用稀HNO3处理,得无色溶液D。将D逐滴加入沸腾的热水中得白色沉淀E,将E过滤灼烧后,再与BaCO3共熔,得一种压电性晶体F。试写出各步化学反应式并鉴别A、B、C、D、E、F各为何种物质?
五、练习题参考答案
1. A; 2.A,C; 3.A; 4.D; 5.C ;6.C; 7.C; 8.C; 9.D; 10.B 11.C ;12.B; 13.A,D; 14.A,B; 15.B,C; 16.A,D; 17.C ;18.C; 19.D; 20.B; 21.A,C ;22.C; 23.D; 24.D; 25.D; 26.D; 27.D;28.C; 29.A; 30.B,D; 31.C; 32.A; 33.C; 34.C; 35.C ;36.D; 37.C; 38.D 39.C; 40.D; 41.C; 42.B; 43.B; 44.C;45.B。
46.提示:A. KMnO4; B. FeSO4·7H2O; C. MnSO4、Fe2(SO4)3混合溶液;D. Fe(OH)3、MnO(OH)2混合沉淀; E. Fe2(SO4)3溶液;
F. [FeF6]3-溶液;G. K2MnO4
离子方程式:
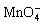 + 5Fe2+ + 8H+ = Mn2+ + 5Fe3+ + 4H2O
+ 5Fe2+ + 8H+ = Mn2+ + 5Fe3+ + 4H2O
Fe3+ + 3OH- = Fe(OH)3↓
Mn2+ +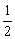 O2 + 2OH- = MnO(OH)2↓
O2 + 2OH- = MnO(OH)2↓
Fe(OH)3 + 3H+ = Fe3+ + 3H2O
 Fe
3+ + 6F
- = FeF
Fe
3+ + 6F
- = FeF
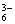
3MnO2 + KClO3 + 6KOH == 3K2MnO4 + KCl + 3H2O
2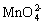 + Cl2 = 2
+ Cl2 = 2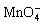 + 2Cl-
+ 2Cl-
47.提示:A. TiCl4 TiCl4 + 3H2O = TiO2·H2O + 4HCl↑
B. TiCl3 2TiCl4 + Zn = 2TiCl3 + ZnCl2
C. Ti(OH)3 TiCl3 + 3NaOH = Ti(OH)3↓+ 3NaCl
D. TiO(NO3)2 3Ti(OH)3 + 7HNO3 = 3TiO(NO3)2 + NO↑+ 8H2O
E. H2TiO3 TiO(NO3)2 + 2H2O = H2TiO3↓ + 2HNO3
 H
2TiO
3 == TiO
2 + H
2O
H
2TiO
3 == TiO
2 + H
2O
F. BaTiO3 TiO2 + BaCO3 = BaTiO3 + CO2↑
