实验一 双酚A的合成及红外检测
一、实验目的
1、掌握抗氧剂双酚A的合成原理和方法;
2、学习和熟练重结晶的操作方法。
二、实验原理
双酚A又称二酚基丙烷,化学名称为2,2´-二对烃基苯基丙烷,结构如下:
本品位无色结晶粉末,熔点155℃~158℃,密度1.95(20℃),溶于甲醇、乙醇、异丙醇、丁醇、乙酸、丙酮及二乙醚微溶于水,易被硝化、卤化、硫化、烃化等。
双酚A的合成有多种,大都由苯酚与丙酮合成,不同之处是采用的催化剂有别。本实验采用的是硫酸法,即苯酚与过量丙酮在硫酸的催化下缩合脱水,生成双酚A,其反应式为:
三、主要仪器和药品
分液漏斗,布氏漏斗,吸滤瓶,电动搅拌器,水浴锅,电热干燥箱,三口烧瓶,球形冷凝管,温度计,烧杯,量筒,滴液漏斗,托盘天平
硫代硫酸钠,苯酚,甲苯,丙酮,硫酸(78%),一氯醋酸
四、实验步骤
1、 在三口烧瓶中加入1.0g五水硫代硫酸钠加热熔化;
2、 再加入0.4g助催化剂一氯醋酸,混合均匀,加入10g苯酚及17ml甲苯,并将7ml 78%的硫酸缓缓加入烧瓶中;
3、 最后迅速一边搅拌,一边用漏斗滴加4ml丙酮滴加期间,瓶内物料温度控制在32~35℃,不得超过35℃,同时开启回流冷凝管的上水,约在10min内滴加完丙酮;
4、 然后在36~40℃下保温搅拌2h以上,将产物移入分液漏斗,用热水洗涤3次,每次水洗量约为50ml,水温为82℃,每次水洗时,一边搅拌一边滴加热水,加完水后,振荡使之混合均匀,再静置分层;
5、 放出下层液,将上层的物料移至烧杯中,一边搅拌一边用冷水冷却结晶;
6、 当冷至25以下,吸滤,用水洗涤滤饼,吸滤至干,得产品粗双酚A。
五、数据记录和处理
六、实验总结
通过这次实验我了解了抗氧剂双酚A的合成原理和方法,学习了离心机的操作方法,
学习了重结晶的操作方法,为以后工作、学习奠定了良好的基础。
实验二 十二烷基硫酸钠的合成
一、实验目的
1、 掌握高级醇硫酸酯盐型阴离子表面活性剂的合成工艺;
2、 了解高级醇硫酸酯盐型阴离子表面活性剂的主要性质和用途
二、实验原理
月桂醇用硫酸酸化:
三、主要仪器和药品
电动搅拌器,托盘天平,氢化钠吸收装置,三口烧瓶,滴液漏斗,烧杯,温度计,量筒;
月桂醇,硫酸,氢氧化钠。
四、实验内容
在装有温度计和电动搅拌器的100ml三口烧瓶中加入18.6g月桂醇,在25℃充分搅拌下用滴液漏斗与30 min内缓慢滴加6~7ml浓硫酸,滴加时温度不要超过30℃,注意起泡,勿使物料溢出。加完浓硫酸后升温至40~50℃,反应2h.
反应结束后,冷却至25℃,倒进烧瓶中,在搅拌下慢慢滴加30%氢氧化钠溶液进行中和至PH为7.0~8.5。
五、实验总结。
通过本次试验,我掌握高级醇硫酸酯盐型阴离子表面活性剂的合成工艺,并且了解了高级醇硫酸酯盐型阴离子表面活性剂的主要性质和用途。
实验三 十二烷基硫酸钠降低表面张力能力及CMC测定
一、实验目的
1、 掌握含固量、表面张力和泡沫性能和测定方法及有关仪器的使用方法。
二、实验原理
临界胶束浓度(CMC)即指形成胶束的最低浓度。形成胶束的表面活性剂溶液,由于溶液结构的变化导致溶液的一系列物理化学性质(如渗透压、浊度、光学性质、电导、表面张力等)发生转折性变化。在表面活性剂溶液的性质与浓度的关系曲线上,位于临界胶束浓度处出现转折点。
三、主要仪,器和药品
月桂醇,氢氧化钠,硫酸,广泛PH试纸
四、实验内容
1、将坐口烧杯,毛细管用橡皮胶真空管联接好,插入深度大于15mm
2、插上电源插头,打开电源开关,LED显示即停,初显示忽略(过量程时显示+1999),2秒后正常显示。预热5分钟后按下置零按钮显示为0000,表示此时系统大气压差为零。
3、LED显示值即为压力腔体的压力值。如果压力腔体的压力呈下降趋势。则出现的
极大值保留显示为一秒钟。
4、先以水作为待测液测定仪器常数,将干燥的毛细管垂直地插入到端面刚好与水面相切,打开其滴液漏斗控制滴液速度,使毛细管逸出的气泡速度约为5s~6s/个,在毛细管气泡逸出的瞬间最大压差在500~800Pa左右,通过手册查出实验温度时水的表面张力,利用公式计算出仪器常数K。
5、配制不同浓度的产品溶液。
6、用待测溶液洗净试管和毛细管,加入适量样品于试管中,按照仪器常数测定的方法,测定已知浓度的待测样品的压力差,代入公式计算其表面张力。
五、数据记录和处理
1、 仪器常数K的确定
实验温度:10℃

其中σ=K△P
2、 产品溶液表面张力的测定
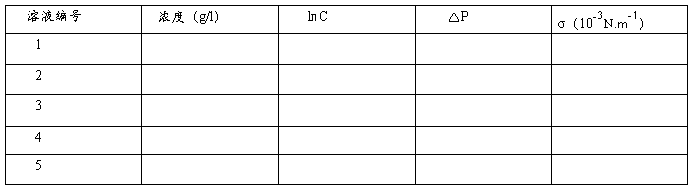
3、将所得数据作σ-㏑C图:
六、注意事项
1、 不要将仪器放置在有强电磁打扰的区域内;
2、 不要将仪器放置在通风的环境中,尽量保持仪器附近的气流稳定;
3、 压力极小值出现的时间间隔不能太小,否则显示值将恒为极大值;
4、 测定时毛细管要洗干净,否则气泡可能不能连续稳定地流过,而使微压
差测量仪读数不稳定,如发生此现象,毛细管应重洗;
5、 毛细管要保持垂直,管口刚好插到与液面接触;
6、 数字式微压差测量仪有峰值保持功能,最大压力会保持一秒钟左右,应读出气泡逸出时的最大压差。
实验四 聚乙烯醇缩甲醛胶的合成及粘度表征
一、实验目的
1、了解自由基加聚反应的机理
2、掌握聚醋酸乙烯乳液的合成原理和方法
二、实验原理
1、主要性质和用途
聚醋酸乙烯(PVAC)乳液制品别名白乳胶,化学式为 。本品为乳白色粘稠浓厚液体,具有优良的粘结能力,可在5~40℃的温度范围内使用,具有良好的成膜性,且无毒、无臭、无腐蚀性,但耐水性差。
2、合成原理
醋酸乙烯单体的聚合反应是自由基型加聚反应属连锁聚合反应
链引发:
链增长:
链终止:偶和终止
歧化终止
通常本体聚合、溶液聚合和悬浮聚合都用过苯甲酰和偶氮二异丁腈为引发剂,而乳化聚合则都用水溶性的引发剂过硫酸盐和过氧化氢等。悬浮聚合和乳液聚合都是在水介质中聚合成醋酸乙烯的分散体,但两者之间有明显的区别。
悬浮聚合一般用来生产分子量较高的聚醋酸乙烯,用少量聚乙烯醇为分散剂,用过氧化苯甲酰等能溶解于单体的引发剂,聚合反应是在分数的单体的液滴中进行的,一般制得颗粒约在0.2mm~1.0mm的聚合物珠体,所以也有称之为珠状聚合。
乳液聚合一般公认的说法是聚合反应早期是在乳化剂的胶束中,而后期是在聚合体中进行, 并不是在水相感乳化的单体液滴进行的。而乳液聚合的产物(乳胶粒子)通常是在0.2μm~5μm粒度的乳胶液。
三、主要仪器和药品
三口烧瓶(250ml),球形冷凝管,滴液漏斗(60ml),温度计(0~100℃),量筒(10,100ml),玻璃棒,烧杯(200ml)
醋酸乙烯,聚乙烯醇1799,乳化剂OP-10,邻苯二甲酸二乙酯,过硫酸钾,碳酸氢钠
四、实验内容
1、按照聚醋酸乙烯乳液的配方称取原料:
醋酸乙烯单体 46 邻苯二甲酸二丁酯 5
聚乙烯醇 2.5 蒸馏水 45.76
乳化剂OP-10(烷基酚与环氧乙烷缩合物) 0.5
过硫酸钾 0.09 碳酸氢钠 0.15
2、 将聚乙烯醇与蒸馏水加入三口烧瓶中加热至80℃,搅拌1h左右溶解完全。加乳化剂搅拌溶解均匀。之后加入醋酸乙烯单体的20%与过硫酸钾用量的40%,加热升温。当温度升至60~65℃时停止加热,通常在66℃时开始共沸回流,待温度升至80~83℃且回流减少时,开始以每小时加入总量20%左右的速度继续加入醋酸乙烯单体,控制在3h~4h左右将单体加完。控制反应温度在78~82℃,每小时加入过硫酸钾用量的15%~20%。加完单体后加入余下的过硫酸钾,因放热体系温度升至90~95℃,保温30min,冷至50℃以下后加入10%的碳酸氢钠水溶液和邻苯二甲酸二丁酯,控制PH=6,搅拌30min,冷却即为成品。
3、 产品粘度的测定
将洁净干燥的粘度计置于固定架上,调节使其处于水平状态。关上粘度计下部小孔,将冷却至室温的待测乳液倒入粘度计至满后,用玻璃棒沿水平方向抹去的余试样。将承受杯置于粘度计下方,打开小孔开关,记录胶水由细流状流出转变为滴流状流出所需时间。
五、数据记录与处理
t= s (利用粘度计测量胶水由细流状流出转变为滴流状流出,用秒表记录时间)
六、注意事项
1、过硫酸钾在每次加入时用水溶解成10%的水溶性;
2、醋酸乙烯单体必须是新精馏过的,因醛类和酸类有显著的阻聚作用,聚合物的分子量不易增大,使聚合反应复杂化;
3、乳液聚合中都用水溶性引发剂,如过硫酸盐和过氧化氢,本实验用过硫酸钾;
4、聚乙烯醇是聚醋酸乙稀乳液聚合的最常用的乳化剂,能降低单体和水的表面张力,提高在单体在水中的溶解度。
5、在按上述配方操作时,开始反应时加入过硫酸盐作引发剂,由于聚合反应过程中回流和连续缓慢加入单体,温度可在一段时间内无需加热或冷却既可保持在80℃左右。
实验五 改性聚乙烯醇缩甲醛涂料的配置
一、实验目的
学会配置聚醋酸乙烯乳液涂料及其改性方法
二、实验原理
1、主要性能和用途
聚醋酸乙烯乳胶涂料为乳白色粘稠液体,可加入各色色浆配成不同颜色的涂料。主要用于建筑物的内、外墙涂料。该涂料以水为溶剂,具有安全无毒、施工方便的特点,易喷涂、刷涂和滚涂,干燥快、保色性好、透气性好,但光泽较差。
2、配置原理
通过乳液聚合得到聚合物乳液,其中聚合物以微胶粒的状态分散在水中。当涂刷在物体表面时,随着水分的挥发,微粒互相挤压而形成连续而干燥的涂膜,这是乳胶涂料的基础。另外,还要加入颜料、填料以及各种助剂如成膜助剂、颜料分散剂、增稠剂、消泡剂等通过高速搅拌,匀质而成乳胶涂料。
三、主要仪器和药品
搪瓷杯、高速匀质搅拌机、砂磨机、水浴锅、调漆刀、漆刷、水泥石棉样板、聚醋酸乙烯乳液、去离子水、六偏磷酸钠、丙二醇、钛白粉、碳酸钙、磷酸三丁酯
四、实验步骤
1、涂料的配制。把20g去离子水、5g10%六偏磷酸钠水溶液以及2.5g丙二醇加入搪瓷杯中,开动高速匀质搅拌器,逐渐加入18g钛白粉,8g滑石粉和6g碳酸钙,搅拌分散均匀后,加入0.3g磷酸三丁酯,继续快速搅拌10min,然后在慢速搅拌下加入40g聚醋酸乙烯酯乳液,直至搅匀为止,既得白色涂料。
2、成品要求:
外观:白色稠厚流体; 固含量:50%; 干燥时间:25℃表干10min,实干24h
3、性能测定。涂料水泥石棉样板,观察干燥速度,测定白读、光泽并作耐水性试验,制备好作耐湿擦性德样板,做耐湿擦性实验。
五、注意事项
在搅匀颜料,填充料时,若粘度太大难以操作,可适量加入乳液至能搅匀为止,最后加乳液时,必须控制搅拌速度,防止产生大量泡沫。
实验六 洗洁精的配置
一、实验目的
1、掌握洗洁精的配制方法
2、了解洗洁精各组分的性质及配方原理
二、实验原理
设计洗洁精的配方结构时,应根据洗涤方式、污垢特点,被洗物特点,以及其他功能要求,具体可归纳为以下几条:
1、基本原则
(1) 对人体安全无害;
(2) 能较好地洗净并除去动植物油垢,即使对粘附牢固的油垢也能迅速除去;
(3) 清洗剂和清洗方式不损伤餐具,灶具及其他器具;
(4) 用于洗涤蔬菜和水果时,应无残留物,也影响其外观和原有风味;
(5) 手洗产品发泡性良好;
(6) 消毒剂应能有效地杀灭有害菌;
(7) 产品长期贮存稳定性好,不发霉变质
2、配方结构特点
(1)洗洁精应制成透明状液体,要设法调配成适当的浓度和粘度;
(2)设计配方时,一定要充分考虑表面活性剂的配伍效应,以及各种助剂的协同作用;
(3)洗洁精一般都是高碱性,主要为提高去污力和节省活性物,并降低成本,但PH不能大于10.5;
(4)高档的餐具洗涤剂要加入釉面保护剂;
(5)加入少量香精和防腐剂。
3、主要原料
洗洁精都是以表面活性剂为主要活性物配制而成的,手工洗涤用得洗洁精主要使用烷基苯磺酸盐和烷基聚氧乙烯醚硫酸盐,其活性物含量大约为10%~15%
三、主要仪器和药品
电炉,水浴锅,电动搅拌器,温度计,烧杯,量筒,托盘天平,滴管,玻璃棒
十二烷基苯磺酸钠,脂肪醇聚氧乙烯醚硫酸钠,椰子油酸二乙醇酰胺,壬基酚聚氧乙烯醚,乙醇,甲醛,乙二胺四乙酸,三乙醇胺,香精,PH试纸,苯甲酸钠,氯化钠,硫酸
四、实验步骤
1、操作步骤
(1) 将水浴锅中加入加入水并加热,烧杯中加入去离子水加热至60℃左右;
(2) 加入AES并不断搅拌至全部溶解,此时水温要控制在60~65℃;
(3) 保持温度60~65℃,在连续搅拌下加入其他表面活性剂搅拌至全部溶解为止;
(4) 降温至40℃以下,加入香精、防腐剂、螯合剂、增溶剂、搅拌均匀;
(5) 测溶液的PH,用硫酸调节PH至9~10.5;
(6) 加入食盐调节到所需的粘度,调节之前应把产品冷却到室温或粘度计标准温度。
洗洁精的几种配方(cot%)
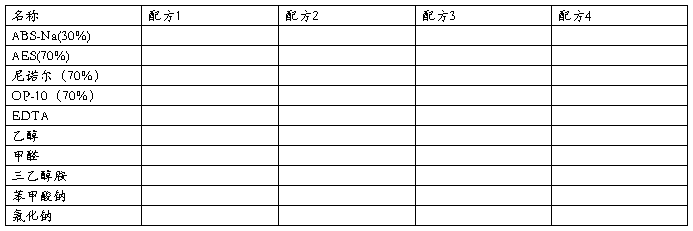
各配方加香精、硫酸(调PH)适量,加去离子水至100ml。
实验七 雪花膏的配置
一、实验目的
1、了解雪花膏的配制原理和各组分作用;
2、掌握雪花膏的配制方法。
二、实验原理
雪花膏通常是以硬脂酸皂为乳化剂的水包油型乳化体系,水相中含有多元醇等水溶性物质,油相中含有脂肪酸、长链脂肪醇、多元醇脂肪酸酯等非水溶性物质。当雪花膏被涂于皮肤上,水分挥发后,吸水性的多元醇与油性组分共同形成一个控制表皮水分过快,蒸发的保护膜,它隔离了皮肤与空气的接触,避免皮肤在干燥环境中由于表皮水分过快蒸发导致皮肤干裂。也可以在配方中加入些可被皮肤吸收的营养性物质。
三、主要仪器和药品
1、烧杯,电动搅拌器,温度计,显微镜,托盘天平,电炉,水浴锅;
2、硬脂酸,单硬脂酸甘油酯,十六醇,白油,丙二醇,氢氧化钠,香精,防腐剂,精密PH试纸。
四、实验内容
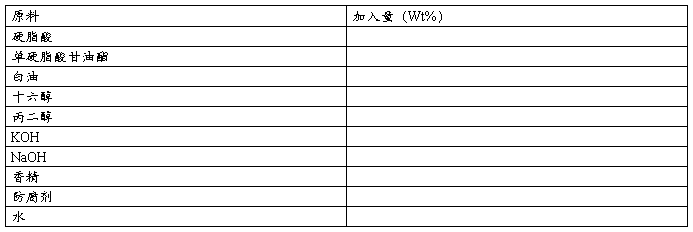
1、实验步骤:按配方中的量分别称量硬脂酸、单硬脂肪、白油、十六醇和丙二醇,将称量好的原料加入250ml烧杯中,水和碱称量后加入另一250ml烧杯中,分别加热至90℃,物料熔化,溶解均匀。装水的烧杯在90℃下保持20min灭菌。然后在搅拌下将水慢慢加入油相中,继续搅拌,当温度降至50℃时,加入防腐剂,降温至40℃,加入香精,搅拌均匀。静置,冷却至室温,调整膏体和PH,使其在要求的范围内。
2、配方
五、注意事项
1、加入少量NaOH有助于增大膏体粘度,也可以不加;
2、降温至55℃以下,继续搅拌使油相分散更细,加速皂与硬脂酸结合形成结晶,出现珠光现象;
3、降温过程,粘度逐渐增大,搅拌带入膏体的气泡,不易逸出,因此粘度较大时,不易过分搅拌;
4、使用工业一级硬脂酸,可使产品的色泽及储存稳定性提高。
实验八 煤中碳、氢的测定
一、实验目的
1、了解BCH-1型半自动碳氢测定仪的使用方法;
2、熟悉煤中碳氢元素的测定原理和方法。
二、实验原理
煤样于800℃在高猛酸银热解产物作用下,在氧气流中燃烧,生成的水与Pt-P2O5电解池中五氧化二磷反应生成偏磷酸,其反应方程式如下:
随着电解反应的进行,偏磷酸越来越少,生成的氧气和氢气随氧气流排出,而五氧化二磷得以再生,电解电流也随之下降。当电解电流降至终点电流时,电解结束。根据电解所消耗的电量应用法拉第定律: ,即可计算出煤中氢的含量。
煤样燃烧生成的二氧化碳用二氧化碳吸收剂吸收,吸收剂一般选用碱石棉,主要
成份为氢氧化钠。其吸收反应方程式如下:
根据吸收剂的增量,计算煤中碳的含量,试样中硫和氯对测定产生的干扰可用高锰酸银热解产物除去,氮对碳的干扰由活性粒状二氧化锰除去。
三、主要仪器和药品
BCH-1型半自动碳氢测定仪及其辅助器具;
变色硅胶,氢氧化钠,无水高氯酸镁,氧化铜,碱石棉,高锰酸银,热解产物,二氧化锰,三氧化铬,硫酸,Pt-P2O5电解池涂膜液
四、实验内容
1、试剂预准备:
(1)高锰酸银热解产物的配制方法:称取100g高锰酸钾溶于2L蒸馏水中,另取107.5g
硝酸银先溶于50ml蒸馏水中,在不断搅拌下,倾入沸腾的高锰酸钾溶液中搅拌均匀,逐渐放冷,静置过夜则生成有光泽的晶体,用真空泵抽滤,再用蒸馏水洗涤数次,在60℃~80℃干燥4h,每次取少量晶体放在器皿中,在酒精灯上加热分解得疏松银灰色残渣,即高锰酸银。
(2)电解池涂膜液的配制方法:分别量取3ml磷酸,7ml丙酮倒入10ml量筒中,充分摇匀即可。
2、碳氢分析操作步骤
(1)打开氧气路,通冷却水,调节氧气吸入器旋钮,使流量指示为80ml/min,调节冷却水使水流出时呈细水柱状即可;
(2)开启电源,在升温的同时,做U型管恒重实验,将二氧化碳吸收管膜口塞旋开,与系统连接,并接上气泡计,接通氧气使氧气流速保持80ml/min,按一下“复位”键,待仪器极点(10min)后,取下吸收管,关闭活塞。在天平旁放置10min左右,称量。再与仪器相连接,重复上述实验直到二氧化碳吸收管质量变化不超过0.0005g时为恒重;
(3)选择极性开关,仪器的极性转换键应每天交换,这对维持电解池良好工作状态大有益处;
(4)待三段炉温升至需要的温度指示值后,即可做正式样品分析;
(5)废样做完后,在预先灼烧过的燃烧舟中充取粗度小于0.2mm的空气干燥煤样70~75mg(标准值到0.0002g)的样品并均匀平铺,在煤样上盖一层三氧化铬,可把此燃烧舟暂存入不带干燥剂的容器中;
(6)接上已恒定量的三氧化碳吸收管和气泡计,并以80ml/min的流速通入氧气。按“预处理”键,将电解池电解到终点,清除残余水分。打开带有镍、铬丝推棒的橡皮塞,迅速将燃烧舟放入燃烧管入口端,及时塞紧带推棒的橡皮塞,用推棒推动燃烧舟,使舟的一半进入燃烧炉口,待样品燃烧平衡无火星,即可将全舟推入高温区,并立即拉回推棒,不要让推棒红热部分回拉到靠近橡皮塞处,以免过热分解。
(7)10min后,取下二氧化碳吸收管,关闭活塞,在天平旁放置10min后称量(称量时应瞬间旋开一下U形管旋塞),记下仪器读数。打开带推棒橡皮塞,用带钩镍铬丝棒取出燃烧舟,塞上带推棒橡皮塞。
(8)氢空白值的测定
在三段炉温达到指定温度后,保持氧气流速为80ml/min,按“预处理”键,将电解池点解到终点,清除系统残余水分。在一个预先灼烧过的燃烧舟内加适量的三氧化铬(数量和煤样分析时相当),打开带推棒的橡皮塞放入燃烧舟,塞紧橡皮塞,按“空白”键。用推棒将燃烧舟一次性推到高温带,立即拉回推棒,9min后仪器自动点解,等待点解到达终点后,记下仪器显示的氢毫克数,若两次空白值相差不超过0.05mg,则取两次测定的平均值为当天氢的空白值。
样品分析结束后,关掉电源、水源、气路,将气泡计调过来接到无水高氯酸镁U形管上。
3、结果计算
(1)氢值计算
总氢值H为:
分析基氢值Had为:
干基氢值Hd:
上列各式
m2:仪器氢的显示数,mg m:试样重量,mg
m3:测定氢的空白值,mg Mad:分析煤样的水分值
(2)碳值计算
分析基碳值Cad为:
干基碳值Cd:
五、实验数据记录和处理
实验九 煤中全硫的测定
一、实验目的
1、学会使用库仑测硫仪测定煤中硫含量;
2、了解仪器的分析原理和工作原理。
二、实验原理
该仪器根据动态库伦分析原理,通过双铂指示电极检测和控制滴定过程,点解电流随被测样品中硫含量的增减,实现了动态跟踪滴定,以得准确的测定结果。
含硫样品在高温(如1150℃)状态下,经催化剂(三氧化钨)催化作用,干净化空气中燃烧,生成二氧化硫及少量三氧化硫。
样品中各种形态的硫氧化分解如下:
样品中有机硫+
样品中的硫酸盐+
生成的二氧化硫及少量三氧化硫随净化空气载入电解池中,与电解液中的水化合成亚硫酸及少量硫酸,电解液中碘-碘化钾的动态平衡被破坏,指示电极间的信号发生变化,该信号经放大后,去控制电解电流,电解产生碘。
电极及电解液反应如下:
电解阳极:
电解阴极:
随着电解的不断进行,电解液中原有的碘化钾平衡得到恢复,指示电极间信号重新回到零,电解终止。溶液处于平衡态时,指示电极上存在如下可逆平衡:
指示阳极:
指示阴极:
仪器上根据电生碘所消耗的电量,由法拉第定律(W )计算出试样中全硫量及百分含量。
三、主要仪器和药品
库伦测硫仪主机,裂解炉,点解池,搅拌器,电磁泵,空气净化系统;
碘化钾,溴化钾,三氧化钨,浓硫酸,重铬酸钾,变色硅胶,氢氧化钠,冰乙酸,蒸馏水,煤样。
四、实验内容
1、称量:要求天平准确度为万分之一,瓷舟洁净,称量前样品反复搅拌均匀,取样50mg,
称量准确到0.2mg.
2、含硫样品测定步骤:
(1)将炉升温到1150℃±10℃,将抽气泵的抽速调到1000ml/min,在供气和抽气条件下,将配好的电解液吸入电解池开动搅拌器,使搅拌子快速旋转。
(2)于瓷舟中称取粒度小于0.2mm的样品50mg,样品上覆盖一层薄薄的三氧化钨。将瓷舟置于石英舟上,按【重量】键,在“P4”提示符下,按相应数字键,显示器上将显示样重,按【键入】后,按【启动】键,即自动进行,进行硫含量测定;显示器上“mg”指示灯亮,表示显示硫的毫克数,测定结束后,舟自动退回,并蜂鸣三声,“S%”指示灯亮,显示硫的百分含量并打印结果。
3、试验结束后,按【降温】键,降温,关闭搅拌器,停止电磁泵供气和抽气,放出电解液,用蒸馏水冲洗电解池后,关注机电源,裂解炉温降至600℃时拔下理解炉插座。
4、测试数据必须进行处理,将st.ad值换车st.d值,公式如下:
五、实验数据记录和处理
实验十 利用原子吸收分光光度计检测煤灰成分
一、实验目的
1、初步认识原子吸收分光光度计;
2、初步了解原子吸收分光光度计的使用方法和工作原理;
3、学会利用原子吸收分光光度计检测煤灰成分;
二、实验原理
1、性质:原子吸收分光光度计又称原子吸收光谱仪。分为单光束型和双光束型。利用待测元素基态原子对特征辐射选择吸收的原理,进行金属与半金属元素分析的一种高灵敏、准确的测量仪器。由锐线光源、火焰或石墨炉原子化器、光学系统及检测系统构成。具有选择性好、干扰少,灵敏、准确、简便、快速、应用广泛等优点。广泛应用于特种气体、金属有机化合物、金属醇盐中微量元素的分析;
2、灰样经氢氟酸、高氯酸分解,在盐酸介质中,使用空气-乙炔火焰进行原子吸收测定。
三、主要仪器和药品
原子吸收分光光度计,光源,分析天平,电热板,聚四氟乙烯坩埚,容量瓶;
氢氟酸,高氯酸,盐酸,钾、钠、钙、镁、铁等元素标准储备溶液,斓溶液,锶溶液,铝溶液,铁、钙、镁混合标准工作溶液,钾、钠、锰混合标准工作溶液;
四、实验内容
1、灰样的制备
将分析煤样按GB212-91《煤的工业分析方法》中缓慢灰化法(3.1)规定的灰化条件烧成煤灰。再将煤灰用玛瑙乳钵研细到全部通过 16。目筛孔,装入磨口瓶中,存放在干燥器内。称样前应将灰样在815±10℃灼烧 30min。
2、样品分解
称取灰样(5.1)0.1士0.01g,精确至0.0002g于聚四氟乙烯柑祸中,用水润湿,加2ml高氯酸、10ml氢氟酸,置于电热板上缓缓加热(温度不高于250℃),蒸至白烟基本冒尽,取下坩埚,稍冷,加入(1+1)盐酸10ml、水10mI,再放在电热板上加热至近沸并保持2min,取下坩埚、用热水将坩埚中的试样溶液转入100ml容量瓶中,冷至室温,加水稀释至刻度,摇匀。此溶液为原液。
注:每分解一批试样应作一个试剂空白,试剂空白除不加灰样外,其余操作同样品分解。
3、待测样品溶液的制备
铁、钙、镁待测样品溶液:准确吸取原液5mI于50mL容量瓶中,加斓溶液2ml(用锶作释放剂时,改为加锶溶液2mL),(1十3)盐酸溶液 1mL,加水稀释至刻度,摇匀。
钾、钠、锰待测样品溶液:准确吸取原液5mL于50ml容量瓶中,加(1+3)盐酸溶液
1mL,加水稀释至刻度,摇匀。
4、混合标准系列溶液的制备
铁、钙、镁混合标准系列溶液:分别吸取铁、钙、镁混合标准工作溶液0,1.0,2.0,3.0,4.0,5.0,6.0,7.0,8.0,9.0,10.0ml于100mL容量瓶中,各加斓溶液4ml(用锶作释放剂时改为加锶溶液4m1和铝溶液3ml),(1+3)盐酸溶液4ml,,用水稀释至刻度,摇匀。此标准系列溶液的三氧化二铁及氧化钙的浓度为0~20μg/ml、氧化镁浓度为0~5μg/mL.
钾、钠、锰混合标准系列溶液:分别吸取钾、钠、锰混合标准工作溶液0,1.0,2.0,3.0,4.0,5.0,G.0.7.0,8.0,9.0,10.0ml于100ml容量瓶中,各加(1+3)盐酸溶液4ml,用水稀释至刻度,摇匀。此标准系列溶液氧化钾、氧化钠及二氧化锰浓度为0~5μg/mL.
注:混合标准系列溶液的浓度间隔视仪器性能及工作曲线弯曲情况可增大或减小。
5、测定:按确定的仪器工作条件,分别测定样品溶液及标准系列溶液中相应元素的吸光度。
6、工作曲线的绘制:以标准系列中测定的成分浓度为横坐标、吸光度为纵坐标,于坐标纸上绘制各测定成分的工作曲线。
五、实验数据记录和处理
由徉品溶液中测定成分的吸光度在相应成分的工作曲线上查出该成分的浓度(Kg/ml,),按式(1)计算其百分含量: RmOn(%)=c×0.001 ×100
m
式中RmOn---K2O,Na2O,Fe2O3,CaO,MgO,Mn02等各测定成分;
c-----在工作曲线上查得的测定成分的浓度,μg/mL;
m-----样品质量,g。
六、实验总结
通过这次实验我初步认识了原子吸收分光光度计,初步了解了原子吸收分光光度计的使用方法和工作原理,同时学会了利用原子吸收分光光度计检测煤灰成分。
实验十一 两性离子型聚丙烯酰胺的合成及应用试验
一、实验目的
1、研究两性离子型聚丙烯酰胺的聚合方法;
2、掌握聚丙烯酰胺的合成原理,学会如何使用乌式粘度计;
3、使合成的目标产物能够对煤泥水产生絮凝效果;
4、增强对选煤、污水处理的认识。
二、实验原理
本次实验采用单体丙烯酰胺(AM),阳离子单体甲基丙烯酰氧乙基三甲基氯化铵DMC,阴离子单体丙烯酸钠AANa通过水溶液共聚法,加入光引发剂进行自由基聚合反应,制得两性离子型聚丙烯酰胺AmPAM。通过测定固含量,特性粘数探讨聚合反应条件,并以AmPAM的特性粘度为指标,,通过絮凝实验来确定AmPAM的絮凝效果。
三、主要仪器和药品
乌式粘度计,581-G型光电比色计,电热恒温真空干燥箱,加热磁力搅拌器,FTIR红外光谱仪,分析天平,恒温水浴装置,烧杯,量筒,滴管;
丙烯酰胺AM,阳离子单体DMC,丙烯酸引发剂,氢氧化钠,去离子水,以及一些检测药品。
四、实验内容
1、实验步骤:
(1)分别称取一定量的丙烯酸酰胺固体和甲基丙烯酸酰氧乙基三甲基氯化铵液体,用去离子水溶解并配成一定浓度的AM和DMC溶液待用;
(2)分别称取一定量的氢氧化钠固体放入透明塑料杯中加去离子水溶解,量取一定量的丙烯酸AA液体加入氢氧化钠溶液中配成丙烯酸钠溶液;
(3)量取AM和DMC溶液,依次将AM和DMC溶液加入塑料杯中;
(4)加入光引发剂氮驱氧4min,通完氮气后,用透明薄膜将杯口封住;
(5)置于紫外光照射,并不定时观察反应现象,待反应结束后老化24小时,进行性能检测。
2、性能检测
(1)固含量的测定:先称取干净的玻璃表面皿的质量再称取一定量的样品(0.5~0.6g)均匀涂抹于玻璃表面皿上,记录皿和样的总质量。将涂好样品的玻璃皿放在真空干燥箱内烘干,温度设置在103~105℃条件下干燥5h。取出烘干的试样,立刻称量并记录干燥好的样和皿的总质量。
S=m/m0 ×100
式中:S 试样的固含量,%; m 干燥后试样质量,g; m0 干燥前试样质量,g;
(2)特性粘数【η】的测定:
【η】=
t ------- 试样溶液的流经时间,S;
ηr ---- 相对粘度;
t0 ------- 1.00mol/L,氯化钠溶液的流经时间,S;
试样溶液的配制:在已准确称量的100ml烧杯中,称入胶状聚丙烯酰胺试样0.66~1.25g,精准至0.0001,搅拌溶解后,转移入250ml容量瓶中摇匀,用干燥的玻璃砂芯漏斗过滤,即得试样浓度约为0.0005~0.001g/L,放在恒温水浴中备用。
五、实验总结
通过这次实验我了解了两性离子型聚丙烯酰胺的聚合方法,掌握了聚丙烯酰胺的合成原理,学会了如何使用乌式粘度计,增强了对选煤、污水处理的认识,相信对我以后的工作学习有很大帮助。
