山东医学高等专科学校(济南)教案首页
山东医学高等专科学校(济南)教案附页
实验二 沸点的测定
一、实验目的
1.掌握沸点测定的方法、蒸馏操作原理和技术
2.了解蒸馏在生产实际中的应用
二、实验原理
蒸馏是利用液体混合物沸点不同而进行分离和纯化液体混合物的一种方法。通过蒸馏还可以测出化合物的沸点。对判断液体化合物的纯度也有一定的意义。
液体的蒸气压随温度的升高而增大,当液体的蒸气压增大到与外界施于液面的总压力(通常是大气压力)相等时,就有大量气泡从液体的内部逸出,溶液沸腾。这时的温度,即为该液体的沸点。沸点是指在一定压力下,液体沸腾时的温度。通常所说的沸点是指在1.013×105 Pa压力下液体的沸腾温度。纯粹的液体化合物在一定压力下具有一定的沸点,而且其沸点范围(沸程)也极小(0.5~1.0℃)。 将测出的化合物沸点与手册相比较,即可判断该化合物是什么物质。所以沸点测定也是鉴定有机物及其纯度的一种方法。
将液体加热至沸腾,使液体变为蒸气,然后使蒸气冷却凝结为液体收集于另一容器中,便可再度获得这一液体,这个操作过程称为蒸馏。通过蒸馏可将沸点不同的液体混合物分离开来,也可将挥发性物质和不挥发性物质分离开来。显然,液体混合物各组分的沸点相差越大,分离的效果越好。
液体被加热时,液体底部和玻璃受热的接触面上就有细小的气泡形成,作为液体气化的气化中心――气芽。溶解在液体内部的空气、粗糙的玻璃表面有助于“气芽”的形成。达到沸点后,液体气化产生气体释放至气芽中,当气泡足够大时,便会上升逸出液面,液体平稳地沸腾。但是,若液体中几乎不存在空气,瓶壁又非常洁净和光滑形成“气芽”非常困难,这样,在加热时可能液体温度上升到超过沸点很多也不沸腾,这种现象称为“过热”。当过热现象发生时,一旦有一个气泡形成,液体迅速气化产生大量气体释放至小气泡中,因而上升的气泡增大非常快,甚至可以将液体冲溢出瓶外,这种不正常的沸腾现象称为“暴沸”。为了防止“暴沸”的发生,使液体平稳地沸腾,在加热前就要引入“气芽”,加入助沸物是最好的方法。助沸物一般是表面疏松多孔,可吸附空气的物质如沸石、无釉的瓷片、一端封口的毛细管(毛细管应有足够的长度,上端搁在蒸馏烧瓶颈部,开口端朝下)等。
三、实验用品
蒸馏烧瓶(容积比欲蒸馏液体的体积大1/3~1/2)温度计 (100℃) 冷凝管 接引管 (也称牛角管) 锥形瓶(两个,用于收集馏出液体) 沸石(或无釉瓷片、或一端封口的毛细管) 烧酒(水∶酒精=1∶1)。
四、实验操作
(一)仪器装置
如图:蒸馏装置由蒸馏烧瓶、温度计、冷凝管、接引管和锥形瓶组成。

图17-1 实验装置
按图将各仪器组装好。安装顺序一般是从热源处(酒精灯或煤气灯)开始,“由下而上,由左到右”。放好酒精灯的位置,将石棉网放在铁圈上,使酒精灯的外焰与内焰交界处恰好位于石棉网底部,蒸馏烧瓶用铁夹垂直夹好,调整冷凝管角度与蒸馏烧瓶支管同轴,用铁夹夹好,然后沿轴移动冷凝管与蒸馏烧瓶相连,才不致折断蒸馏烧瓶支管。各铁夹不应夹得太紧或太松,以夹住后稍用力能转动为宜。铁夹内要垫以橡皮等软性物质,以免夹破仪器。整个装置要求准确端正,无论从正面或侧面观察,全套装置中各仪器的轴线都在同一平面内,铁夹和铁架台要尽可能整齐地放在仪器的侧面或背后。
(一)蒸馏及沸点测定
1.加料 取欲蒸馏的烧酒少许,放入小表面皿中,用火柴点燃,不能燃烧(如能燃烧,则应稀释至不能点燃,以资比较)。
用量筒量取30mL烧酒,称取其重量(样品+量筒重)记录数据。将烧酒通过漏斗或直接沿支管口对面的烧瓶壁小心倒入蒸馏烧瓶中,注意不要使液体从支管流出。加入几粒沸石,塞好带有温度计并调整好高度的塞子。再次检查装置的气密性。
2.蒸馏 向冷凝管中通入冷凝水(为节约用水,控制水流速在以流出水微热为宜)。用小火加热至烧瓶内液体逐渐沸腾,蒸气经支管进入冷凝管冷凝流下滴入接受器中。记下第一滴馏出液滴入接受器时的温度。此时收集的馏分称为“馏头”。常为沸点较低的杂质,应弃去不要。“馏头”蒸完,温度趋于稳定时,蒸出的就是较纯的物质。这时应更换洁净干燥的接受器收集馏出液体,并调节火焰,控制加热速度,通常以每秒馏出1~2滴液体、温度计水银球上常有冷凝的液滴悬挂为宜。记下这部分液体开始馏出和最后一滴馏出时的温度,即为液体的沸程。纯净的液体沸程较窄,由此可判断化合物的纯度。(由于酒精与水在78.2℃时形成二元恒沸混合物,该恒沸混合物中含有4.4%的水和95.6%的乙醇,所以此时收集的馏出液为95.6%的酒精,而不是纯酒精)。仔细观察温度计温度的变化,当温度开始上升,超过恒定温度时即可停止加热,注意千万不要将液体蒸干,以免蒸馏烧瓶破裂以及发生其他意外事故。
3.蒸馏完毕 蒸馏完毕,应先停火,后停水,待烧瓶冷却后,拆除仪器。拆除仪器的顺序与装配顺序相反,先取下接受器,然后拆下接引管、冷凝管和蒸馏烧瓶清洗。
4.计算得率 将收集的馏分转入量筒中,称量蒸出的液体总重量,计算得率。取少许蒸馏出的烧酒倒入表面皿中,点燃,有淡蓝色的火焰。
五、注意事项
(一)装置安装应注意
1.根据蒸馏物的量选择蒸馏烧瓶的体积,一般是使蒸馏物的体积不超过瓶体积的三分之二,也不少于三分之一。
2.温度计通过软木塞插入瓶颈中央,调整温度计的位置,使温度计的水银球能完全被蒸气所包围,这样都能准确测定蒸气的温度,通常是使温度计水银球的上沿与蒸馏烧瓶支管的下沿在同一水平线上。
3.蒸馏烧瓶的支管通过木塞和冷凝管相连,支管口应伸出木塞2~3cm左右。
4.直形冷凝管的下端为冷却水进水口,上端为冷却水的出水口,出水口高于进水口,以保证管内充满冷凝水。
5.接引管下端伸入锥形瓶中,但不可用塞子塞住,而应与大气相通。若蒸馏物为易挥发、易燃或蒸气有毒性的物质,则应在通风橱内进行。
(二)加入沸石时应注意
6.沸石应在加热前加入。
7.切忌将沸石加入已受热接近沸腾的液体中,如果加热前忘记加沸石,补加时必须先停止加热,待液体冷却至沸点以下后再加入。
8.沸石不能重复使用。
思考题
1.解释名词 (1)沸点 (2)蒸馏 (3)过热 (4)暴沸
2.安装蒸馏装置应注意哪些问题?
3.蒸馏操作中,蒸馏烧瓶中为什么要加入沸石?想一想,哪些有机化学实验中还需加入沸石?
4.为什么用过的沸石不能再用?
第二篇:熔点、沸点及其测定

有 机 化 学 实 验 报 告

实 验 名 称: 熔点、沸点及其测定
学 院: 化学工程学院
专 业: 化学工程与工艺
班 级: 10-6班
姓 名: 学 号
指 导 教 师: 邵琼芳 陈斌
日 期: 2011.10.15
熔点及其测定
一、 实验目的
1. 了解熔点测定的原理和意义。
2. 掌握毛细管法测定熔点的操作。
3. 了解显微熔点测定仪和全自动熔点仪的使用方法。
二、 实验原理
熔点是纯净有机物的重要物理常数之一。它是固体有机化合物固液两态在大气压力下达 成平衡的温度,纯净的固体有机化合物一般都有固定的熔点,固液两态之间的变化是非常敏锐的,自初熔至全熔(称为熔程)温度不超过 0.5~1℃。 加热纯有机化合物,当温度接近其熔点范围时,升温速度随时间变化约为恒定值,此时用加热时间对温度作图(如图 1)。
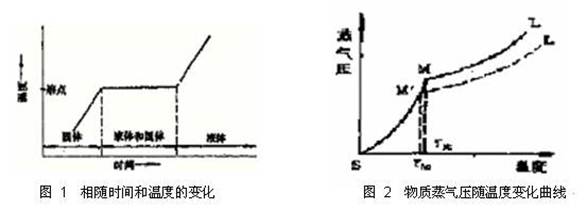
化合物温度不到熔点时以固相存在,加热使温度上升,达到熔点。开始有少量液体出现, 而后固液相平衡。继续加热,温度不再变化,此时加热所提供的热量使固相不断转变为液相,两相间仍为平衡,最后的固体熔化后,继续加热则温度线性上升。因此在接近熔点时,加热 速度一定要慢,每分钟温度升高不能超过 2℃,只有这样,才能使整个熔化过程尽可能接近 于两相平衡条件,测得的熔点也越精确。当含杂质时(假定两者不形成固溶体),根据拉乌耳定律可知,在一定的压力和温度条 件下,在溶剂中增加溶质,导致溶剂蒸气分压降低(图 2 中M´L´),固液两相交点M´即代表 含有杂质化合物熔点时的固液相平衡共存点,TM´为含杂质时的熔点,显然,此时的熔点较纯粹者低。
三、 主要试剂及物理性质
试剂:石蜡油、甲苯酸、奈、未知物质
仪器:温度计、 B型管 (Thiele管) 、毛细管、玻璃管、酒精灯、表面皿
物理常数:

四、 试剂用量规格
毛细管底部2~3mm。
五、 实验仪器装置示意图

六、 实验步骤

七、 实验数据记录和处理
表 熔点测定数据记录表

八、 实验讨论
熔点测定可能产生误差的因素:
1、肉眼观察的温度存在误差,且不能及时记录温度数据,影响实验结果。
2、样品粉碎不够细。使得样品填装不结实,产生空隙,则不易传热,造成熔程变大。
3、熔化过程中,加热速度过快导致测量误差。
4、样品本身存在杂质影响实验结果。
沸点及其测定
一、 实验目的
1. 了解沸点测定的意义。
2. 掌握微量法测定液体沸点的原理和方法。
二、 实验原理
沸点是指液体的蒸气压与外界大气压相等时的温度。纯液体物质有固定的沸点,不纯时沸程很长,常超过3度。沸点的测定,有常量法和微量法两种,样品不多时,通常采用微量法即毛细管法。本实验就是采用微量法测定液体的沸点,并与已知数据比较。
三、 主要试剂及物理性质
试剂:丙酮、乙醇、未知物、石蜡油
仪器:温度计、 B型管(Thiele管) 、毛细管、玻璃管(5mm一端封口)、酒精灯、铁架台(含铁夹)、胶头滴管、橡皮圈
物理常数:

四、 试剂用量规格
玻璃管底部约1cm液体.
五、 仪器装置示意图
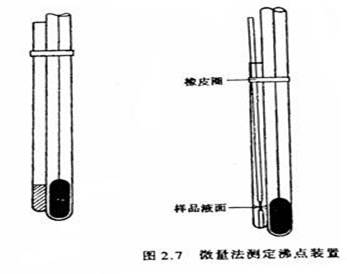
六、 实验步骤

七、 实验结果数据记录及处理
表沸点测定数据记录表

八、 实验讨论
1、 试样液体不纯,导致测得液体沸点降低。
2、肉眼读取温度计的读数存在误差,且不能及时记录温度数据,影响实验结果。
3、毛细管管内有气泡,对实验观测结果有一定的影响。
4、加热速度过快,影响实验观察。
