实验报告

一、实验目的
1、 巩固层状硅酸盐矿物的晶体结构知识;
2、 观察并熟悉粘土胶粒的电泳现象,即用宏观电泳仪测定粘土胶体的电泳速度并计算其Zeta电位,进行电解质对Zeta 电位影响的实验;
3、 掌握测定粘土阳离子交换容量的方法;
4、 通过实验增强材料结构与性能之间关系的理解。
二、实验装置及设备
1、 高岭石、蒙脱石结构模型
2、 U 型管界面电泳仪(见图6)
3、 离心分离机
4、 分析天平
5、 显微电泳分析系统
6、 粘土矿物试样
7、 BaCl2 溶液(1mol/l)、H2SO4 溶液(0.1mol/l)、NaOH 溶液(0.05mol/l)、酚酞溶液、离心试管、滴定管、锥形瓶、烧杯、移液管等。 1-整流稳压输出端 2.-直流电压表 3-铂电极 4-电泳管
1-整流稳压输出端 2.-直流电压表 3-铂电极 4-电泳管
5-辅助溶液(蒸馏水) 6-泥浆 7-活塞 图6 U 形管界面移动电泳仪装置图
三、实验原理
一般将高岭石、蒙脱石、伊利石、蛭石等归结为粘土类矿物,为层状结构的硅酸盐矿物。其矿物粒度极细,一般在 0.1~10 m范围内,具有较高的比表面积,如高岭石约为 20 m2/g,蒙脱石约为100 m2/g,因而表现出一系列的表面化学性质,如荷电性、离子的吸附与交换、电动电位以及诸如流变、触变、可塑等粘土-水系统的胶体性质。
(一)粘土的结构
粘土为典型的层状结构,它是硅氧四面体在二维平面内通过三个共用氧连接而延伸成一个硅氧四面体层,硅氧层中(图1),处于同一平面的三个氧离子都被硅离子共用而形成一个无限延伸的六节环层,这三个氧为桥氧。另一个顶角向上的氧(自由氧),与硅氧层以外的阳离子如Al3+、Mg2+、Fe2+、Fe3+等相连,形成Al-O、Mg-O 等八面体。自由氧在空间排列形成六边形网络,因此Al-O、Mg-O八面体也连成六边形网络。
高岭石(Al4[Si4O10](OH)8)的晶体结构属于三斜晶系C1 空间群,a0=0.5139nm,b0=0.8932nm,c0=0.7371nm, =91°36’, =104°48’,? =89°54’,Z=1,是 1:1 型层状结构,层之间的联系主要是氢键,结构单位层间不易进入水分子,可以交换的阳离子容量也小。
蒙脱石((MxnH2O)(Al2-xMgx)[Si4O10](OH)2)的晶体结构属于单斜晶系C2/m 空间群, a0≈0.523nm,b0≈0.906nm,c0 值可变,当结构单位层之间无水时c0≈0.960nm,如果结构单位层之间有水分子存在,则c0 值将随水分子的多少以及层间可交换的阳离子不同而不同,Z=2,为2:1 型层状结构


高岭石的晶体结构 蒙脱石的晶体结构
(二)粘土胶体的电动电位
电泳是胶体体系在直流电场的作用下胶体分散相在分散介质中作定向移动的电动现象。按照Gouy-chapman 提出并由Stein 发展的扩散双电层模型,胶体分散相的电泳现象是由于胶粒与液相接触时。在胶粒周围形成了连续扩散双电层,并在扩散双电层的滑动面上相互均匀液相介质具有一个电位即Zeta 电位(ζ-电位)。根据静电学原理,ζ-电位的数值与电泳速度有下列关系: u = ζD/4πη
式中:u 为电泳速度,D 为分散介质的介电常数;η为分散介质的粘度。因此,依据电泳速度的大小可以研究胶粒的电动电位和带电性质等情况。
测定胶体电泳速度的方法大致可分为两种,一为宏观的胶体界面移动法。另一为微观的颗粒移动法。相应地,电泳仪也分为两类:(1)宏观电泳仪——肉眼观察胶体界面的移动,以测定电泳速度。可以U 形管电泳仪为代表(U 型管电泳仪结构见图6)。(2)微观电泳仪42——在显微镜下观察胶粒的移动,以测定电泳速度。此类电泳仪可分载波片式与毛细管两种。测定方法应根据实际情况适当选用。本实验分别采用U 形管界面移动电泳仪这中方法进行。
(三)粘土的阳离子交换
分散在水溶液中的粘土胶粒带有电荷,不仅可以吸附反电荷离子,而且可以在不破坏粘土本身结构的情况下,同溶液中的其它离子进行交换。粘土进行离子交换的能力(即交换容量,以“mmol/-100g”表示),随着矿物的不同而异。

所以,测得离子交换容量,可以作为鉴定粘土矿物组成的辅助方法。
测定离子交换容量的方法很多,本实验采用钡粘土法。首先,以BaCl2 溶液冲洗粘土使粘土变成钡—土,再用已知浓度的稀H2SO4 置换出被粘土吸附的Ba2+,生成BaSO4 沉淀,最后用已知浓度的NaOH 溶液滴定过剩的稀硫酸,以NaOH 消耗量计算粘土的交换容量。
四、实验方法
1、粘土-水系统的双电层实验
U 型管法
① 称取一定量的粘土,研磨后配制成胶体溶液,使其浓度为 0.2wt%。
② 将配制好的胶体溶液加入 U形管,使液面超出两活塞,关闭活塞,倾出活塞上部的胶体溶液,用蒸馏水洗净活塞上的管子。
③ 在活塞以上的管子内注入辅助溶液至一定的高度,并使两端水平。插入铂电极,并测出两铂电极之间的距离。
④ 接好线路,确定正负极,将稳压器接上电源,一分钟后再逐步升高电压到 120V~150V。
⑤ 打开活塞,并同时接下秒表,待泥浆液面上升到一定位置时,记录时间和相应的移动距离以及界面移动的方向(向正极移动或向负极移动)。
⑥ 加入电解质 BaCl2到粘土胶体溶液中,经充分摇匀后,重复上述操作。
2、粘土的阳离子交换容量
(1)准确称取粘土矿物试样(0.5~0.3 克)三份(作两个平行试验,分别置于已知重量的干燥离心试管中,加10ml BaCl2 溶液充分搅动(约1 分钟),然后离心分离,并吸出上面澄清溶液,如此,重复操作两次,加蒸馏水洗涤二次。
(2)小心吸净上层清液,然后将离心管与湿土样在分析天平中称量,算出湿度校正项。
(3)在称量后之土样中准确地加人14ml(分两次加H2SO4 溶液充分搅拌,放置数分钟,然后离心,离心后将上层酸液合并入一洁净烧坏中,用移液管准确吸出10ml 置于锥形瓶中,滴加酚酞指示剂三滴,用NaOH 溶液滴定,滴定至摇动30 秒钟红色不退为止。记下NaOH 溶液的用量。
(4)吸取10ml 未经交换得H2SO4 溶液,用相同的NaOH 溶液滴定,记下所消耗的NaOH溶液毫升数。
五、实验数据记录及处理
1、指出高岭石,蒙脱石的结构类型以及正负离子的配位关系。

2、求电泳淌度:
u= ?
?
式中:S —界面移动距离,cm;
t —与S 对应的移动时间,sec,
H —平均电位剃度,即单位长度内的电压, H =  (L —铂电极之间的距离)。
(L —铂电极之间的距离)。

3、按下式计算粘土的交换容量,并判断属于哪类粘土。
W= *100
*100
式中:W —粘土的交换容量(mmol/100g);
C —NaOH 溶液浓度;
V1 —滴定10ml 未经交换的H2SO4 溶液所需的NaOH 溶液毫升数;
V2 —滴定10ml 交换后的H2SO4 溶液所需的NaOH 溶液毫升数;
L —湿度校正项(L=g1-g2)
g1 —湿土加离心管重(克)
g2 —干土加离心管重(克)
m —土样重量(克)

c=0.044625 mol/L
分析与思考
1、硅酸盐晶体一共有岛状、链状、组群状、层状、和架状五种结构;
高岭石(Al4[Si4O10](OH)8)的晶体结构属于三斜晶系C1 空间群,a0=0.5139nm,b0=0.8932nm,c0=0.7371nm, =91°36’, =104°48’,? =89°54’,Z=1,是 1:1 型层状结构,层之间的联系主要是氢键,结构单位层间不易进入水分子,可以交换的阳离子容量也小;而蒙脱石((MxnH2O)(Al2-xMgx)[Si4O10](OH)2)的晶体结构属于单斜晶系C2/m 空间群, a0≈0.523nm,b0≈0.906nm,c0 值可变,当结构单位层之间无水时c0≈0.960nm,如果结构单位层之间有水分子存在,则c0 值将随水分子的多少以及层间可交换的阳离子不同而不同,Z=2,为2:1 型层状结构,在一定的条件下这些水化阳离子容易被交换出来,因此,c 轴可以膨胀以及阳离子交换容量大是蒙脱石的结构特征。
不同:高岭石可以交换的阳离子容量小,蒙脱石阳离子容易被交换出来。
2、 实验中正极一侧颜色加深,表明粘土胶体带负点。原因有:1,黏土晶格内离子的同晶置换所产生的,在黏土结构中,硅氧四面体层中的 可能被
可能被 置换等,154产生了过剩的负电荷。2,断键,沿平行于C轴方向,使层状结构断裂,暴露出边面而带电。当黏土在边面上断裂时,其周期性排列被中断,断面上质点的电价不能饱和从而带电。3,黏土表面通常吸附一些腐烂的有机质,由于有机质中的羧基和羟基的H解离而可能使黏土表面带负电。
置换等,154产生了过剩的负电荷。2,断键,沿平行于C轴方向,使层状结构断裂,暴露出边面而带电。当黏土在边面上断裂时,其周期性排列被中断,断面上质点的电价不能饱和从而带电。3,黏土表面通常吸附一些腐烂的有机质,由于有机质中的羧基和羟基的H解离而可能使黏土表面带负电。
3 、由双电层模型推知,电介质对ζ-电位有明显影响,当电介质浓度增大时,扩散双电层受到压缩,于是ζ-电位也随之下降。如黏土胶体中加入阳离子,ζ-电位减小。加入阴离子,ζ-电位增大。
4、根据静电学原理,ζ-电位的数值与电泳速度有下列关系: u = 
式中:影响u 电泳速度的因素有:D 为分散介质的介电常数;η为分散介质的粘度,以及ζ-电位。而在本实验中影响电泳速度u的因素有电动电位。影响ζ-电位的因素有双电层的厚度,即加入电解质的浓度,所带电荷数。
5、由于黏土颗粒表面带有负电荷,因此,他就会吸附介质中的阳离子以平衡其过剩的电价。当溶液存在其他浓度大或者价数高的阳离子时,这些被吸附的离子就可能被交换出来。哪些阳离子被交换主要取决于黏土与吸附离子之间作用力的大小,作用力大的,吸附牢固,从而能够吸附不牢固即作用力小的离子交换。这种作用力取决与1,黏土吸附阳离子的电荷数。2,离子水化半价。
6、在用碱滴定交换过的硫酸时,硫酸的试管里面有没有倒干净的水,所以用湿度校正可以减小误差。
7、受限制,不能冲洗次数超过三次,超过三次以后,离心次数变多,容易把已经交换过的Ba离子洗去,从而发生胶溶现象,从而得不到Ba-土。
8、先生成Ba-土然后再用硫酸进行交换,硫酸根会与钡离子生成沉淀,H离子就会容易与黏土形成H-土。使交换效果更好。
感想与体会
这次实验一共做了将近六个小时,是我上大学以来做过最长的一次实验,实验分为两个内容,我做的第一个实验,测电泳淌度时,一开始失败了好几次,这个实验的关键是胶体的配置,要把土样充分研磨,把胶体配置好,后面的才可以进行下去,否则难以进行;第二个实验是判断黏土类型,这个实验要有足够的耐心和充分的细心,中间有着很多的步骤,如果不小心做错一步,把试管弄破,则前功尽弃,必须重头再来。滴定的时候也要慢慢来,切不可急躁。本次实验让我学会很多,我熟悉了仪器的使用,掌握了黏土的一些性质,提升了自己的心态和心境。在以后的学习或者工作中我还会继续努力,争取让自己更加提升一个档次。
第二篇:电导的测定及应用实验报告
实验名称 电导的测定及其应用
一、实验目的
1.测量KCl水溶液的电导率,求算它的无限稀释摩尔电导率;
2.用电导法测量醋酸在水溶液中的解离平衡常数;
3.掌握恒温水槽及电导率仪的使用方法。
二、实验原理
 1、电导G:对于电解质溶液,常用电导表示其导电能力的大小。电导G是电阻R的倒数,即 G=1/R。电导的单位是西门子,常用S表示。1S=1Ω-1
1、电导G:对于电解质溶液,常用电导表示其导电能力的大小。电导G是电阻R的倒数,即 G=1/R。电导的单位是西门子,常用S表示。1S=1Ω-1
2、电导率或比电导:κ=Gl/A (2.5.1)
其意义是电极面积为及1m2、电极间距为lm的立方体导体的电导,单位为S·m-1。
对电解质溶液而言,令l/A = Kcell,Kcell称为电导池常数。
所以 κ=G l/A =G Kcell
3、摩尔电导率:Λm=κ/ C (2.5.2)
强电解质稀溶液的摩尔电导率Λm与浓度有如下关系:
Λm= Λ∞m- A (2.5.3)
(2.5.3)
Λ∞m为无限稀释摩尔电导率。可见,以Λm对 作图得一直线,其截距即为Λ∞m。
作图得一直线,其截距即为Λ∞m。
弱电解质溶液中。在无限稀释的溶液中可认为弱电解质已全部电离。此时溶液的摩尔电导率为 Λ∞m =V+ Λm ,+ + V- Λm ,- (2.5.4)
根据电离学说,可以认为,弱电解质的电离度α等于在浓度时的摩尔电导Λ与溶液在无限稀释时的电导Λ∞m之比,即:α=Λm/Λ∞m (2.5.5)
4、弱电解质电离平衡常数:弱电解质AB型的电离平衡常数:Kθ=(Cα2)/Cθ(1-α) (2.5.6)
所以,通过实验测得α即可得Kθ值。
把(2.5.4)代入(2.5.6)式可得
Kθ=(CΛ∞m2)/ Λ∞mCθ(Λ∞m-Λm) (2.5.7)
或 CΛm=(Λ∞m2) KθCθ1/Λm -Λ∞mKθCθ
以CΛm对1/Λm作图,其直线的斜率为(Λ∞m2) KθCθ,如知道Λ∞m值,就可算出Kθ。
三、实验仪器、试剂
仪器:梅特勒326电导率仪1台;电导电极一只,量杯(50mL)2个;移液管(25mL)3只;
洗瓶一只;洗耳球一只。
药品:10.00(mol/m3)KCl溶液;0.093mol/dm3)HAc溶液;电导水。
四、实验步骤
1.打开电导率仪开关,预热5min。
2.KCl溶液电导率的测定:
(1)用移液管准确移入10.00(mol/m3)KCl溶液25.00mL,至于洁净、干燥的量杯中;测定
其电导率3次,取平均值。
(2)再用移液管准确移入25.00mL电导水,置于上述量杯中;搅拌均匀后,测定其电导率3
次,取平均值。
(3)再用移液管准确移出25.00mL上述量杯中的溶液,弃去;再用移液管准确移入25.00mL
电导水,置于上述量杯中;搅拌均匀后,测定其电导率3次,取平均值。
(4)重复(3)的步骤。
(5)重复(3)的步骤。
(6)倾去电导池中的KCl溶液,用电导水洗净量杯和电极;量杯放回烘箱;电极用滤纸吸干。
3.HAc溶液和电导水的电导率的测定:
(1)用移液管准确移入0.093(mol/dm3)KCl溶液25.00mL,至于洁净、干燥的量杯中;测定
其电导率3次,取平均值。
(2)再用移液管准确移入25.00mL已恒温的电导水,置于上述量杯中;搅拌均匀后,测定其
电导率3次,取平均值。
(3)再用移液管准确移出25.00mL上述量杯中的溶液,弃去;再用移液管准确移入25.00mL
电导水,置于上述量杯中;搅拌均匀后,测定其电导率3次,取平均值。
(4)再用移液管准确移出25.00mL上述量杯中的溶液,弃去;再用移液管准确移入25.00mL
电导水,置于上述量杯中;搅拌均匀后,测定其电导率3次,取平均值。
(5)倾去电导池中的HAc溶液,用电导水洗净量杯和电极;然后注入电导水,测定其电导率
3次,取平均值。
(6)倾去电导池中的电导水,用电导水洗净量杯和电极;量杯放回烘箱;电极用滤纸吸干。
五、数据记录与处理
1.数据记录
大气压:101.10KPa 室温:25.2℃ 实验温度:25.2℃
已知数据:25℃下10.00(mol/m3)KCl溶液电导率=0.1413S·m-1;25℃时无限稀释的HAc水溶液的摩尔电导率=3.907×10-2(S·m2·mol-1)。
(1)测定KCl溶液的电导率:
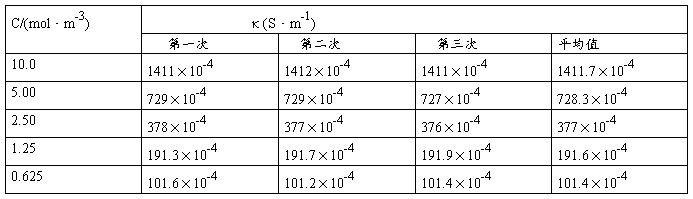
(2)测定HAc水溶液的电导率:
电导水的电导率κ=(H2O)/(S·m-1)=8.90×10-4

2.数据处理
(1)KCl溶液的各组数据
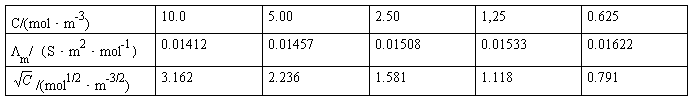
以KCl溶液的Λm对 作图得一直线,其截距即为KCl的Λ∞m。
作图得一直线,其截距即为KCl的Λ∞m。
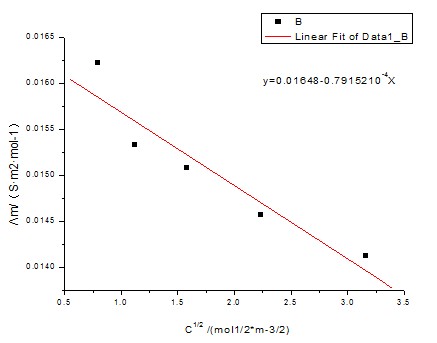
由图可知斜率为-7.98152×10-4,截距为0.01648
由Λm= Λ∞m- A 得出Λ∞m= 0.01648S·m2·mol-1
得出Λ∞m= 0.01648S·m2·mol-1
(2)HAc溶液的各组数据
HAc原始浓度:0.093mol/L
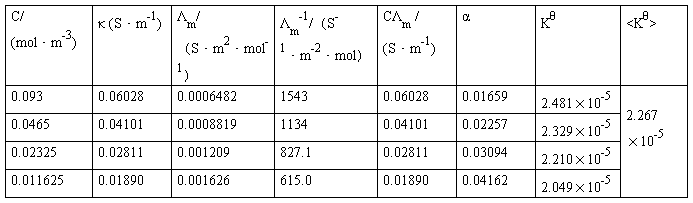
κ = κ′-κH2O
以CΛm对1/Λm作图,其直线的斜率为(Λ∞m2) KθCθ,如知道Λ∞m值,就可算出Kθ,并与上述结果进行比较。
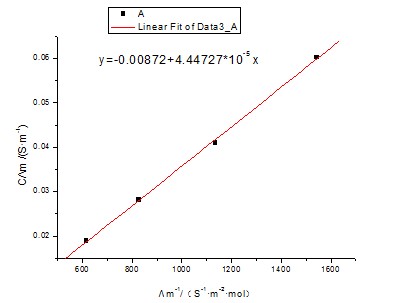
由图可知此直线的斜率为4.44727×10-5,所以(Λ∞m)2 KθCθ=4.44727×10-5,
又因为Λ∞m=3.907×10-2(S·m2·mol-1),Cθ=1mol/L;
所以Kθ=4.1963×10-5/((3.907×10-2)2×1×1000)=2.749×10-5
实验计算所得结果相对图得到的结果的相对误差=(2.749×10-5-2.267×10-5)×100%=17.5%
六、结果与讨论
误差分析:
1、 移液管使用时存在误差,使得溶液浓度非理想浓度;
2、 更换待测液时,电导率仪的电极与未洗干净或未擦干,导致误差;
3、 电导水的电导率的测定误差;
4、 移液管操作时没有进行搅拌。
有关已知数据:25℃下0.01000mol/L KCl溶液电导率К =0.1413 S·m-1 无限稀的HAc水溶液的摩尔电导率(25℃)∧∞m=3.907×10-2S·m2·mol-1
