
生物化学实验报告
姓 名: 王晨阳
学 号: 3130101027
专业年级: 20##级临床医学(卓越创新班)
组 别: 第一实验室
生物化学与分子生物学实验教学中心
第二篇:生物化学实验报告 20xx
孝感学院生命科学技术学院实验报告



 专业: 学号: 姓名: 分数:
专业: 学号: 姓名: 分数:
 实验一还原糖和总糖的测定——3,5-二硝基水杨酸比色法
实验一还原糖和总糖的测定——3,5-二硝基水杨酸比色法
一、目的与要求
掌握还原糖和总糖测定的基本原理,学习比色法测定还原糖的操作方法和分光光度计的使用。
二、实验原理
还原糖的测定是糖定量测定的基本方法。还原糖是指含有自由醛基或酮基的糖类,单糖都是还原糖,双糖和多糖不一定是还原糖,如乳糖和麦芽糖是还原糖,蔗糖和淀粉是非还原糖。利用糖的溶解度不同,可将植物样品中的单糖、双糖和多糖分别提取出来,对没有还原性的双糖和多糖,可用酸水解法使其降解成有还原性的单糖进行测定,再分别求出样品中还原糖和总糖的含量(还原糖以葡萄糖含量计)。
还原糖在碱性条件下加热被氧化成糖酸及其它产物,3,5-二硝基水杨酸则被还原为棕红色的3-氨基-5-硝基水杨酸。在一定范围内,还原糖的量与棕红色物质颜色的深浅成正比关系,利用分光光度计,在540 nm波长下测定光密度值,查对标准曲线并计算,便可求出样品中还原糖和总糖的含量。由于多糖水解为单糖时,每断裂一个糖苷键需加入一分子水,所以在计算多糖含量时应乘以0.9。
三、实验材料、主要仪器和试剂
1.实验材料 小麦面粉(1000 g)
2.主要仪器
(1)具塞玻璃刻度试管:20 mL×11 (2) 滤纸 (3)烧杯:100 mL×2
(4)三角瓶:100 mL×1 (5)容量瓶:100 mL×3 (6)刻度吸管:1mL×1;2 mL×2;10 mL×1 (7)恒温水浴锅 (8)煤气炉 (9)漏斗 (10)天平 (11)分光光度计
3. 试剂
(1)1mg/mL葡萄糖标准液
准确称取80 ℃烘至恒重的分析纯葡萄糖100 mg,置于小烧杯中,加少量蒸馏水溶解后,转移到100 mL容量瓶中,用蒸馏水定容至100 mL,混匀,4℃冰箱中保存备用。
(2)3,5-二硝基水杨酸(DNS)试剂
3,5-二硝基水杨酸(DNS)试剂:称取6.5 g DNS溶于少量热蒸馏水中,溶解后移入1000 mL容量瓶中,加入2 mol/L氢氧化钠溶液325 mL,再加入45 g丙三醇,摇匀,冷却后定容至1000 mL。
(3)碘-碘化钾溶液:称取5 g碘和10 g碘化钾,溶于100 mL蒸馏水中。
(4)酚酞指示剂:称取0.1 g酚酞,溶于250 mL 70%乙醇中。
(5)6 M HCl和6 M NaOH各100 mL。(分别取59.19 mL 37 %浓盐酸和24克NaOH定容至100mL)
四、操作步骤
1. 制作葡萄糖标准曲线
 批阅教师: 年 月 日
批阅教师: 年 月 日
取7支20 mL具塞刻度试管编号,按表1分别加入浓度为1 mg/mL的葡萄糖标准液、蒸馏水和3,5-二硝基水杨酸(DNS)试剂,配成不同葡萄糖含量的反应液。
表1 葡萄糖标准曲线制作
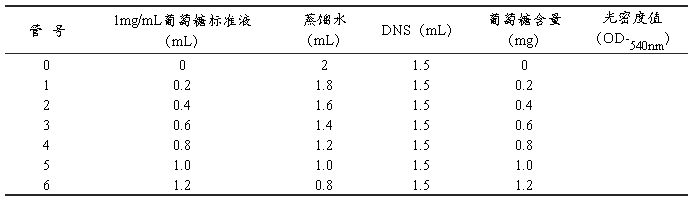
将各管摇匀,在沸水浴中准确加热5 min,取出,用冷水迅速冷却至室温,用蒸馏水定容至20 mL,加塞后颠倒混匀。调分光光度计波长至540 nm,用0号管调零点,等后面7~10号管准备好后,测出1~6号管的光密度值。以光密度值为纵坐标,葡萄糖含量(mg)为横坐标,在坐标纸上绘出标准曲线。
葡萄糖标准曲线
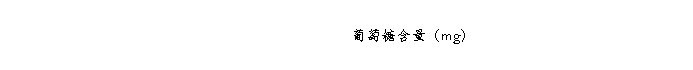
2. 样品中还原糖和总糖的测定
(1)还原糖的提取
准确称取3.00 g食用面粉,放入100 mL烧杯中,先用少量蒸馏水调成糊状,然后加入50 mL蒸馏水,搅匀,置于50 ℃恒温水浴中保温20 min,不时搅拌,使还原糖浸出。过滤,将滤液全部收集在100 mL的容量瓶中,用蒸馏水定容至刻度,即为还原糖提取液。
(2)总糖的水解和提取
准确称取1.00 g食用面粉,放入100 mL三角瓶中,加15 mL蒸馏水及10 mL 6 M HCl,置沸水浴中加热水解30 min, 取出1~2滴置于白瓷板上,加1滴I-KI溶液检查水解是否完全。如已水解完全,则不呈现蓝色。水解毕。冷却至室温后加入1滴酚酞指示剂,以6 mol/L NaOH溶液中和至溶液呈微红色,并定容到100 mL,过滤取滤液10 mL于100 mL容量瓶中,定容至刻度,混匀,即为稀释1000倍的总糖水解液,用于总糖测定。
(3)显色和比色
取4支20 mL具塞刻度试管,编号,按表2所示分别加入待测液和显色剂,将各管摇匀,在沸水浴中准确加热5 min,取出,冷水迅速冷却至室温,用蒸馏水定容至20 mL,加塞后颠倒混匀,在分光光度计上进行比色。调波长540 nm,用0号管调零点,测出7~10号管的光密度值。
表2 样品还原糖测定

五、结果与计算
计算出7、8号管光密度值的平均值和9、10管光密度值的平均值,在标准曲线上分别查出相应的葡萄糖毫克数,按下式计算出样品中还原糖和总糖的百分含量(以葡萄糖计)。
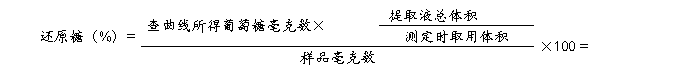
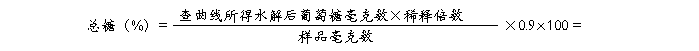
六、注意
1. 标准曲线制作与样品测定应同时进行显色,并使用同一空白调零点和比色。
2. 面粉中还原糖含量较少,计算总糖时可将其合并入多糖一起考虑。
七、思考题
1.在样品的总糖提取时,为什么要用浓HCl处理?而在其测定前,又为何要用NaOH中和?
2.标准葡萄糖浓度梯度和样品含糖量的测定为什么应该同步进行?比色时设0号管有什么意义?
3. 绘制标准曲线的目的是什么?
孝感学院生命科学技术学院实验报告



 专业: 学号: 姓名: 分数:
专业: 学号: 姓名: 分数:
 实验二 油脂酸价的测定
实验二 油脂酸价的测定
一、目的与要求
初步掌握测定油脂酸价的原理和方法;了解测定油脂酸价的意义。
二、实验原理
油脂在空气中暴露过久,部分油脂会被水解产生游离脂肪酸和醛等物质,并且这些物质具有刺激性气味,使油脂产生酸价。酸败的程度使以水解产生的游离脂肪酸的多少为指标的,常以酸价或者是酸值来表示。同一油脂若酸价高,则说明水解产生的游离脂肪酸就多。
酸价是指中和1g油脂中游离脂肪酸所需的氢氧化钾的毫克数。酸价越高,油脂的质量也越差。
三、主要仪器、实验材料和试剂
1. 锥形瓶(250 mL)3个; 2. 量筒(50 mL)1支;3. 碱式滴定管1支;4. 花生油、菜油、芝麻油等;5. 乙醇-乙醚混合液(1:1,V/V);6. 0.1 % KOH(1克KOH溶于1000 mL纯水中)。
四、操作步骤
1. 准确称取1~2 g油脂于250 mL锥形瓶中。
2. 在瓶内加入乙醇-乙醚混合液50 mL,充分振荡,使油脂样品完全溶解成透明溶液。
待油样完全溶解后,加入1%酚酞指示剂3~5滴,立即用0.1% KOH标准溶液滴定至溶液成微红色(放置30 S内不褪色)为终点,并记录用去的KOH的体积,并按下式进行计算。
酸价=2(V2-V1)/W
V2 :滴定油样时耗用氢氧化钾溶液的毫升数
V1 :滴定空白对照耗用氢氧化钾溶液的毫升数
W:油样重(g)
注:滴定过程中如出现混浊或分层,表明由碱液带进水过多,乙醇量不足以使乙醚与碱溶液互溶。一旦出现此现象,可补加乙醇,促使均一相体系的形成。
五、实验结果

六、思考题
请对你的实验结果进行分析。
 批阅教师: 年 月 日
批阅教师: 年 月 日
孝感学院生命科学技术学院实验报告



 专业: 学号: 姓名: 分数:
专业: 学号: 姓名: 分数:
 实验三蛋白质的提取及浓度测定(紫外吸收法)
实验三蛋白质的提取及浓度测定(紫外吸收法)
一、目的与要求
掌握蛋白质的提取方法;学习紫外分光光度法测定蛋白质含量的原理;熟练掌握紫外分光光度计的使用方法。
二、实验原理
大部分蛋白质都可溶于水、稀盐、稀酸或碱溶液,少数与脂类结合的蛋白质则溶于乙醇、丙酮、丁醇等有机溶剂中,因些,可采用不同溶剂提取分离和纯化蛋白质及酶。
由于蛋白质中存在着含有共轭双键的酪氨酸和色氨酸,因此蛋白质具有吸收紫外光的性质,最大吸收峰在280 nm波长处。在此波长范围内,蛋白质溶液的光密度OD280nm与其浓度呈正比关系,可作定量测定。
三、实验材料、主要仪器和试剂
1. 试验材料:萌发3天的小麦种子
2. 主要仪器
(1)紫外分光光度计,(2)离心机(3)试管与试管架,(4)刻度吸量管 (5)研钵 (6)100 mL容量瓶
3.试剂:标准牛血清蛋白溶液:准确称取经凯氏定氮法校正的结晶牛血清蛋白,配制成浓度为1mg/ mL(0.5克标准牛血清蛋白纯水定容至500 mL)的溶液。
四、操作步骤
1.蛋白质(淀粉酶)的提取
称取1g萌发3天的小麦种子(芽长约1cm),置于研钵中,加入少量石英砂和2 mL蒸馏水,研磨匀浆。将匀浆倒入离心管中,用6 mL蒸馏水分次将残渣洗入离心管。提取液在室温下放置提取15~20 min,每隔数分钟搅动1次,使其充分提取。然后在3,000 r/min转速下离心10 min,将上清液倒入100 mL容量瓶中,加蒸馏水定容至刻度,摇匀,即为蛋白质原液,用于蛋白质浓度的测定。
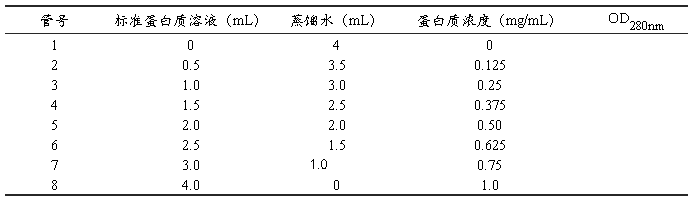
2. 标准曲线制作
按表1分别向每支试管内加入各种试剂,混匀。以光程为1 cm的石英比色杯,在280 nm波长处测定各管溶液的光密度值OD280nm。以蛋白质浓度为横坐标,光密度值为纵坐标,绘出标准曲线。
 批阅教师: 年 月 日
批阅教师: 年 月 日
表1 蛋白质标准曲线制作

3.样品测定
取提取的蛋白质溶液,按上述方法测定280 nm的光密度,并从标准工作曲线上查出提取蛋白质溶液的浓度。若提取蛋白质溶液的浓度大于2.0,超出测量范围,则稀释后再测,计算蛋白质浓度时乘以稀释倍数。
蛋白质浓度=
五、思考题
1. 为何要在280 nm波长下测定蛋白质浓度?在其它波长下测定可以吗?
2. 如果考虑核酸的存在,蛋白质浓度的实际的值比测量值是大还是小?为什么?
孝感学院生命科学技术学院实验报告



 专业: 学号: 姓名: 分数:
专业: 学号: 姓名: 分数:
 实验四淀粉酶活力的测定
实验四淀粉酶活力的测定
一、目的与要求
学习和掌握测定淀粉酶(包括α-淀粉酶和β-淀粉酶)活力的原理和方法。
二、实验原理
淀粉是植物最主要的贮藏多糖,也是人和动物的重要食物和发酵工业的基本原料。淀粉经淀粉酶作用后生成葡萄糖、麦芽糖等小分子物质而被机体利用。淀粉酶主要包括α-淀粉酶和β-淀粉酶两种。α-淀粉酶可随机地作用于淀粉中的α-1,4-糖苷键,生成葡萄糖、麦芽糖、麦芽三糖、糊精等还原糖,同时使淀粉的粘度降低,因此又称为液化酶。β-淀粉酶可从淀粉的非还原性末端进行水解,每次水解下一分子麦芽糖,又被称为糖化酶。淀粉酶催化产生的这些还原糖能使3,5-二硝基水杨酸还原,生成棕红色的3-氨基-5-硝基水杨酸。
淀粉酶活力的大小与产生的还原糖的量成正比。用标准浓度的麦芽糖溶液制作标准曲线,用比色法测定淀粉酶作用于淀粉后生成的还原糖的量,以单位重量样品在一定时间内生成的麦芽糖的量表示酶活力。
淀粉酶存在于几乎所有植物中,特别是萌发后的禾谷类种子,淀粉酶活力最强,其中主要是α-淀粉酶和β-淀粉酶。两种淀粉酶特性不同,α-淀粉酶不耐酸,在pH3.6以下迅速钝化。β-淀粉酶不耐热,在70 ℃15min钝化。根据它们的这种特性,在测定活力时钝化其中之一,就可测出另一种淀粉酶的活力。本实验采用加热的方法钝化β-淀粉酶,测出α-淀粉酶的活力。在非钝化条件下测定淀粉酶总活力(α-淀粉酶活力+β-淀粉酶活力),再减去α-淀粉酶的活力,就可求出β-淀粉酶的活力。
三、实验材料、主要仪器和试剂
1.实验材料
萌发的小麦种子(芽长约1cm)
2.仪器
(1)离心机(2)离心管(3)研钵(4)电炉(5)容量瓶:50mL×1, 100mL×1
(6)恒温水浴(7)20mL具塞刻度试管×13(8)试管架(9)刻度吸管:2mL×3, 1mL×2, 10mL×1 (10)分光光度计
3.试剂(均为分析纯)
(1)标准麦芽糖溶液(1mg/mL):精确称取100mg麦芽糖,用蒸馏水溶解并定容至100mL。
(2)3,5-二硝基水杨酸试剂:精确称取3,5-二硝基水杨酸1g,溶于20 mL 2 mol/L NaOH溶液中,加入50 mL蒸馏水,再加入30 g酒石酸钾钠,待溶解后用蒸馏水定容至100 mL。盖紧瓶塞,勿使CO2进入。若溶液混浊可过滤后使用。
(3)0.1mol/L pH5.6的柠檬酸缓冲液
A液:(0.1mol/L 柠檬酸):称取C6H8O7·H2O 21.01g,用蒸馏水溶解并定容至1L。
B液:(0.1mol/L柠檬酸钠):称取Na3C6H5O7·2H2O 29.41g,用蒸馏水溶解并定容至1L。
取A液55mL与B液145mL混匀,既为0.1mol/LpH5.6的柠檬酸缓冲液。
(4)1%淀粉溶液:称取1g淀粉溶于100mL 0.1mol/L pH5.6的柠檬酸缓冲液中。
 批阅教师: 年 月 日
批阅教师: 年 月 日
四、操作步骤
1.麦芽糖标准曲线的制作
取7支干净的具塞刻度试管,编号,按表1加入试剂:
表1 麦芽糖标准曲线制作
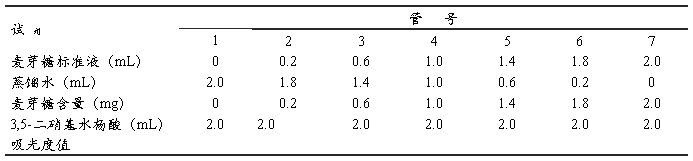
摇匀,置沸水浴中煮沸5 min。取出后流水冷却,加蒸馏水定容至20 mL。以1号管作为空白调零点,在540 nm波长下比色测定光密度。以麦芽糖含量为横坐标,光密度为纵坐标,绘制标准曲线。

2.淀粉酶液的制备
称取1g萌发3天的小麦种子(芽长约1 cm),置于研钵中,加入少量石英砂和2 mL蒸馏水,研磨匀浆。将匀浆倒入离心管中,用6 mL蒸馏水分次将残渣洗入离心管。提取液在室温下放置提取15~20 min,每隔数分钟搅动1次,使其充分提取。然后在3 000r/min转速下离心10min,将上清液倒入100 mL容量瓶中,加蒸馏水定容至刻度,摇匀,即为淀粉酶原液,用于α-淀粉酶活力测定。
吸取上述淀粉酶原液10 mL,放入50 mL容量瓶中,用蒸馏水定容至刻度,摇匀,即为淀粉酶稀释液,用于淀粉酶总活力的测定。
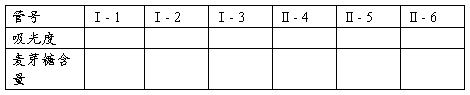
3.酶活力的测定:取6支干净的试管,编号,按表2进行操作。
表2 酶活力测定取样表

将各试管摇匀,置沸水浴中煮沸5 min。取出后流水冷却,加蒸馏水定容至20 mL。以1号管(做标准曲线时用过的)作为空白调零点,在540 nm波长下比色测定光密度,记录测定结果。
五、结果计算
计算Ⅰ- 2、Ⅰ- 3光密度平均值与Ⅰ- 1光密度之差,在标准曲线上查出相应的麦芽糖含量(mg),按下列公式计算α- 淀粉酶的活力。

=
计算Ⅱ- 5、Ⅱ- 6光密度平均值与Ⅱ- 4光密度之差,在标准曲线上查出相应的麦芽糖含量(mg),按下式计算(α+β)淀粉酶总活力(单位同上)。

(α+β)淀粉酶总活力
=
β-淀粉酶活力=(α+β)淀粉酶总活力-α-淀粉酶活力=
六、思考题
1.为什么要将Ⅰ- 1、Ⅰ- 2、Ⅰ- 3号试管中的淀粉酶原液置70 ℃水浴中保温15min?
2.为什么要将各试管中的淀粉酶原液和1%淀粉溶液分别置于40 ℃水浴中保温?
孝感学院生命科学技术学院实验报告



 专业: 学号: 姓名: 分数:
专业: 学号: 姓名: 分数:
 实验五 醋酸纤维薄膜电泳法分离血清蛋白质
实验五 醋酸纤维薄膜电泳法分离血清蛋白质
一、目的
学习醋酸纤维薄膜电泳的操作,了解电泳技术的一般原理。
二、原理
带电质点在电场中移动的现象称为电泳。电泳有很多类型,如,纸电泳、醋酸纤维薄膜电泳、纤维素或淀粉粉末电泳、淀粉凝胶电泳、琼脂糖凝胶电泳、聚丙烯酰胺凝胶电泳等。
任何一种物质的质点,由于其本身在溶液中的解离或由于其表面对其他带电质点的吸附,会在电场中向一定的电极移动。例如,氨基酸、蛋白质、酶、激素、核酸及其衍生物等物质都具有许多可解离的酸性和碱性基团,它们在溶液中会解离而带电。
不同的质点在同一电场中泳动速度不同,据此可将不同带电物质分开。
醋酸纤维薄膜电泳是用醋酸纤维薄膜作为支持物的电泳方法。
醋酸纤维薄膜由二乙酸纤维素制成,它具有均一的泡沫样的结构,厚度仅120微米,有强渗透性,对分子移动无阻力,作为区带电泳的支持物进行蛋白电泳有简便、快速、样品用量少、应用范围广、分离清晰、没有吸附现象等优点。目前已广泛用于血清蛋白、脂蛋白、血红蛋白和同功酶的分离及用在免疫电泳中。
三、器材及试剂
1.器材:

2.试剂:
①巴比妥缓冲液(PH8.6):巴比妥2.76克,巴比妥纳15.45克,加水至1000毫升。
②染色液:氨基黑10B 0.25克,甲醇50毫升,冰醋酸10毫升,水40毫升(可重复用)。
③漂洗液:含甲醇或乙醇45毫升,冰醋酸5毫升,水50毫升。
④透明液:含无水乙醇7份,冰醋酸3份。
四、操作步骤
1.浸泡:用镊子取醋酸纤维薄膜1张(识别出光泽面与无光泽面,并在无光泽面角上用铅笔做上记号)放在缓冲液中浸泡20分钟。
2.点样:把膜条从缓冲液中取出,夹在两层粗滤纸内吸干多余的液体,然后平铺在玻璃板上(无光泽面朝上),将点样器先在白磁板上的血清中沾一下,再在膜条一端2—3厘米处轻轻地水平落下并随即提起,这样即在膜条上点上了细条状的血清样品。
 批阅教师: 年 月 日
批阅教师: 年 月 日
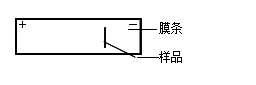
 3.电泳:在电泳槽内加入缓冲液,使两个电极槽内的液面等高,将膜条平悬于电泳槽支架的滤纸桥上。(先剪裁尺寸合适的滤纸条,取双层滤纸条附着在电泳槽的支架上,使它的一端与支架的前沿对齐,而另一端浸入电极槽的缓冲液内。用缓冲液将滤纸全部润湿并驱除气泡,使滤纸紧贴在支架上,即为滤纸桥。它是联系醋酸纤维薄膜和两极缓冲液之间的“桥梁”。)膜条上点样的一端靠近负极。盖严电泳室。通电。调节电压至160V,电流强度0.4—0.7毫安/厘米膜宽,电泳时间约为60分钟。
3.电泳:在电泳槽内加入缓冲液,使两个电极槽内的液面等高,将膜条平悬于电泳槽支架的滤纸桥上。(先剪裁尺寸合适的滤纸条,取双层滤纸条附着在电泳槽的支架上,使它的一端与支架的前沿对齐,而另一端浸入电极槽的缓冲液内。用缓冲液将滤纸全部润湿并驱除气泡,使滤纸紧贴在支架上,即为滤纸桥。它是联系醋酸纤维薄膜和两极缓冲液之间的“桥梁”。)膜条上点样的一端靠近负极。盖严电泳室。通电。调节电压至160V,电流强度0.4—0.7毫安/厘米膜宽,电泳时间约为60分钟。
4.染色:电泳完毕后将膜条取下并放在染色液中浸泡10分钟。
5.漂洗:将膜条从染色液中取出,置漂洗液中漂洗数次至无蛋白区底色脱净为止,可得色带 清晰的电泳图谱。
清晰的电泳图谱。
6.定量(了解):有两种方法
(1)将上述漂净的薄膜用滤纸吸干,剪下各种蛋白质色带,分别浸于4.0ml 0.4mol·L-1NaOH溶液中(37℃)5—10分钟,色泽浸出后,比色(590nm)。设各部分的光密度分别为:OD白、ODα1、ODα2、ODβ、ODγ。则光密度总和(OD总)为:
OD总=OD白+ODα1+ODα2+ODβ+ODγ
白蛋白%= ×100 α1球蛋白%=
×100 α1球蛋白%=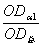 ×100 α2球蛋白%=
×100 α2球蛋白%= ×100
×100
β球蛋白%=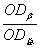 ×100 γ球蛋白%=
×100 γ球蛋白%= ×100
×100
(2)把薄膜放在滤纸上用电吹风吹干,待薄膜完全干燥后,浸入透明液中约5—10分钟,取出,平贴于干净玻璃片上,自然干燥或用电吹风冷风吹干,即得背景透明的电泳图谱,可用刀片刮开并从玻板上取下图谱。能用光密度计测定各蛋白斑点。此图谱可长期保存。
五、思考题
1.点样端为何放在负极?
2.实验中应注意哪些事项?
孝感学院生命科学技术学院实验报告



 专业: 学号: 姓名: 分数:
专业: 学号: 姓名: 分数:
 实验六 氨基酸的分离鉴定――纸层析法
实验六 氨基酸的分离鉴定――纸层析法
一、实验目的
通过氨基酸的分离,学习纸层析法的基本原理及操作方法。
二、实验原理
纸层析法是用滤纸作为惰性支持物的分配层析法。
层析溶剂由有机溶剂和水组成。
物质被分离后在纸层析图谱上的位置是用Rf值(比移)来表示的:
Rf = 原点到层析中心的距离 / 原点到容剂前沿的距离
在一定的条件下某种物质的Rf值是常数。Rf值的大小与物质的结构、性质、溶剂系统、层析滤纸的质量和层析温度等因素有关。本实验利用纸层析法分离氨基酸。
三、器材
1、层析缸 2、毛细管 3、喷雾器 4、培养皿 5、小烧杯 6、长颈漏斗7、层析滤纸(新华一号) 8、电吹风
四、试剂
1、扩展剂 正丁醇:88%甲酸:水=15:2.5:2.5(体积比),平衡溶剂与扩展剂相同。每组配制40 mL。
2、氨基酸溶液 0.5%的赖氨酸、脯氨酸、缬氨酸、亮氨酸溶液及它们的混合液(各组份浓度均为0.5%)。
3、显色剂 50~l00 mL 0.1% 水合茚三酮正丁醇溶液。
五、操作
1.将盛有扩展剂10 mL的小烧杯和培养皿置于密闭的层析缸中。
2.戴手套取层析滤纸(长22 cm、宽14 cm)一张。在纸的一端距边缘2~3 cm处用铅笔划一条直
线,在此直线上每间隔2.5 cm作一记号。
3.点样:用毛细管将各氨基酸样品分别点在这5个位置上,干后重复点一次,直径最大不超过3 mm。缝成筒状,两边不能接触。点样面朝外,点样端朝下,盖上层析缸盖,平衡约10~30分钟。
4.展层 用长颈漏斗,扩展剂的液面需低于点样线1cm。溶剂扩展至滤纸上沿约5厘米时,取出滤纸,用铅笔标出溶剂前沿界线,干燥。
5.显色 用0.1%茚三酮丙酮溶液均匀浸透,用热风吹干。脯氨酸、羟脯氨酸产生黄色物质外,所有α-氨基酸及一切蛋白质都能和茚三酮产生兰紫色物质。
 批阅教师: 年 月 日
批阅教师: 年 月 日
6.计算各种氨基酸的Rf值。
六、实验结果
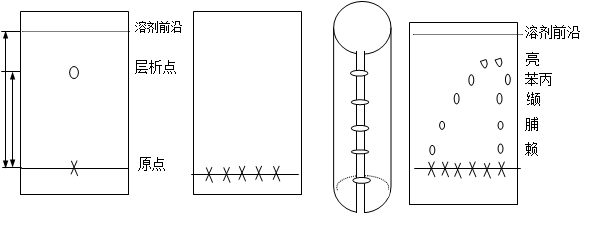
各种氨基酸的Rf值:

七、思考题
1. 实验过程中切勿用手直接接触滤纸和显色剂,为什么?
2. 点样过程中必须在第一滴样品干后再点第二滴,为什么?
孝感学院生命科学技术学院实验报告



 专业: 学号: 姓名: 分数:
专业: 学号: 姓名: 分数:
 实验七 基因组DNA的快速提取---碘化钾法
实验七 基因组DNA的快速提取---碘化钾法
一、实验目的
了解碘化钾法提取动物组织基因组DNA的原理;掌握DNA提取的相关操作技术。
二、实验原理
快速、经济地从血液、组织或培养细胞中得到高产量、高纯度的DNA 对于基因研究非常重要。
目前国内外基因组DNA 的提取方法有传统的蛋白酶K 消化法、尿素法、氯化锌法、辛酸法等, 这些方法存在操作步骤繁杂或者使用蛋白酶,且国内许多实验室不易得到方法中使用的试剂。 高浓度碘化钾可直接将细胞膜、核膜破坏、使DNA 释放出来,然后用异丙醇沉淀DNA。实验表明,KI 的浓度对DNA 的提取效率有影响,5 mol/ L 的KI 提取DNA 效果较好。
KI 法操作简便,不用价格较高的蛋白酶K。DNA 丢失少。该方法提取的DNA 与经典的蛋白酶K 法提取的DNA 比较电泳结果基本一致。
三、实验材料、试剂及主要器材
1. 实验材料
冷冻的新鲜动物肝脏。
2. 试剂
氯仿/异戊醇(24∶1):异戊醇21 mL加入到500 mL的氯仿试剂瓶中,混匀;5 mol/L 碘化钾:(41.5克碘化钾溶于50 mL纯水中);0. 9 % NaCl:4.5克NaCl溶于500 mL纯水中;无水乙醇。
3. 主要器材
台式高速(冷冻)离心机、移液器(10, 100,1000 µL),旋涡混合器、Eppendorf管等。
四、实验步骤
1. 取黄豆粒大小冷冻肝组织于EP管中(EP管上写上自己学号的最后两位数),有眼科剪捣碎;
2. 加50 µL 5 mol/ L KI,旋涡振荡30 s,静置3 min;
3. 加0. 9 % NaCl 375 µL,氯仿/异戊醇(24:1) 600 µL,充分振荡10 min,10 000 r/ min 离心5 min ;
4. 吸取水相层(上清)于另一Ependorf 管中,加-20度预冷乙醇1000 µL,轻轻混匀(此时应能看到DNA的絮状沉淀),12 000 r/ min 离心5 min 弃上清;
5. 加冷无水乙醇1000 µL,12,000 r/ min 离心3 min 弃净乙醇,待干(可在37 ℃烘干约10 min);以50 µL无菌双蒸水溶解DNA ,备用。
2. 加50 µL 5 mol/ L KI ,旋涡振荡30 s,将沉淀物混匀3 min;
3. 加0. 9 % NaCl 250 µL,氯仿/异戊醇(24∶1) 375 µL,充分振荡10 min ,10 000 r/ min 离心5 min ;
4. 吸取水相层(上清)于另一Ependorf 管中,加-20度预冷乙醇(-20度)300 µL,轻轻混匀(此时应能看到DNA的絮状沉淀),-20度冰箱静置5 min后12 000 r/ min 离心5 min 弃上清;
 批阅教师: 年 月 日
批阅教师: 年 月 日
5. 加冷无水乙醇1000 µL,12,000 r/ min 离心3 min 弃净乙醇,待干(可在37℃烘干约10 min);以50 µL无菌双蒸水溶解DNA ,备用。
五、思考题
1)在DNA 提取过程中乙醇的作用是什么?为什么用-20度预冷的乙醇效果更好?
2)实验所用的EP管和枪头等需要高温灭菌吗,为什么?
孝感学院生命科学技术学院实验报告



 专业: 学号: 姓名: 分数:
专业: 学号: 姓名: 分数:
 实验八 琼脂糖凝胶电泳技术――DNA样品检测
实验八 琼脂糖凝胶电泳技术――DNA样品检测
一、实验目的
学习与掌握琼脂糖凝胶电泳的技术方法,利用琼脂糖凝胶电泳检测DNA含量以及分子量,分离不同大小DNA片段。
二、实验原理
琼脂糖凝胶电泳是以琼脂糖凝胶为支撑物的区带电泳。不同大小、不同形状和不同构象的DNA分子在相同的电泳条件下(如凝胶浓度、电流、电压、缓冲液等),有不同的迁移率,所以可通过电泳使其分离。凝胶中的DNA可与荧光染料溴化乙锭(EB)结合,在紫外灯下可看到荧光条带,籍此可分析实验结果。
三、试剂配制
1. 5×TBE:Tris 54g;硼酸27.5g;0.5 M EDTA(pH 8.0)20 mL;加双蒸水至1 L。用时5倍稀释。
2. EB:用水配制成10 mg/mL的贮存液,分装,避光,4℃保存(1g溴乙锭于100 mL水中)。
3. 6×加样buffer:0.25%溴酚蓝;40%(W/V)蔗糖;溶于水中,贮存于4℃。
四、实验操作
1. 胶模 水平放置胶模。
2. 制胶 量取200 mL 1×TBE 缓冲液倒入三角烧瓶中,称取1.6克琼脂糖加入,在微波炉上加热至全熔(清澈透明)。凝胶加热时间不宜过长,以免蒸干。
3. 倒胶 用琼脂糖封好胶模,待凝胶冷至50℃左右时(手感容器能耐受),缓缓倒入制胶模中,迅速放好梳子。凝胶的厚度在3~5 mm之间。避免产生气泡,尤其梳子周围不能有气泡,若有气泡,可用吸管小心吸去。
4. 凝胶条件 凝胶通常需要在室温中放置20~30分钟。
5. 电泳缓冲液 凝胶完全凝固后,将凝胶放入电泳槽中(点样孔在负极),加入1×TBE电泳缓冲液,液面应高出凝胶表面1 mm。
6. 拔梳子 小心移去梳子和隔离板,保持点样孔完整。
7. 点样 用移液器取1-2 µL配制好的 Loading Buffer,分别与需要电泳的样品或Marker混合(5-10 µL),点样,记录点样次序。注意:每次电泳每块胶需留一孔点DNA marker。加样时Tip头不必插入孔中,可对准加样孔,在孔的上方加样,样品会沉入孔内。
8. 电泳 开启电泳仪电源开关,观察正负两极是否有气泡出现,如负极气泡比正极多,则表示电泳槽已经接通电源。电泳起始时需采用低压(80~100V),待电泳几分钟后溴酚蓝指示剂迁移至凝胶中,可调整电压至200V恒压电泳,当溴芬兰接近胶的先端,停止电泳。
9. 观测将胶在溴化乙锭(EB)溶液中浸泡约10分钟后,在用凝胶成像仪积分成像后观察并拍照。
 批阅教师: 年 月 日
批阅教师: 年 月 日
五、实验结果
DNA样品琼脂糖凝胶电泳检测图(在自己的点样孔上做上记号)。
六、思考题
1、如果实验成功了,请总结经验;如果实验失败了,请分析原因。
2、谈谈对生物化学实验的看法和建议。
