实验九 熔点的测定
一、实验目的
了解熔点测定的意义,掌握测定熔点的方法。
二、实验原理
通常当结晶物质加热到一定的温度时,即从固态转变为液态。此时的温度为该化合物的熔点,或者说,熔点应为固液两态在大气压力下成平衡时的温度。纯粹的固体有机化合物一般都有它固定的熔点。常用熔点测定法来鉴定纯粹固体有机化合物。纯化合物开始熔化至完全熔化(初熔至全熔)的温度范围叫熔程。温度一般不超过0.5℃~1℃。如该化合物含有杂质,其熔点往往偏低,且熔程也较长。所以根据熔程长短可判别固体化合物的纯度。
三、仪器和药品
⑴仪器
提勒管或双浴式熔点管 温度计(150℃) 橡皮塞 熔点毛细管 长玻璃管(70-80cm)玻璃棒 表面皿 小胶圈 酒精灯铁架台 显微熔点测定仪。
⑵药品
萘 乙酰苯胺 苯甲酸 尿素 浓硫酸。
四、实验操作
由于熔点的测定对有机化合物的研究具有很大的价值,因此如何测出准确的熔点是一个重要问题。目前测定熔点的方法以毛细管法最为简便。现介绍如下:
⑴ 毛细管法测定熔点
①样品的装入
放少许待测熔点的干燥样品(约0.1克)于干净的表面皿上,用玻棒或不锈钢刮刀将它研成粉末并集成一堆。将熔点管开口端向下插入粉末中,然后把熔点管开口端向上,轻轻地在桌面上敲击,以使粉末落入和填紧管底。或者取一支长约30~40厘米的玻管,垂直于一干净的表面皿上,将熔点管从玻管上端自由落下,可更好地达到上述目的,为了要使管内装入高约2~3毫米紧密结实的样品,一般需如此重复数次。沾于管外的粉末须拭去,以免沾污加热浴液。要测得准确的熔点,样品一定要研得极细,装得密实,使热量的传导迅速均匀。对于蜡状的样品,为了解决研细及装管的困难,只得选用较大口径 (2毫米左右)的熔点管。 ②熔点浴
熔点浴的设计最重要的一点是要使受热均匀。下面介绍两种在实验室中最常用的熔点浴。
a.提勒管(Thiele):又称b形管,如图[2-27左]。管口装有开口软木塞,温度计插入其中,刻度应面向木塞开口,其水银球位于b形管上下两叉管口之间,装好样品的熔点管,借少许浴液沾附于温度计下端,使样品的部分置于水银球侧面中部 [见图2-27中]。b形管中装入加热液体 (浴液),高度达上叉管处即可。在图示的部位加热,受热的浴液作沿管上升运动。从而促成了整个b形管内浴液呈对流循环,使得温度较均匀。
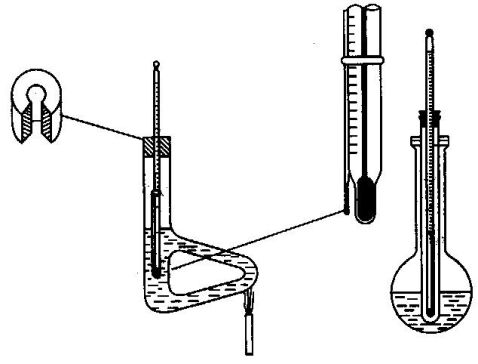
图2-27 毛细管法测定熔点的装置
b.双浴式:如图[2-27右],将试管经开口软木塞插入250毫升平底 (或圆底)烧瓶内,直至离瓶底约1厘米处,试管口也配一个开口软木塞,插入温度计,其水银球应距试管底0.5厘米。瓶内装入约占烧瓶2/3体积的加热体,试管内也放入一些加热液体,使在插入温度计后,其液面高度与瓶内相同。熔点管粘附于温度计和在b形管中相同。
在测定熔点时凡是样品熔点在220℃以下的,可采用浓硫酸作为浴液。但高温时,浓硫酸将分解放出三氧化硫及水。长期不用的熔点浴应先渐渐加热去掉吸入的水分,如加热过快,就有冲出的危险。
当有机物和其他杂质触及硫酸时,会使硫酸变黑。有碍熔点的观察。此时可加入少许硝酸钾晶体共热后使之脱色。
除浓硫酸之外,亦可采用磷酸 (可用于300℃以下)、石蜡油或有机硅油等。如将7份浓硫酸和3份硫酸钾或5.5份浓硫酸和4.5份硫酸钾在通风橱中一起加热,直至固体溶解,这样的溶液可应用在220~320℃的范围。若以6份浓硫酸和4份硫酸钾混合,则可使用至365℃。但此类加热液体不适用于测定低熔点的化合物,因为它们在室温下呈半固态或固态。 ③熔点的测定
将提勒管垂直夹于铁架上,按前述方法装配完毕,以浓硫酸作为加热液体,用温度计水银球蘸取少许硫酸滴于熔点管上端外壁上,即可使之粘着,图[2-27]。将粘附有熔点管的温度计小心地伸入浴中,以小火缓缓加热。开始时升温速度可以较快,到距离熔点10~15℃时,调整火焰使每分钟上升约1~2℃。愈接近熔点,升温速度应愈慢 (掌握升温速度是准确测定熔点的关键)。这一方面是为了保证有充分的时间让热量由管外传至管内,以使固体熔化;另一方面因观察者不能同时观察温度计所示度数和样品的变化情况。只有缓慢加热,才能使此项误差减小。记下样品开始塌落并有液相产生时(初熔)和固体完全消失时(全熔)的温度计读数,即为该化合物的熔程。要注意在初熔前是否有萎缩或软化、放出气体以及其他分解现象。例如一物质在120℃时开始萎缩,在121℃时有液滴出现,在122℃时全部液化,应记录如下:熔点121~122℃,120℃时萎缩。
熔点测定,至少要有两次重复的数据。每一次测定都必须用新的熔点管另装样品,不能将已测过熔点的熔点管冷却,使其中的样品固化后再作第二次测定。因为有时某些物质会产生部分分解,有些会转变成具有不同熔点的其他结晶形式。测定易升华物质的熔点时,应将熔点管的开口端烧熔封闭,以免升华。
如果要测定未知物的熔点,应先对样品粗测一次。加热可以稍快,知道大致的熔点范围后,待浴温冷至熔点以下约30℃左右,再取另一根装样的熔点管作精密的测定。 熔点测好后,温度计的读数须对照温度计校正图进行校正。
一定要待熔点浴冷却后,方可将浓硫酸倒回瓶中。温度计冷却后,用废纸擦去硫酸,否则温度计极易炸裂。
⑵ 微量熔点测定法测定熔点
① 显微熔点测定仪: 用毛细管法测定熔点,操作简便,但样品用量较大,测定时间长,同时不能观察出样品在加热过程中晶形的转化及其变化过程。为克服这些缺点,实验室常采用显微熔点测定仪。
显微熔点测定仪的主要组成可分为两大部分:显微镜和微量加热台。
显微镜可以是专用于这种仪器的特殊显微镜,也可以是普通的显微镜。微量加热台的组成部件如图2-28所示。
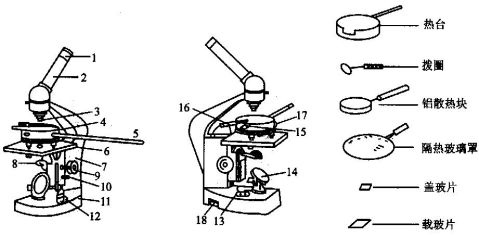
图2-28 放大镜式显微熔点测定仪
显微熔点测定仪的优点:a.可测微量样品的熔点; b.可测高熔点 (熔点可达350℃)的样品; c.通过放大镜可以观察样品在加热过程中变化的全过程,如失去结晶水,多晶体的变化及分解等。
② 实验操作: 先将玻璃载片洗净擦干,放在一个可移动的载片支持器⑦内,将微样品放在载片上,使其位于加热器⑧的中心孔上,用盖玻璃将样品盖住,放在圆玻璃盖③下,打开光源,调节镜头,使显微镜焦点对准样品,开启加热器,用可变电阻调节加热速度,自显微镜的目镜中仔细观察样品晶形的变化和温度计的上升情况 (本仪器目镜视野分为两半,一半可直接看出温度计所示温度,另一半用为观察晶体的变化)。当温度接近样品的熔点(本实验所用样品为苯甲酸,其熔点在122.4℃,注意它本身易于升华)时,控制温度上升的速度为1℃~2℃/分,当样品晶体的菱角开始变圆时,即晶体开始熔化,结晶形完全消失即熔化完毕。重复2次读数。
测定完毕,停止加热,稍冷,用镊子去掉圆玻璃盖,拿走载片支持器及载玻片,放上水冷铁块加快冷却,待仪器完全冷却后小心拆卸和整理部件,装入仪器箱内。
五、温度计校正
用以上方法测定熔点时,温度计上的熔点读数与真实熔点之间常有一定的偏差。这可能是由于温度计的质量所引起。例如一般温度计中的毛细孔径不一定是很均匀的,有时刻度也不很准确。其次,温度计有全浸式和半浸式两种。全浸式温度计的刻度是在温度计的汞线全
部均匀受热的情况下刻出来的,而在测熔点时仅有部分汞线受热,因而露出的汞线温度当然较全部受热者为低。另外经长期使用的温度计,玻璃也可能发生体积变形而使刻度不准。为了校正温度计,可选用一标准温度计与之比较。通常也可采用纯粹有机化合物的熔点作为校正的标准。通过此法校正的温度计,上述误差可一并除去。校正时只要选择数种已知熔点的纯粹化合物作为标准,测定它们的熔点,以观察到的熔点作纵坐标,测得熔点与应有熔点的差数作横坐标,画成曲线,在任一温度时的读数即可直接从曲线中读出。
用熔点方法校正温度计的标准样品如下,校正时可以具体选择。
水一冰 0℃
α一苯胺 50℃
二苯胺 53℃
对二氯苯 53℃
苯甲酸苄酯 71℃
萘 80.55℃
间二硝基苯 90.02℃
二苯乙二酮 95~96℃
乙酰苯胺 114.3℃
苯甲酸 122.4℃
尿素 135℃
二苯基羟基乙酸 151℃
水杨酸 159℃
对苯二酚 173~174℃
3.5一二硝基苯甲酸 205℃
蒽 216.2~216.4℃
酚酞 262~263℃
蒽醌 286℃(升华)
* 零点的测定最好用蒸馏水和纯冰的混合物。在一个15×2.5的试管中放置蒸馏水20毫升,将试管浸在冰盐浴中至蒸馏水部分结冰。用玻棒搅动使之成冰-水混合物。将试管自冰盐浴中移出,然后将温度计插入冰-水中,轻轻搅动混合物,到温度恒定后(2~3min)读数。
六、注 释
[1]用浓硫酸作热浴时,应特别小心,不仅要防止灼伤皮肤,还要注意勿使样品或其它有机物触及硫酸。所以,装置样品时,沾在管外的样品须拭去。否则,硫酸的颜色会变成棕黑。妨碍观察。如已变黑,要酌加少许硝酸钠 (或硝酸钾)晶体,加热后便可退色。
[2]这样测出的熔点可能因温度计的误差而不准确。所以,除了要校正温度计刻度之外,还要将温度计外露段所引起的误差进行读数的校正,才能够得到正确的熔点。
例: 浴液面在温度的30℃处测定熔点为190℃(t1)则外露段为190℃-30℃=160℃,这样辅助温度计水银球应放在160℃×1/2+30=110℃处。测得t2=65℃,熔点为190℃,则K=0.000159。按照上式则可求出:
Δt=O.000159×160×(l90-65)=3.18≈3.2
所以,校正后的熔点应为190+3.2=193.2℃
七、思考题
⑴ 加热的快慢为什么会影响熔点? 在什么情况下加热可以快些? 而在什么情况下加热则要慢些?
⑵是否可以使用第一次测熔点时已经熔化了的有机化合物再作第二次测定呢? 为什么?
第二篇:熔点的测定实验报告

