元素周期律总结
(箭头方向是增强方向)
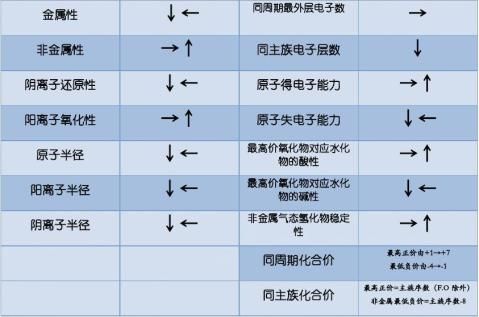

元素周期表中几个量的关系:
(1)原子序数=核电荷数=质子数=核外电子数 (2)周期序数=核外电子层数 (3)主族序数=最外层电子数=元素的最高正价数(F无正价,O一般也无正价)
(4)非金属元素:|最高正价数|+|负价数|=8
知识网络
中子N
质子Z
决定原子呈电中性 原子结构:最外层电子数决定主族元素的 电子数(Z个)(AZX)
→
表示方法 → 原子(离子)的电子式、原子结构示意图
随着原子序数(核电荷数)的递增:元素的性质呈现周期性变化
①、原子最外层电子的周期性变化(元素周期律的本质)
③、元素主要化合价的周期性变化 ④、元素的金属性与非金属性的周期性变化 ①、按原子序数递增的顺序从左到右排列;

具
体 表现
形周期(7 三七式长主 三七A~ⅦA共7个) 短副18BB共7个) 一零
不和③、Ⅷ族(8、9、10纵行) 全八
同周期同主族元素性质的递变规律
①、核外电子排布
②、原子半径
④、金属性与非金属性
⑤、气态氢化物的稳定性
⑥、最高价氧化物的水化物酸碱性
电子层数相同条件下,电子层越多,半径越大。
最外层电子数相同条件下,最外层电子数越多,半径越大。
1、同周期元素的原子半径随核电荷数的增大而减小(稀有气体除外)
如:Na>Mg>Al>Si>P>S>Cl.
2、同主族元素的原子半径随核电荷数的增大而增大。如:Li<Na<K<Rb<Cs
-------- 3、同主族元素的离子半径随核电荷数的增大而增大。如:F<Cl<Br<I
4、电子层结构相同的离子半径随核电荷数的增大而减小。
-+2+3+如:F> Na>Mg>Al
2+3+5、同一元素不同价态的微粒半径,价态越高离子半径越小。如Fe>Fe>Fe
②最高价氧化物的水化物碱性强弱
元素的金属性④互相置换反应 或非金属性强①与H2 弱的判断依据
③单质的氧化性
第二篇:高考化学-元素周期律 总结
高中化学-元素周期律总结
知识结构图:
一·周期表结构
二·“位,构,性”的相互推导
元素周期律
三·原子结构
四·碱金属
五·卤素
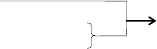
一.周期表结构
1. 元素周期表
注意:①元素周期表的上界②金属与非金属的边界线
2. ⅡA ⅢA 二三 X X+1 四五 X X+11
六七 X X+25
3.每个周期元素的总数和每个周期过渡元素的总数
二.“位、构、性”的相互推导 失电子能力↓?金属性↑
1.结构与性质 原子半径↑?F↓
得电子能力↓?非金属性↓
(1
q1q2F?G 2 核电核数↓ ?F↓ r
半径↓ 半径↑ (主)
同周期 F↓ 同主族 F↓ 质子数↑ 质子数↓(次) 多?得电子
(2)最外层电子数 少?失电子
第 1 页 共 4 页ppy
高中化学-元素周期律总结
4 ?共用电子对
(3)化合价与结构的关系:
最高正价数=最外层电子数
最低负价数=8-最外层电子
2.位置与结构
(1) 周期数=电子数
主族序数=

3.位置与性质
(1

)递变规律

递变规律 -4 原子半径↓,金属性↓,非金属性↑
相似性 化合价相同
递变性 原子半径↑
金属性 ↑
非金属性↓
Ⅳ:- 4,+2,+4
Ⅴ:-3,+3,+5(特殊的氮:-3~+5)
Ⅵ:-2,+4,+6
Ⅶ:-1,+1,+3,+5,+7
成正比:失电子能力,还原性,单质与水,与酸,水化物的碱性
(2
成反比:阳离子的氧化性
成正比:得电子能力,氧化性,单质与氢气,氢化物的稳定性,
(3 最高价氧化物对应的水化物的酸性
成反比:阴离子的还原性
(4)无氧酸的酸性:①同周期:与非金属性成正比,HCl>H2S
②同主族:与非金属性成反比,HF<HCl<HBr<HI
三.原子结构 Z个
原子核 1.原子构成(ZX) AA-Z个
电子:Z个
2.两个等量关系
3.核素
4.同位素
5.核素的相对原子质量≈核素的质量数
6.元素的相对原子质量
第 2 页 共 4 页ppy AAr(ZAm(ZX) X)=112m(C)
高中化学-元素周期律总结
例:Ar(O)=Ar(O)·a%+Ar(O)·b%+Ar(O)·c%
7.核外电子排布规律
(1)2n(个)
(2)最外层≤8(He≤2)
次外层≤18
倒数第三层≤32
(3)能量最低
8. 同周期:从左到右,r↓ (1)原子半径
同主族:从上到下,r↓
质子数↑ ?r
电子数相同 电荷数↑?r↓ (2同主族:从上到下,r↓ 同周期:阴离子>阳离子,且都从左到右减小
(3)同一元素的不同离子:电子数↑?r↑
2161718
四.碱金属
①物理性质:银白色,柔软,密度小,熔、沸点低,导热导电性很好 ②化合价:+1
③活泼金属,易失去电子
④单质还原性很强 1.相似性 ⑤MOH都是强碱
⑥单质易与O2、卤素单质,硫反应
⑦单质易与H2O、酸反应
⑧单质不能从盐溶液中置换出金属
①从上到下单质的溶沸点减小
②单质的密度增大
2.递变性 ③原子半径↑
④离子半径↑
⑤金属性↑
①Cs略带金色光泽
3.特殊性 ②ρ(Na)>ρ(K) Li2O
③与O2反应 M+O2 Na2O2
KO2 (钾以后的更复杂)
五.卤素
第 3 页 共 4 页ppy
高中化学-元素周期律总结
①物理性质:单质熔、沸点都比较低 ②化合价:-1,+2,+3,+5,+7 ③活泼非金属,易得电子 ④单质氧化性很强 ⑤H2+X2→HX 1.相似性 ⑥X2+H2O→HX+HXO(F2除外) ⑦X2+NaOH→NaX+NaXO+H2O(F2除外) ⑧X2+M→MXn
⑨卤代反应
⑩加成反应
①从上到下单质的熔、沸点,密度增大
②单质的状态:气→液→固
③单质的颜色变深
2.递变性 ④非金属性减弱
⑤原子、离子半径增大,
⑥HX的酸性增强
⑦X2+H2O→HX+HXO的反应强度减弱
①氟的化合价只有-1,没有正价
②氟没有含氧酸
③2F2+2H2O=4HF+O2 3. ④F2+NaOH= NaF+OF2↑+H2O
⑤F2不能置换其他卤化物水溶液中的卤素,直接和水反应 ⑥I2和Fe反应生成Fe2+ I2+Fe→FeI2 (Fe+X2→FeX3)
第 4 页 共 4 页ppy
