高考化学考前归纳总结
(反应原理)
[题型分析]
化学反应原理综合应用题是高考Ⅱ卷必考题型之一,问题设计上往往以组合题的形式出现,题目往往围绕一个主题,由多个小题组成,各小题具有一定的独立性,以考查不同的化学反应原理知识为主,有时还兼顾基本概念、元素化合物和简单计算等知识,题目往往还借助于图像、图表、数据等表达化学信息,试题综合性强。
[解题技能]
在解题时要注意以下几个方面:首先快速浏览全题,整体把握题目,明确知识考查背景,以及考查了哪方面的化学反应原理,产生总体印象;其次逐字逐句认真审题,深入思考,准确把握题目提供的条件及求解问题,充分探究题干、图表提供的信息以及问题中的隐含信息。结合条件、信息与问题,联系化学原理,分析推理解决问题;第三各个问题逐个突破,切不可因一个问题没有解决而放弃其他问题;第四认真作答,规范书写,把握答题要点切不可似是而非;最后认真检查再次突破搁置难点。
近三年高考反应原理题型分析

详细知识点:
1.有关化学反应速率的四点注意
(1)化学反应速率的单位是由浓度的单位(mol·L-1)和时间的单位(s、min或h)决定的,可以是mol·L-1·s-1、mol·L-1·min-1或mol·L-1·h-1,在计算时要注意保持时间单位的一致性。
(2)对于某一具体的化学反应,可以用每一种反应物和每一种生成物的浓度变化来表示该反应的化学反应速率,虽然得到的数值大小可能不同,但用各物质表示的化学反应速率之比等于化学方程式中相应物质的化学计量数之比。
(3)化学反应速率不取负值而只取正值。
(4)在整个反应过程中,反应不是以同样的速率进行的,因此,化学反应速率是平均速率而不是瞬时速率。
2.有关化学平衡状态判断的两个辨析
(1)反应体系中各成分的含量
①各物质的物质的量或各物质的物质的量分数不变,化学反应一定处于平衡状态。
②各物质的质量或各物质的质量分数不变,化学反应一定处于平衡状态。
③各气体的体积或体积分数不变,化学反应一定处于平衡状态。
④总压强、总体积、总物质的量不变,化学反应不一定处于平衡状态。
(2)正、逆反应速率的关系
举例反应mA(g)+nB(g) pC(g)+qD(g)
pC(g)+qD(g)
①在单位时间内消耗了m mol A同时生成m mol A,即v正=v逆,化学反应平衡。
②在单位时间内消耗了n mol B同时生成p mol C,均指v正,化学反应不一定平衡。
③vA∶vB∶vC∶vD=m∶n∶p∶q,v正不一定等于v逆,化学反应不一定平衡。
④在单位时间内生成了n mol B,同时消耗q mol D,因均指v逆,化学反应不一定平衡。
3.反应物用量的改变对化学平衡影响的一般规律
(1)若反应物只有一种:aA(g) bB(g)+cC(g),(保持容器体积,温度不变)在不改变其他条件时,增加A的量平衡向正反应方向移动,但是A的转化率与气体物质的化学计量数有关:
bB(g)+cC(g),(保持容器体积,温度不变)在不改变其他条件时,增加A的量平衡向正反应方向移动,但是A的转化率与气体物质的化学计量数有关:
①若a=b+c:A的转化率不变;
②若a>b+c:A的转化率增大;
③若a<b+c:A的转化率减小。
(2)若反应物不只一种:aA(g)+bB(g) cC(g)+dD(g),(保持容器体积,温度不变)
cC(g)+dD(g),(保持容器体积,温度不变)
①在不改变其他条件时,只增加A的量,平衡向正反应方向移动,但是A的转化率减小,而B的转化率增大。
②若按原比例同倍数地增加A和B,平衡向正反应方向移动,但是反应物的转化率与气体物质的化学计量数有关:如a+b=c+d,A、B的转化率都不变;
如a+b>c+d,A、B的转化率都增大;
如a+b<c+d,A、B的转化率都减小。
4.应用勒夏特列原理分析平衡移动的两个注意
(1)不要把v正增大与化学平衡向正反应方向移动等同,只有v正>v逆时,才使化学平衡向正反应方向移动。
(2)不要把化学平衡向正反应方向移动与反应物转化率的提高等同,当反应物总量不变时,化学平衡向正反应方向移动,反应物的转化率提高;当增大一种反应物的浓度,使化学平衡向正反应方向移动时,会使另一种反应物的转化率提高,而本身的转化率降低。
5.化学平衡移动的实质和规律
(1)化学平衡移动的实质是外界条件(如温度、压强、浓度等)的改变破坏了原平衡体系,使得正、逆反应速率不再相等。当v正>v逆时,平衡向正反应方向移动,当v正<v逆时,平衡向逆反应方向移动,移动的结果是v正=v逆。若条件的改变不能引起正、逆反应速率的变化,或者正、逆反应速率的变化相同,则平衡不发生移动。
(2)化学平衡移动的规律——勒夏特列原理
①温度的影响:升高温度,化学平衡向吸热反应方向移动;降低温度,化学平衡向放热反应方向移动。
②浓度的影响:增大反应物浓度或减小生成物浓度,化学平衡向正反应方向移动;减小反应物浓度或增大生成物浓度,化学平衡向逆反应方向移动。
③压强的影响:增大压强会使平衡向着气体体积减小的方向移动;减小压强会使平衡向着气体体积增大的方向移动。
6.判断化学平衡移动方向的思维模型
(1)分析反应特点:①是否有气体参加;②是否有固体或纯液体参加;③ΔV3是否为零;④ΔH变化情况。
(2)分析反应容器特点:①恒温恒容;②恒温恒压。
(3)根据勒夏特列原理分析:①温度的影响;②压强的影响;③浓度的影响。
(4)综合分析判断。
7.速率、平衡图像题的解题模板
(1)定特点:分析确定化学反应特点。
(2)看图像:一看面(纵、横坐标的意义);二看线(线的走向和变化趋势);三看点(起点、拐点、终点);四看辅助线(如等温线、等压线、平衡线);五看量的变化(如浓度变化、温度变化)。
(3)想规律:联想平衡移动原理,分析条件对反应速率、化学平衡移动的影响。
(4)作判断:利用原理,结合图像,分析图像中所代表反应速率变化或化学平衡的线,作出判断。
8.化学平衡计算题的解题思路

三步法是化学平衡计算的一般格式,根据题意和恰当的假设列出起始量、转化量、平衡量.但要注意计算的单位必须保持统一,可用mol、mol/L,也可用L。
9.化学反应进行的方向
若ΔH<0,ΔS>0一定能自发
若ΔH>0,ΔS<0一定不能自发
若ΔH<0,ΔS<0;或ΔH>0,ΔS>0
则一定条件下可以自发
10.酸碱中和滴定中“五个”易错点
(1)酸式滴定管不能盛放碱性溶液和氢氟酸,碱式滴定管不能盛放酸性和强氧化性溶液。
(2)滴定管读数时保留小数点后两位。
(3)滴定的关键是准确测定两种反应物溶液的体积,判断滴定终点,合理选用指示剂。
(4)注意恰好中和=酸碱恰好反应≠溶液呈中性≠滴定终点。
(5)中和滴定误差分析:判断依据是c(待)=c(标)·V(标,aq)/V(待,aq),任何操作的误差最终均可归结到对所用标准液的体积的影响。
11.沉淀溶解平衡的应用
(1)判断在一定条件下沉淀能否生成或溶解
①Qc>Ksp:溶液过饱和,有沉淀析出
②Qc=Ksp:溶液饱和,处于平衡状态
③Qc<Ksp:溶液未饱和,无沉淀析出
(2)判断难溶电解质在水中的溶解能力
当难溶电解质的类型相同时:
①Ksp越大的难溶电解质在水中的溶解能力越强。
②当一种离子和其他几种离子都可能产生沉淀时,Ksp越小,沉淀越容易生成。
(3)判断能否发生沉淀的转化反应
一般来说,Ksp大的沉淀容易转化为Ksp小的沉淀。但在一定条件下也可以使Ksp小的沉淀转化为Ksp大的沉淀,如用饱和Na2CO3溶液浸泡重晶石(BaSO4)可制备可溶性钡盐(BaCO3)。
12.三大平衡常数的比较
(1)电离平衡
举例:NH3·H2O NH+OH-
NH+OH-
平衡表达式:Kb=
影响平衡常数的因素:内因:弱电解质的相对强弱,外因:温度,温度越高,电离程度越大,平衡常数越大
(2)水解平衡
举例:NH+H2O NH3·H2O+H+
NH3·H2O+H+
平衡表达式:Kh=
影响平衡常数的因素:盐的水解程度随温度的升高而增大,Kh随温度的升高而增大
(3)沉淀溶解平衡
举例:PbI2(s) Pb2+(aq)+2I-(aq)
Pb2+(aq)+2I-(aq)
平衡表达式:Ksp=c(Pb2+)·c2(I-)
影响平衡常数的因素:①内因:难溶电解质在水中的溶解能力。②外因:Ksp与温度有关
13.利用盖斯定律书写热化学方程式的思维模型
(1)先确定待求的反应化学方程式。
(2)找出待求热化学方程式中各物质在已知热化学方程式中的位置。
(3)根据待求热化学方程式中各物质的化学计量数和位置对已知热化学方程式进行处理,得到变形后的新热化学方程式。
(4)将新得到的热化学方程式进行加减(反应热也需要相应加减)。
14.化学反应与能量变化图解
放热反应: 吸热反应:
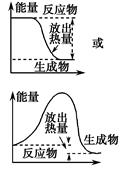

15.原电池反应式的书写
(1)一般电极反应式的书写
①列物质标得失:按照负极发生氧化反应,正极发生还原反应,判断出电极反应产物,找出得失电子的数量。
②看环境配守恒:电极产物在电解质溶液的环境中,应能稳定存在,如碱性介质中生成的H+应让其结合OH-生成水。电极反应式应根据电荷守恒和质量守恒、得失电子守恒等加以配平。
③两式加验总式:两电极反应式相加,与总反应的离子方程式对照验证。
(2)复杂电极反应式的书写
=-
16.电解池电极反应式的书写步骤
(1)分析电极①根据电源或条件确定电极名称。②分析电极是惰性电极还是活泼电极。
(2)分析溶液①确定微粒种类:先分析溶质,后分析溶剂。②确定微粒的量或浓度。
(3)根据离子的移动方向和离子的放电顺序确定电极上的放电离子。
(4)写出电极反应式。
1、 (2014·浙江理综,27)(14分)煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低了脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g) ΔH1=218.4 kJ·mol-1(反应Ⅰ)
CaO(s)+SO2(g)+CO2(g) ΔH1=218.4 kJ·mol-1(反应Ⅰ)
CaSO4(s)+4CO(g) CaS(s)+4CO2(g) ΔH2=-175.6 kJ·mol-1(反应Ⅱ)
CaS(s)+4CO2(g) ΔH2=-175.6 kJ·mol-1(反应Ⅱ)
请回答下列问题:
(1)反应Ⅰ能自发进行的反应条件是___________________________________。
(2)对于气体参与的反应,表示平衡常数Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应Ⅱ的Kp=________(用表达式表示)。
(3)假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是________。

(4)通过监测反应体系中气体浓度的变化可判断反应Ⅰ和Ⅱ是否同时发生,理由是______________________________________________________________。

(5)图1为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线。则降低该反应体系中SO2生成量的措施有________。
A.向该反应体系中投入石灰石
B.在合适的温度区间内控制较低的反应温度
C.提高CO的初始体积百分数
D.提高反应体系的温度
(6)恒温恒容条件下,假设反应Ⅰ和Ⅱ同时发生,且v1>v2,请在图2中画出反应体系中c(SO2)随时间t变化的总趋势图。
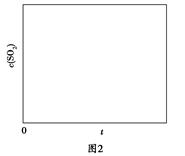
【考情诠释】
(1)考查自发反应的条件,注意对化学反应方向复合判据ΔH-TΔS的应用
(2)考查化学平衡常数表达式,注意题目要求及化学平衡常数的概念
(3)考查化学反应速率与活化能的关系,以及吸热、放热反应过程中的能量变化,注意①反应热决定于反应物和生成物总能量的相对大小;②化学反应的活化能越小;化学反应速率越快
(4)考查学生分析问题的能力,注意分析反应Ⅰ和Ⅱ发生时SO2和CO2的比例变化
(5)考查影响化学平衡移动的因素,注意化学平衡移动原理的应用和图像信息的获取
(6)考查学生的分析能力和绘图能力,注意已知条件v1>v2和化学平衡移动原理的综合应用
【标准答案】
(1)高温(2分) (2)(2分) (3)C(2分)
(4)如果气相中SO2和CO2两种气体的浓度之比随时间发生变化,则表明两个反应同时发生(2分) (5)ABC(3分)
(6) (3分)
(3分)
2.(2014·全国理综I化学卷,T27)(15分)次磷酸(H3PO2)是一种精细磷化工产品,具有较强的还原性。回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式_______________________。
(2)H3PO2和NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银。
①H3PO2中,P元素的化合价为__________。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为___________(填化学式)。
③NaH2PO2为___________(填“正盐”或“酸式盐”),其溶液显_______(填“弱酸性”、“中性”或“弱碱性”)。
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应,写出白磷与Ba(OH)2溶液反应的化学方程式__________________________________________。
 (4)H3PO2也可用电渗析法制备。“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
(4)H3PO2也可用电渗析法制备。“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
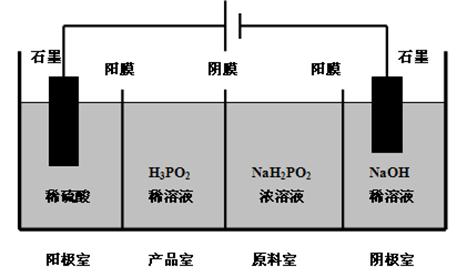
①写出阳极的电极反应____________________________________。
②分析产品室可得到H3PO2的原因___________________________________。
③早期采用“三室电渗析法”制备H3PO2:将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室。其缺点是产品中混有 杂质,该杂质产生的原因是 。
【答案】(1)H3PO2 H++H2PO2-
H++H2PO2-
(2)①+1。②H3PO4。③正盐,碱性。
(3)2P4+3Ba(OH)2+6H2O=2PH3↑+3Ba(H2PO2)2
(4)①2H2O-4e-=4H++O2↑或4OH--4e-=2H2O+O2.
②由于阳极室OH-放电,造成H+浓度增大,通过阳膜扩散进入产品室,而原料室中的H2PO2-可以通过阴膜进入产品室,二者反应生成H3PO2.
③H3PO4或PO43-。由于H3PO2具有还原性,电解时就会有H3PO2在阳极放电而被氧化生成H3PO4。
【解析】(1)一元酸,只发生一步电离,中强酸是弱电解质:H3PO2 H++H2PO2-
H++H2PO2-
(2)①利用元素化合价代数和为零,得出P元素为+1价。
②H3PO2做还原剂,Ag+是氧化剂,二者1︰4反应,则H3PO2失去4个电子,P元素变为+5价,生成H3PO4。
③由于H3PO2是一元酸,所以NaH2PO2是正盐,弱酸强碱盐水解显碱性。
(3)反应的反应物与产物都给出,是P元素的歧化反应,注意配平就可以:2P4+3Ba(OH)2+6H2O=2PH3↑+3Ba(H2PO2)2
(4)①阳极室电极上发生氧化反应,失电子的是OH-。2H2O-4e-=4H++O2↑或4OH--4e-=2H2O+O2↑.
②由于阳极室OH-放电,造成H+浓度增大,H+通过阳膜进入产品室,而原料室中的H2PO2-可以通过阴膜进入产品室,生成H3PO2.
③由于H3PO2具有还原性,电解时就会有H3PO2在阳极放电而生成H3PO3。
第二篇:1-高考化学考前归纳总结(有机)
高考化学考前归纳总结
(有机化学)
一、近5年高考理综化学有机推断题分析
在化学非选择题四大题中,20##、20##年、20##年的得分率最高,20##年、2010得分率列第二高,可见有机化学题难度不是太大,做好有机化学题是提高分数的关键之一。

近几年广东理科综合有机大题考点和题型都比较稳定,一般提供五种左右的物质展开设问,而设问一般都是围绕分子式 结构简式、化学方程式、官能团的书写或名称,反应类型和官能团性质的判断来考查。有机题中都会出现一些“温馨提示”——陌生信息,这是有机体的难点之一,从几年的年报分析可知这类陌生信息的迁移和化学方程式仿写题也是学生在有机题中丢分最严重的题目,所以在二轮复习中要进行突破。
二、有机推断题中陌生信息分析
广东高考有机大题中一定会包含信息化处理的考点,陌生信息的提出都会在题头的题干中,形式一般有3种:
1、从未学过的方程式(如13年、12年、11年、10年试题)
2、文字叙述的未知的转化(如14年试题)
3、有机合成路线图中一种未知的转化关系(如14年江门一模试题)

抓住核心知识,精讲精练,以同分异构体、反应类型、有机合成反应的规律为平台,提高有机化学应试的核心能力—信息提取、整合、迁移应用的能力。
三、对应的突破策略
(一)夯实知识基础
1、突出重点,熟记常见有机物官能团的结构和性质。

2、特别关注下列反应条件,理解重要的有机反应类型。
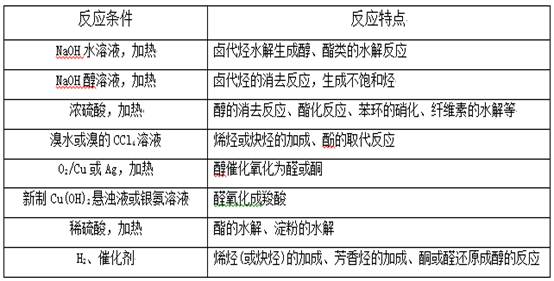
3、默写有机化学方程式,弄清物质之间的转化关系。
默写化学方程式的形式多样,可以是单独方程式的默写,也可以是根据物质转化关系默写。
如:写出下列各转化的化学方程式:

这种题型有助于学生牢牢抓住“有机物之间转化关系”这条主线,从官能团结构上、官能团之间的转化、官能团的衍变上掌握有机物的性质,同时注意到对应有机反应类型、反应条件、反应现象的区别。
要特别关注:
①根据价键理论书写结构简式,不要少H或多H;
②原子的连接次序,如—OH不能写成—HO, —CHO不能写成COH—, —NO2不能写成—O2N);
③检查小分子是否遗漏,建议先写小分子,再写有机分子;
④条件缺漏不全;
⑤注意易混淆的反应条件(如卤代烃的消去和取代反应);
⑥注意同一条件下多个官能团同时反应,不能顾此失彼
(  在NaOH溶液下反应 )
在NaOH溶液下反应 )
(二) 陌生方程式进行信息化处理的步骤方法
1、提取新信息:识别与对比
一是迅速识别有机物中熟悉的官能团,推断其性质;二是仔细对比反应前后有机物结构组成、官能团的变化,找出反应发生的关键——旧键的断裂处和新键的形成之处,忽略结构没有变化的部分。
2、整合新信息 把已经提取出来的信息与题设的情景、设问中要解决的问题、脑海里储存的已知知识进行整合。
3、迁移模仿 将比对信息化处理提炼出来的结果迁移到要应用的有机物,找出其相似的关键部分断键、成键、反应条件)进行模仿,书写出新反应。
巩固练习
(15分)慢心律是一种治疗心律失常的药物,它的合成路线如下:

(1)由B→C的反应类型为_____________。
(2)C分子中有2个含氧官能团,分别为____ ____和__________(填官能团名称)。
(3)写出A与浓溴水反应的化学方程式______________________________。
(4)由A制备B的过程中有少量副产物E,它与B互为同分异构体,E的结构简式为_ _。
(5)写出同时满足下列条件的D的一种同分异构体的结构简式:___________。 ①属于α-氨基酸;②是苯的衍生物,且苯环上的一氯代物只有两种;③分子中含有两个手性碳原子。
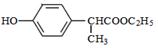
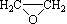 (6)已知乙烯在催化剂作用与氧气反应可以生成环氧乙烷( )。写出以邻甲基苯
(6)已知乙烯在催化剂作用与氧气反应可以生成环氧乙烷( )。写出以邻甲基苯
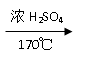 酚 (
酚 ( 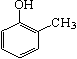 )和乙醇为原料制备
)和乙醇为原料制备 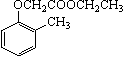 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下: CH3CH2OH CH2 = CH2
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下: CH3CH2OH CH2 = CH2
【(15分)(1)氧化反应(2分) (2)醚键、羰基(2分)
(3) 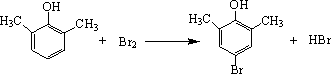 (2分)
(2分)
(4)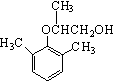 (2分)
(2分)
(5)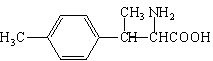 (2分)
(2分)
(6)(5分)
