一、物质的颜色与状态特性
初三的学生应对以下物质颜色和状态做到熟悉
Cu:红色
Cu2O:鲜红色固体(沉淀)
Fe:银白色固体、黑色粉末
H2:最轻的气体
CO:有毒气体
MnO2、CuO、C:黑色固体
MgO、CuSO4:白色粉末
CuSO4·5H2O:蓝色固体
Cu(OH)2、CuCO3:蓝色固体(沉淀)
Cu2(OH)2CO3:绿色粉末
Fe(OH)3:红褐色固体(沉淀)
KMnO4:紫色固体
S:淡黄色固体(粉末)
NaOH:易吸水、易潮解
Na2CO3·10H2O:易风化
CaCl2、浓H2SO4、CaO:易吸水
HCl、NH3:刺激性气味、极易溶于水
SO2:刺激性气味,污染气体
FeCl2、FeSO4:浅绿色溶液
FeCl3:黄色溶液
CuSO4:蓝色溶液
AgCl、BaSO4:不溶于酸的白色沉淀
更多教程加作者QQ:954120
二、化学反应特征
初三的同学请对以下化学反应的特征(包括现象和反应物生成物特点)加以熟悉。
S + O2:蓝紫色火焰
Fe + O2:火星四射
H2、CO、CH4 + O2:淡蓝色火焰
P + O2:大量白烟
Mg + O2:耀眼白光
Cu2(OH)2CO3、KMnO4 (△):加热分解产生三种产物
CuO + C、Fe2O3/Fe3O4 + C/CO:高温反应
CaCO3分解:高温反应
CH4、C2H5OH、糖类 + O2:燃烧生成CO2和H2O
H2O的分解:通电反应
三、六大核心关系网
以下六个关系网请同学们务必熟悉,对化学不是很感冒的同学做到尽量默写。
碳关系网:
铜关系网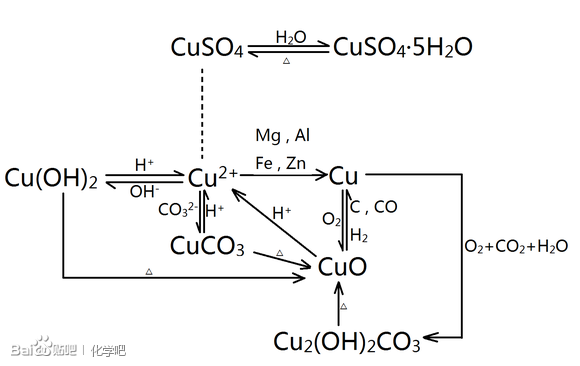
铁关系网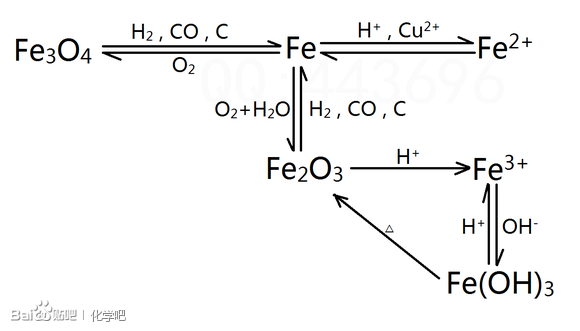
钙关系网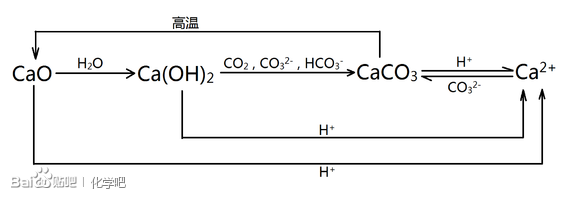
氢关系网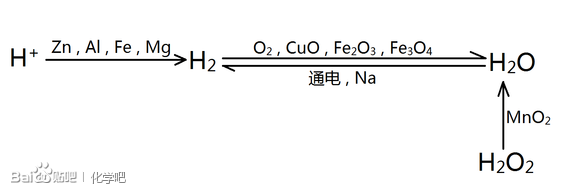
氧关系网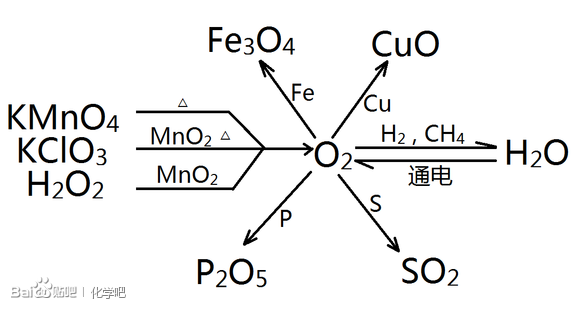
四、离子反应
1、去杂离子沉淀一般规则
Cl- ——Ag+
SO42- ——Ba2+
CO32- ——Ca2+、H+
OH- ——Mg2+
2、Ba2+和Ag+
Ba2+或Ag+在推断题中出现,一般题目中要出现CO32-、SO42-或CO32-、Cl-。注意对应碳酸盐沉淀可溶于酸,AgCl、BaSO4不溶于酸。
3、中间反应沉淀一般规则
① 先:Ba2+ +CO32-→BaCO3↓
后:BaCO3+H+→Ba2+ (H+代表HCl或者HNO3,有气体放出)
②先:Ag+ +CO32-→Ag2CO3 ↓
后:Ag2CO3+H+→Ag+ (H+代表HNO3,有气体放出)
4、双沉淀反应
题目中出现了双沉淀,一般与Ba(OH)2有关,另一种反应物阳离子对应的碱为沉淀,阴离子为SO42-,如CuSO4、MgSO4、Fe2(SO4)3等。
5、可溶反应物的离子构成及其参加反应难易程度
反应潜能指的是某物质最多可以和多少其它物质参加化学反应(现有知识体系内)。钠盐钾盐(或碱)只有阴离子有反应潜能;硝酸盐(或酸)只有阳离子有反应潜能;NaNO3和KNO3一般不参加反应。
其余的可溶情况,阴离子和阳离子有时候都有反应潜能。一般说来,潜能最大的是Ba(OH)2,各种可溶硫酸盐、氯化物的反应潜能其次。
五、化学方程式汇总
一. 物质与氧气的反应:
(1)单质与氧气的反应:
1. 镁在空气中燃烧:2Mg + O2 点燃 2MgO
2. 铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O4
3. 铜在空气中受热:2Cu + O2 加热2CuO
4. 铝在空气中燃烧:4Al + 3O2 点燃 2Al2O3
5. 氢气中空气中燃烧:2H2 + O2 点燃 2H2O
6. 红磷在空气中燃烧:4P + 5O2 点燃 2P2O5
7. 硫粉在空气中燃烧: S + O2 点燃 SO2
8. 碳在氧气中充分燃烧:C + O2 点燃 CO2
9. 碳在氧气中不充分燃烧:2C + O2 点燃 2CO
(2)化合物与氧气的反应:
10.一氧化碳在氧气中燃烧:2CO + O2 点燃 2CO2
11.甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O
12.酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O
二.几个分解反应:
13.水在直流电的作用下分解:2H2O 通电 2H2↑+ O2 ↑
14.加热碱式碳酸铜:Cu2(OH)2CO3 加热 2CuO + H2O + CO2↑
15.加热氯酸钾(有少量的二氧化锰):2KClO3 ==== 2KCl + 3O2 ↑
16.加热高锰酸钾:2KMnO4 加热 K2MnO4 + MnO2 + O2↑
17.碳酸不稳定而分解:H2CO3 === H2O + CO2↑
18.高温煅烧石灰石:CaCO3 高温 CaO + CO2↑
三.几个氧化还原反应:
19.氢气还原氧化铜:H2 + CuO 加热 Cu + H2O
20.木炭还原氧化铜:C+ 2CuO高温 2Cu + CO2↑
21.焦炭还原氧化铁:3C+ 2Fe2O3 高温 4Fe + 3CO2↑
22.焦炭还原四氧化三铁:2C+ Fe3O4 高温 3Fe + 2CO2↑
23.一氧化碳还原氧化铜:CO+ CuO 加热Cu + CO2
24.一氧化碳还原氧化铁:3CO+ Fe2O3 高温 2Fe + 3CO2
25.一氧化碳还原四氧化三铁:4CO+ Fe3O4 高温 3Fe + 4CO2
四.单质、氧化物、酸、碱、盐的相互关系
(1)金属单质 +酸 -------- 盐+氢气(置换反应)
26.锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑
27.铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑
28.镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑
29.铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑
30.锌和稀盐酸Zn + 2HCl === ZnCl2 + H2↑
31.铁和稀盐酸Fe + 2HCl === FeCl2 + H2↑
32.镁和稀盐酸Mg+ 2HCl === MgCl2 + H2↑
33.铝和稀盐酸2Al + 6HCl== 2AlCl3 + 3H2↑
(2)金属单质 + 盐(溶液) ------- 另一种金属 + 另一种盐
34.铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu
35.锌和硫酸铜溶液反应:Zn + CuSO4 === ZnSO4 + Cu
36.铜和硝酸汞溶液反应:Cu + Hg(NO3)2 === Cu(NO3)2 + Hg
(3)碱性氧化物 +酸 -------- 盐 +水
37.氧化铁和稀盐酸反应:Fe2O3 + 6HCl === 2FeCl3 + 3H2O
38.氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 === Fe2(SO4)3 + 3H2O
39.氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2O
40.氧化铜和稀硫酸反应:CuO + H2SO4 ==== CuSO4 + H2O
41.氧化镁和稀硫酸反应:MgO + H2SO4 ==== MgSO4 + H2O
42.氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2O
(4)酸性氧化物 +碱 -------- 盐 + 水
43.苛性钠暴露在空气中变质:2NaOH + CO2 ==== Na2CO3 + H2O
44.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3 + H2O
45.苛性钠吸收三氧化硫气体:2NaOH + SO3 ==== Na2SO4 + H2O
46.消石灰放在空气中变质:Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O
47. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 ==== CaSO3 ↓+ H2O
(5)酸 + 碱 -------- 盐 + 水
48.盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O
49. 盐酸和氢氧化钾反应:HCl + KOH ==== KCl +H2O
50.盐酸和氢氧化铜反应:2HCl + Cu(OH)2 ==== CuCl2 + 2H2O
51. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 ==== CaCl2 + 2H2O
52. 盐酸和氢氧化铁反应:3HCl + Fe(OH)3 ==== FeCl3 + 3H2O
53.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 ==== AlCl3 + 3H2O
54.硫酸和烧碱反应:H2SO4 + 2NaOH ==== Na2SO4 + 2H2O
55.硫酸和氢氧化钾反应:H2SO4 + 2KOH ==== K2SO4 + 2H2O
56.硫酸和氢氧化铜反应:H2SO4 + Cu(OH)2 ==== CuSO4 + 2H2O
57. 硫酸和氢氧化铁反应:3H2SO4 + 2Fe(OH)3==== Fe2(SO4)3 + 6H2O
58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O
(6)酸 + 盐 -------- 另一种酸 +另一种盐
59.大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑
60.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑
61.碳酸镁与稀盐酸反应: MgCO3 + 2HCl === MgCl2 + H2O + CO2↑
62.盐酸和硝酸银溶液反应:HCl + AgNO3 === AgCl↓ + HNO3
63.硫酸和碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑
64.硫酸和氯化钡溶液反应:H2SO4 + BaCl2 ==== BaSO4 ↓+ 2HCl
(7)碱 + 盐 -------- 另一种碱 + 另一种盐
65.氢氧化钠与硫酸铜:2NaOH + CuSO4 ==== Cu(OH)2↓ + Na2SO4
66.氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe(OH)3↓ + 3NaCl
67.氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg(OH)2↓ + 2NaCl
68. 氢氧化钠与氯化铜:2NaOH + CuCl2 ==== Cu(OH)2↓ + 2NaCl
69. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 === CaCO3↓+ 2NaOH
(8)盐 + 盐 ----- 两种新盐
70.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 ==== AgCl↓ + NaNO3
71.硫酸钠和氯化钡:Na2SO4 + BaCl2 ==== BaSO4↓ + 2NaCl
五.其它反应:
72.二氧化碳溶解于水:CO2 + H2O === H2CO3
73.生石灰溶于水:CaO + H2O === Ca(OH)2
74.氧化钠溶于水:Na2O + H2O ==== 2NaOH
75.三氧化硫溶于水:SO3 + H2O ==== H2SO4
76.硫酸铜晶体受热分解:CuSO4·5H2O 加热CuSO4 + 5H2O
77.无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4·5H2
第二篇:初中化学常见物质总结
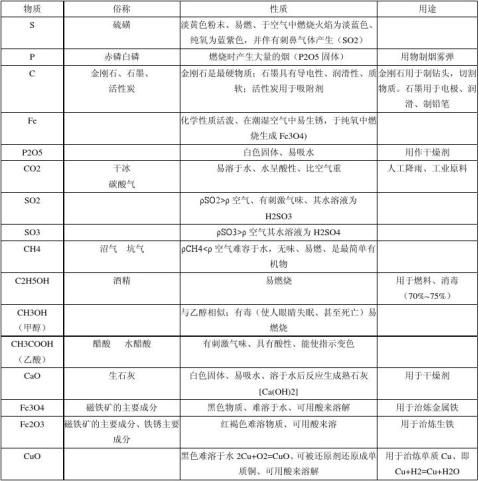
初中化学知识总结(常见物质的性质和用途)
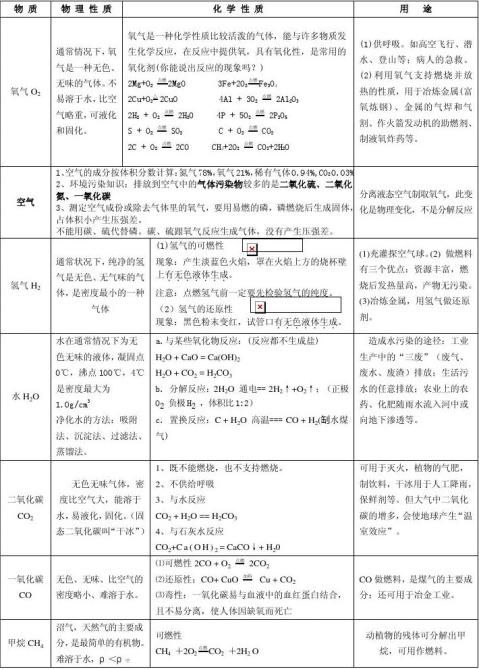
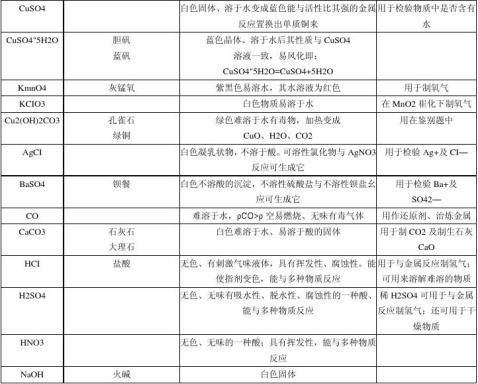


初中常见物质化学式及俗称及重要性质和用途 总结
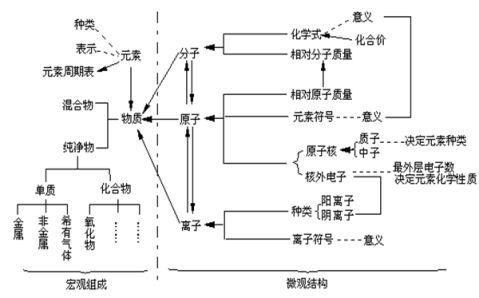

九年级化学有关简答题的一些知识点总结(上学期)
一、 大气污染物的主要成分、危害及防治
污染物:气体(二氧化硫、一氧化碳、二氧化氮),烟尘(可吸入颗粒物)等;
原因:化石燃烧的大量使用(不充分燃烧产生大量一氧化碳,煤、石油中含有硫、氮元素,燃烧时产生二氧化硫和二氧化氮)
危害:严重损害人体健康,影响作物生长,破坏生态平衡。造成全球气候变暖(温室效应)、臭氧层破坏,酸雨等。
防治:加强大气质量监测,改善环境状况,减少使用煤、石油等能源,使用清洁能源,积极植树、造林、种草等
二、水体污染的来源、危害及水资源的保护
来源:工业污染(工业上未经处理的废水、废物)和生活污染(生活污水的任意排放)及农业污染(农药、化肥的不合理施用)
危害:影响工农业、渔业生产,破坏水生生态系统,还会直接危害人体健康。
水资源的爱护:
1、节约用水:提高水的的利用效益,使用新技术、改革工艺和改变生活习惯, 使用节水型用水器;(注:良好生活习惯见课本P62家庭用水情况调查表)
2、防止水体污染:工业上通过应用新技术、新工艺减少污染物的产生,同时对
污染的水体作处理使之符合排放标准;农业上提倡使用农家肥,合理使用化肥和农药;生活污水也应逐步实现集中处理和排放。
另: 淡水资源缺乏的原因:可利用的淡水资源少(淡水只约占全球水储量的2。53%,且大部分分布在两极冰川等);水污染情况日益严重;工业、农业、生活用水的大量增加。
关于开发水资源的方法:开发地下水,淡化海水、开发冰川、人工降雨。
三、关于温室效应:(大气中的二氧化碳气体能像温室玻璃或塑料膜那样,使地球吸收的热量不易散失,从而使地球变暧)
1、产生原因:大气中二氧化碳含增加(由于大量使用化石燃料,产生了大量的二氧化碳)。除此之外,还有臭氧(O3)、甲烷(CH4)、氟氯代烷等气体
2、危害:导致两极冰川融化,使海平面升高,淹没部分沿海城市;使土地沙漠化;农业减产;
3、防止:减少化石燃烧的使用,更多的利用太阳能、风能、地热等清洁能源;大力植树造林,严禁砍伐森林等。
注:若是你能做到的,则有:双面使用纸张;不使用一次性木筷;以电子贺卡代替纸质贺卡;不焚烧垃圾等等。
说明:“西气东输”即以天然气为燃料或以酒精为能源都不能缓解温室效应,因为它们在燃烧时都产生大量的二氧化碳。
四、酸雨的产生、危害及防治
形成:煤燃烧时排放出大量的二氧化硫、二氧化氮等污染物,这些气体溶于雨水生成酸,从而形成酸雨。
(注:PH小于5.6的才能称为酸雨)
危害:(1)对人体健康的直接危害,酸雾毒性比二氧化硫大得多,可以引起肺气肿等疾病而使人死亡。
(2)引起河流、湖泊的水体酸化,严重影响水生动植物的生长。
(3)腐蚀金属及建筑物、雕像等。
(4)破坏土壤、植被、森林。
(4)引起地下水酸化,使地下水中一些金属离子(如铝、锌、铜、镉等)含量增多。
防治:使用脱硫煤;研究煤中硫资源的的综合开发和利用;工厂废气必须经处理后才能排放;研究开发新能源如氢能、太阳能等。(注:西气东输有助于解决这问题)
五、关于燃料(能源)的使用问题
化石燃料产生污染原因:1、燃料中的一些杂质如硫等燃烧时,产生空气污染物如二氧化硫等;2、燃料燃烧不充分,产生一氧化碳;3、末燃烧的碳氢化合物及碳粒、尘粒等排放到空气中。
防冶:燃烧时会对空气造成污染,所以需要使用和开发清洁的燃料。
发展:人们正在利用和开发其他新能源,如太阳能、核能、风能、地热能和潮汐能等。
六、汽车尾气的污染及防治
产生:主要污染物有一氧化碳、未燃烧的碳氢化合物、氮的氧化物、含铅化合物和烟尘等。
防治:1、改进发动机的燃烧方式,以使汽油能充分燃烧;2、使用催化净化装置,使有害气体转化为无害物质;3、使用无铅汽油,禁止含铅物质排放。4、在管理上,加大检测尾气的力度,禁止没达到环保标准的汽车上路。
七、易燃易爆物的储存、使用常识
1.有良好的通风设备和静电消除设备,严禁烟火,杜绝一切可产生火花的因素。
2.盛装易燃物和易爆物的容器要牢固、密封,有明显的警告标志,物质的名称、化学性质和注意事项。
3.易燃物和易爆物不能跟其它物质混存, 对遇水或受阳光照射容易发生燃烧或爆炸的物质,不能存放在露天或高温的地方。
4.存放易燃物和易爆物时,不能堆放得过高过密
5.存放易燃物和易爆物的仓库,要做到人走电断,并进行经常性的防火检查。
八、化学对人类和社会发展的重要作用可见上册P2倒数第6行
九、实验评价多方面
1、 从原料方面考虑——来源要广泛,易得,充分利用资源
2、 从条件方面考虑——易实现
3、 从生成物考虑——无污染,而且最好原子的利用率达到100%---化合反应(符号绿色化学的要求;)
4、 从实验操作上考虑——简单、易操作,易实现
5、 从安全方面,如使用可燃性气体、有毒性物品或浓硫酸时往往要考虑这点
6、 从经济角度——经济实惠,如铁、稀盐酸、生石灰、熟石灰、石灰石等物质都是较平的物质。
