化学必修一基础知识总结
第二章 化学物质及其变化
第一节 物质的分类
一、物质分类的方法
1、 交叉分类法:
2、 树状分类法:
二、分散系及其分类
1、 分散系:把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系,叫做分散系。被分散的物质称作分散质;起容纳作用的物质称作分散剂。
2、 分散系的分类
① 按照分散质或分散剂所处的状态,可分为9种分散系。(参照课本第26页 图2-4)
② 按照分散质粒子的大小来分类,可分为:溶液、胶体和浊液。
3、 溶液、胶体和浊液三种分散系的比较

三、胶体的概念及性质
1、 胶体:分散质粒子直径在1-100nm之间的分散系称为胶体
2、 胶体的性质
① 丁达尔现象:当一束可见光通过胶体时,可以看到一条光亮的“通路”。这条光亮的“通
路”是由于胶体粒子对光线的散射形成的,叫做丁达尔现象。
应用:利用胶体的丁达尔现象可以区别溶液与胶体。
② 电泳:由于胶粒带有电荷,所以在外加电场的作用下,胶粒就会向某一极(阴极或阳
极)做定向移动。这种运动现象叫做电泳。
应用:冶金厂的大量烟尘可用高压电除去,就是利用了胶体电泳的这一性质。
第二节 离子反应
一、酸、碱、盐在水溶液中的电离
1、 电解质:在水溶液里或熔化状态下能够导电的化合物叫做电解质。
2、 非电解质:在水溶液里和熔化状态下都不能导电的化合物叫做非电解质。
3、 电离:电解质在水溶液里或熔融状态下,解离出自由移动的阴阳离子的过程叫做电离。
4、 电离方程式:用化学符号来表示电解质电离的式子叫做电离方程式。
【请你动手做一做】写出HNO3 H2SO4 HCl NaOH Ba(OH)2 KOH KCl Na2CO3
NaHCO3 K2SO4 KHSO4的电离方程式
5、 从电离的角度认识酸、碱、盐
① 酸:电离出的阳离子全部是H+的化合物叫做酸
② 碱:电离出的阴离子全部是OH-的化合物叫做碱
③ 盐:电离出金属阳离子和酸根阴离子的化合物叫做盐
【请你做一做】1、下列状态的物质,既能导电又属于电解质的是( )
A、MgCl2晶体 B、NaCl溶液 C、液态HCl D、熔融的NaOH
2、下列物质:Fe 、O2、Na2SO4固体、乙醇、HNO3、干冰、熟石灰、生石灰、CH4、NH3,其中,① 是电解质,② 是非电解质,③ 既不是电解质也不是非电解质。
3、下列物质在水溶液中的电离方程式书写正确的是 ( )
A、Ba(OH)2====Ba2+ + (OH)2- B、Na2SO4====Na2+ + SO42-
C、NaHCO3===Na+ + H+ +CO32- D、NaHSO4==== Na+ + H+ + SO42-
二、离子反应及其发生的条件
1、离子反应:有离子参加或离子生成的反应叫做离子反应。
2、离子反应发生的条件:有气体、沉淀、水中的一种生成,这个离子反应就能发生。
3、离子方程式:用实际参加反应的离子符号来表示化学反应的式子就叫做离子方程式。
4、离子方程式的书写:{H2SO4和Ba(OH)2为例来复习离子方程式书写的步骤}
①写:根据事实写出正确的化学方程式
②拆:将可溶于水,易电离的物质拆成离子的形式;所有的氧化物、NH3和H2O以及难
溶的物质仍旧写成化学式的形式。
③删:将等号两边相同的离子删去
④查:利用质量守恒和电荷守恒检查并整理离子方程式且各项系数为最简比
【小case,我会做】请按照离子方程式的书写步骤进行书写下列化学反应的离子方程式
⑴硫酸铜与氢氧化钠的反应 ⑵稀盐酸与氢氧化钡的反应
⑶稀盐酸与碳酸钙的反应 ⑷稀硫酸与碳酸钠的反应
⑸硫酸铜与铁单质的反应 ⑹稀硫酸与氢氧化钡的反应
第三节 氧化还原反应
一、氧化还原反应
1、氧化还原反应:有化合价升降的反应就叫做氧化还原反应。
2、氧化还原反应的特征:有化合价的升降
3、氧化还原反应的实质:有电子的转移或者电子对的偏移
4、氧化还原反应的规律:化合价升高的总数=失电子总数=化合价降低总数=得电子总数
5、氧化剂:化合价降低的物质(或得到电子的物质)叫做氧化剂(什么是还原产物呢?)
常见的氧化剂有:O2 、Cl2、 浓硫酸、 HNO3 、KMnO4、 FeCl3等
还原剂:化合价升高的物质(或失去电子的物质)叫做还原剂(什么是氧化产物呢?)
常见的还原剂有:活泼的金属单质如Al、Zn、Fe,以及C、H2、CO等
二、四种基本反应类型与氧化还原反应的关系(参见优化方案第41页的图示关系)
三、用双线桥表示氧化还原反应{请同学们一定要记住“升(化合价升高)、失(失去电子)、氧(被氧化或者是发生氧化反应)、还(作还原剂)”}
第二篇:人教版化学必修1第一单元期末复习知识总结
人教版化学必修1第一单元期末复习知识总结
一、化学实验安全
1、做有毒气体的实验时,应在通风厨中进行,并注意对尾气进行适当处理(吸收或点燃等)。进行易燃易爆气体的实验时应注意验纯,尾气应燃烧掉或作适当处理。
2、烫伤宜找医生处理。
3、浓酸撒在实验台上,先用Na2CO3(或NaHCO3)中和,后用水冲擦干净。浓酸沾在皮肤上,宜先用干抹布拭去,再用水冲净。浓酸溅在眼中应先用稀NaHCO3溶液淋洗,然后请医生处理。
4、浓碱撒在实验台上,先用稀醋酸中和,然后用水冲擦干净。浓碱沾在皮肤上,宜先用大量水冲洗,再涂上硼酸溶液。浓碱溅在眼中,用水洗净后再用硼酸溶液淋洗。
5、钠、磷等失火宜用沙土扑盖。
6、酒精及其他易燃有机物小面积失火,应迅速用湿抹布扑盖。
二、混合物的分离和提纯

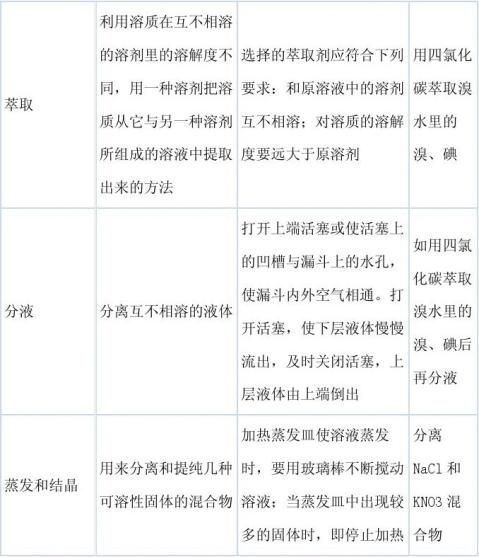
三、离子检验
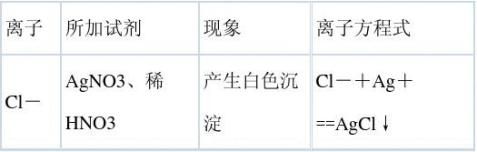

四、除杂
注意事项:为了使杂质除尽,加入的试剂不能是“适量”,而应是“过量”;但过量的试剂必须在后续操作中便于除去。
五、物质的量的单位——摩尔
1.物质的量(n)是表示含有一定数目粒子的集体的物理量。
2.摩尔(mol):把含有6.02 ×1023个粒子的任何粒子集体计量为摩尔。
3.阿伏加德罗常数:把6.02 X1023mol-1叫作阿伏加德罗常数。
4.物质的量=物质所含微粒数目/阿伏加德罗常数
n =N/NA
5.摩尔质量(M)
(1)定义:单位物质的量的物质所具有的质量叫摩尔质量。
(2)单位:g/mol或g..mol-1
(3)数值:等于该粒子的相对原子质量或相对分子质量。
6.物质的量=物质的质量/摩尔质量 ( n = m/M )
六、气体摩尔体积
1.气体摩尔体积(Vm)
(1)定义:单位物质的量的气体所占的体积叫做气体摩尔体积。
(2)单位:L/mol
2.物质的量=气体的体积/气体摩尔体积n=V/Vm 1
3.标准状况下, Vm = 22.4 L/mol
七、物质的量在化学实验中的应用
1.物质的量浓度
(1)定义:以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的浓度。
(2)单位:mol/L
(3)物质的量浓度 = 溶质的物质的量/溶液的体积
CB = nB/V
2.一定物质的量浓度的配制
(1)基本原理:根据欲配制溶液的体积和溶质的物质的量浓度,用有关物质的量浓度计算的方法,求出所需溶质的质量或体积,在容器内将溶质用溶剂稀释为规定的体积,就得欲配制得溶液.
(2)主要操作
a.检验是否漏水.b.配制溶液
1计算 2称量 3溶解 4转移 5洗涤 6定容 7摇匀 8贮存溶液 注意事项:A 选用与欲配制溶液体积相同的容量瓶。
B使用前必须检查是否漏水。
C不能在容量瓶内直接溶解。
D溶解完的溶液等冷却至室温时再转移。
E定容时,当液面离刻度线1―2cm时改用滴管,以平视法观察加水至液面最低处与刻度相切为止。
3.溶液稀释:C(浓溶液)·V(浓溶液) = C(稀溶液)·V(稀溶液)
