阿伏伽德罗常数试题专题汇编
 1.(09福建)设NA为阿伏伽德罗常数,下列叙述正确的是
1.(09福建)设NA为阿伏伽德罗常数,下列叙述正确的是
 A.24g镁的原子最外层电子数为NA
A.24g镁的原子最外层电子数为NA
B.1L0.1mol·L-1乙酸溶液中H+数为0.1NA
 C.1mol甲烷分子所含质子数为10NA
C.1mol甲烷分子所含质子数为10NA
D.标准状况下,22.4L乙醇的分子数为NA
答案:C
2.(09年广东化学·6)设NA 代表阿伏加德罗常数(NA )的数值,下列说法正确的是
A.1 mol 硫酸钾中阴离子所带电荷数为NA
B.乙烯和环丙烷(C3H6 )组成的28g混合气体中含有3NA 个氢原子
C.标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为NA
D.将0.1mol氯化铁溶于1L水中,所得溶液含有0.1NA Fe3+
答案:C
3.(09年广东理基·20)设NA代表阿伏加德罗常数(NA)的数值,下列说法正确的是
A.22.4 L Cl2中含有NA个C12分子
B.1 L 0.1 mol·L-1 Na2SO4溶液中有0.1 NA个Na+
C.1 mol H2与1 mol C12反应生成NA个HCl分子
D.1 mol Ca变成Ca2+时失去的电子数为2NA
答案:D
4 .(09年海南化学·8)下列叙述正确的是(用NA代表阿伏加德罗常数的值)
.(09年海南化学·8)下列叙述正确的是(用NA代表阿伏加德罗常数的值)
 A.2.4g金属镁变为镁离子时失去的电子数为0.1NA
A.2.4g金属镁变为镁离子时失去的电子数为0.1NA
 B.1molHCl气体中的粒子数与0.5 mo1/L盐酸中溶质粒子数相等
B.1molHCl气体中的粒子数与0.5 mo1/L盐酸中溶质粒子数相等
 C.在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10 NA
C.在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10 NA
 D.CO和N2为等电子体,22.4L的CO气体与lmol N2所含的电子数相等
D.CO和N2为等电子体,22.4L的CO气体与lmol N2所含的电子数相等
答案:C
 5
5 .(09年江苏化学·4)用NA表示阿伏加德罗常数的值。下列叙述正确的是
.(09年江苏化学·4)用NA表示阿伏加德罗常数的值。下列叙述正确的是
 A.25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2NA
A.25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2NA
 B.标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA
B.标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA
 C.室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA
C.室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA
 D.标准状况下,22.4L 甲醇中含有的氧原子数为1.0NA
D.标准状况下,22.4L 甲醇中含有的氧原子数为1.0NA
6 .(09年上海化学·12)NA代表阿伏加德罗常数。下列有关叙述正确的是
.(09年上海化学·12)NA代表阿伏加德罗常数。下列有关叙述正确的是
 A.标准状况下,2.24LH2O含有的分子数等于0.1NA
A.标准状况下,2.24LH2O含有的分子数等于0.1NA
 B.常温下,100mL 1mol·L-1Na2CO3溶液中阴离子总数大于0.1NA
B.常温下,100mL 1mol·L-1Na2CO3溶液中阴离子总数大于0.1NA
 C.分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g
C.分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g
 D.3.4gNH3中含N—H键数目为0.2NA
D.3.4gNH3中含N—H键数目为0.2NA
答案:B
7.(09年浙江理综·8)用NA表示阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,5.6 L NO和5.6 L O2混合后的分子总数为0.5 NA
B.1 mol乙烷分子含有8 NA个共价键
C.58.5 g氯化钠固体中含有NA个氯化钠分子
D.在1 L 0.1 mol/L碳酸钠溶液中阴离总数大于0.1 NA
答案:D
8. (10广东理综卷)8.设 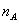 为阿伏加德罗常数的数值,下列说法正确的是
为阿伏加德罗常数的数值,下列说法正确的是
A.16g 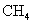 中含有4
中含有4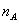 个C-H键
个C-H键
B.1mol·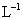
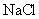 溶液含有
溶液含有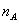 个
个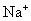
C.1mol Cu和足量稀硝酸反应产生 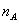 个NO分子
个NO分子
D.常温常压下,22.4L 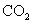 中含有
中含有 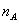 个
个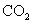 分子
分子
解析:每个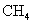 中含有4个C-H键,故16g
中含有4个C-H键,故16g 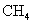 (1mol)中含有4
(1mol)中含有4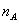 个C-H键
个C-H键
,A正确;
没有告诉溶液的体积,无法知道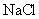 的物质的量,故B错;
的物质的量,故B错;
根据关系式,1mol Cu~2mol NO,故C错;
常温常压下,22.4L 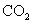 不是1mol。
不是1mol。
答案:A
9(2010福建卷)7.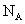 表示阿伏伽德罗常数,下列判断正确的是
表示阿伏伽德罗常数,下列判断正确的是
A.在18 中含有
中含有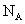 个氧原子
个氧原子
B.标准状况下,22.4L空气含有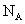 个单质分子
个单质分子
C.1 molCl2参加反应转移电子数一定为2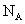
D.含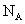 个
个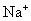 的
的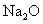 溶解于1L水中,
溶解于1L水中,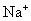 的物质的量浓度为
的物质的量浓度为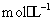
解析:本题考察阿弗加德罗常数的计算和判断
A 18 正好是0.5mol,一个氧分子正好含有两个氧原子,所以氧原子的物质的量为1mol,即为1
正好是0.5mol,一个氧分子正好含有两个氧原子,所以氧原子的物质的量为1mol,即为1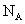
B 空气是混合物
C 在氯气与水的反应中,1molCl2 就只转移1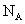 的电子
的电子
D 所得溶液中含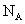 个
个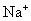 ,可得氢氧化钠的物质的量为1mol,但这时候溶液不是1L,所以物质的量浓度不是1mol/L.
,可得氢氧化钠的物质的量为1mol,但这时候溶液不是1L,所以物质的量浓度不是1mol/L.
答案:A
10(2010上海卷)7.NA表示阿伏加德罗常数,下列叙述正确的是
A.等物质的量的N2和CO所含分子数均为NA
B.1.7g H2O2中含有的电子数为0.9 NA
C.1mol Na2O2 固体中含离子总数为4 NA
D.标准状况下,2.24L戊烷所含分子数为0.1 NA
答案:B
解析:此题考查了阿伏伽德罗常数知识。阿伏伽德罗常数是指1mol任何微粒中含有的微粒数,等物质的量不一定是1mol,A错;H2O2的相对分子质量为:34,故其1.7g的物质的量为0.05mol,其每个分子中含有的电子为18个,则其1.7g中含有的电子的物质的量为0.9mol,数目为0.9NA,B对;Na2O2固体中,含有的是Na+和O22-两种离子,1mol固体中含有3mol离子,故其中的离子总数为:4 NA,C错;戊烷在标准状况下为液态,故其2.24L不是0.1mol,D错。
易错警示:进行阿伏伽德罗常数的正误判断的主要考查点有:①判断一定量的物质所含的某种粒子数目的多少;②物质的组成;③通过阿伏加德罗常数进行一些量之间的换算等,在解题时要抓住其中的易错点,准确解答。
11(2010江苏卷)5.设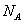 为阿伏加德罗常数的值,下列叙述正确的是
为阿伏加德罗常数的值,下列叙述正确的是
A.常温下, 的
的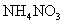 溶液中氮原子数为0.2
溶液中氮原子数为0.2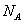
B.1mol羟基中电子数为10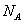
C.在反应中,每生成3mol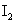 转移的电子数为6
转移的电子数为6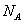
D.常温常压下,22.4L乙烯中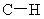 键数为4
键数为4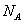
【答案】A
【解析】本题主要考查的是以阿伏伽德罗常数为载体考查如下知识点①考查22.4L/mol的正确使用;②考查在氧化还原反应中得失电子数的计算等内容。A项,无论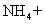 水解与否,根据元素守恒;B项,1mol羟基中有9
水解与否,根据元素守恒;B项,1mol羟基中有9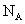 个电子;C项,在该反应中,每生成3mol
个电子;C项,在该反应中,每生成3mol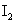 ,转移5
,转移5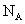 个电子;D项,常温常压下,气体摩尔体积
个电子;D项,常温常压下,气体摩尔体积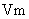 不为22.4L/mol。综上分析得知,本题选A项。
不为22.4L/mol。综上分析得知,本题选A项。
【备考提示】结合阿伏伽德罗常数为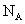 ,判断一定量的物质所含有的某种粒子数目的多少,是高考命题的热点之一,在近几年的各种高考试题中保持了相当强的连续性。这种题型所涉及的指示非常丰富,在备考复习时应多加注意,强化训练,并在平时的复习中注意知识的积累和总结。
,判断一定量的物质所含有的某种粒子数目的多少,是高考命题的热点之一,在近几年的各种高考试题中保持了相当强的连续性。这种题型所涉及的指示非常丰富,在备考复习时应多加注意,强化训练,并在平时的复习中注意知识的积累和总结。
12(2010四川理综卷)7.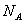 表示阿伏加德罗常数的值,下列说法正确的是
表示阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,22.4L二氯甲烷的分子数约为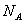 个
个
B.盛有 的密闭容器中含有
的密闭容器中含有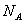 个氧原子,则
个氧原子,则 的物质的量为0.5mol
的物质的量为0.5mol
C.17.6g丙烷中所含的极性共价键为 个
个
D.电解精炼铜时,若阴极得到电子数为 个,则阳极质量减少64g
个,则阳极质量减少64g
答案:B
解析:本题考查微粒数与物质的量、物质的质量等的关系;二氯甲烷在标况下为液态,22.4L不一定为1mol,A项错误;1molSO2中含有氧原子2mol,故含有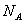 个氧原子的
个氧原子的 的物质的量为0.5mol,B项正确;17.6g丙烷的物质的量为0.4mol,1mol丙烷中含有极性键8mol,故0.4mol中含有极性键3.2mol,为3.2NA个,C项错误;精炼铜时,阳极为粗铜,当转移2mol电子时,阳极消耗的质量不一定为64g,D项错误。
的物质的量为0.5mol,B项正确;17.6g丙烷的物质的量为0.4mol,1mol丙烷中含有极性键8mol,故0.4mol中含有极性键3.2mol,为3.2NA个,C项错误;精炼铜时,阳极为粗铜,当转移2mol电子时,阳极消耗的质量不一定为64g,D项错误。
13(2010四川理综卷)12.标准状况下VL氨气溶解在1L水中(水的密度近似为1g/ml),所得溶液的密度为p g/ml,质量分数为ω,物质浓度为c mol/L,则下列关系中不正确的是
A.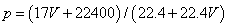 B.
B. 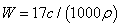
C.  D.C=1000Vρ/(17V+22400)
D.C=1000Vρ/(17V+22400)
答案:A
解析:本题考查基本概念。考生只要对基本概念熟悉,严格按照基本概念来做,弄清质量分数与物质的量浓度及密度等之间的转化关系即可。
二、高考试题中有关阿佛加德罗常数的八大陷阱
陷阱之一:标准状况与常温、常压及气态和非气态的难辨性。
例1、设N A为阿伏加德罗常数,下列说法正确的是(D )
A.常温下11.2L的甲烷气体所含分子数为0.5N A。(2007。上海。20)
B.标准状况下,5.6L四氯化碳含有分子数为0.25N A。(2008。海南。5)
C. 分子数为N A的CO、C2H4混合气体体积约为22.4L,质量为28 g。(2009。上海。12)
D. 常温、常压下,48gO3含有的氧原子个数为3 N A。(2003。江苏。14)
考查气体摩尔体积时,常用在标准状况下非气态的物质来迷惑考生。常有以下三种情况:
一是受“兄弟关系”的影响。如SO3就受SO2的影响,因SO2标况下是气体,于是很多同学定势思维认为SO3(熔点16.83℃,沸点(101.3kPa)44.8℃)也是气体。CH3Cl就常受CH2Cl2(液态)、CHCl3 (液态)、CCl4(液态)影响,认为CH3Cl(熔点: -97.7 3℃,沸点: -24.2℃)也是液体,在标況下不是气体。
二是受“蒸汽关系”的影响。如常见易挥发物质,我们习惯说水蒸汽、苯蒸汽、溴蒸汽等,于是学生便将这些物质认为在标况下是气态物质,容易受后缀影响。
三是受“溶液关系”的影响。如我们常常习惯说甲醛溶液,于是很多学生定势思维认为甲醛在标况是液态物质。其实甲醛是一种无色,有强烈刺激型气味的气体。只是易溶于水,溶液便于使用罢了。其沸点: -19.5 ℃,熔点: -118 ℃。
另外,说明气体摩尔体积也适用于混合气体。因为气体摩尔体积研究的对象是气体,而只有气体才与温度、压强有关。而质量、物质的量与温度、压强无关。
陷阱之二:物质组成的特殊性。
例2. 设N A为阿伏加德罗常数,数值约为6.02 × 10 23,下列说法不正确的是(C )
A. 46g NO2和N2O4混合气体含有原子数为3 N A 。(2004.上海。19)
B.由CO2和O2组成的混合物中共有N A分子,其中氧原子数为2N A。(2008.江苏。3)
C.9 g 重水所含的电子数为5N A 。(2004.天津理综。7)
D.14 g 乙烯和丙烯的混合物中总原子数为3N A。(2007.上海。20)
对于最简式相同的物质,质量相同,所含原子数相同。如同素异形体虽然它们的分子式不同,但只要总质量一定,其中所含的原子数就一定,与两者比例无关,对于其它同素异形体的混合物也是一样。最简式相同(也包括有机化学中的同分异构体)的物质,虽然它们的分子式不同,但它们的最简式相同,只要总质量一定,所含的原子数与两者比例无关。同分异构体的物质分子式相同所以只要总质量一定,所含的原子数也相同。?(C3H8O3、C7H8)
陷阱之三:化学反应的隐蔽性。
例3:设N A为阿伏加德罗常数,数值约为6.02 × 10 23,下列说法正确的是( D )
A.5.6 g 铁粉与硝酸反应失去电子数为0.3 NA。(2007.上海。20)
B.常温常压下,4.6 g NO2气体含有1.81× 10 23个NO2分子。(2007.广东。3)
C.1molCl2 与足量Fe反应,转移的电子数为3 NA。(2008广东。10)
D.1mol Mg与足量O2或N2生成MgO或同Mg3N2均失去2NA个电子。(2004。上海。19)
很多反应与量有关,当量不确定或不准确时,所涉及的微粒数目就不确定;二氧化氮在常温下可以二聚为四氧化二氮,具有较高的隐蔽性。
陷阱之四:电子转移数目的难判断性。
例4.设N A为阿伏加德罗常数,数值约为6.02 × 10 23,下列说法正确的是( D )
A.Na2O2与H2O反应生成1.12LO2(标准状况),反应中转移电子数为2×6.02 × 10 22.(2006.江苏。6)
B.在铜与硫的反应中,1mol铜失去电子数2N A。(2002.上海。8)
C.7.1 g 氯气与足量NaOH溶液反应转移的电子数为0.2N A.(2004.天津理综。7)
D.在H2O2+Cl2=2HCl+O2反应中,每生成32 g 氧气,则转移2 N A个电子。(2008.山东理综。13)
考查氧化还原反应中电子转移数目,特别是较为特殊的氧化还原反应如Na2O2与H2O、Cl2与NaOH等歧化反应;Cu与S、Fe与Cl2等有变价金属参加的反应;NaH与水反应生成氢气的特殊性。解题策略应该是首先书写出化学反应方程式,再用单线桥法进行标记,以弄清楚得失电子的本质。
陷阱之五:电化学基本知识的模糊性。
例5. 设N A为阿伏加德罗常数,数值约为6.02 × 10 23,下列说法正确的是( C)
A.电解食盐水若产生2 g 氢气,则转移的电子数目为2N A。(2005.广东。3)
B. 铜的电解精炼时,阳极上每转移2mol电子时就溶解铜原子数N A个。
C. 用铜作阳极电解稀硫酸溶液时,每生成1 mol氢气时,阳极上就失去2N A个电子。
D. 1mol OH-在电解过程中被氧化时,提供的电子数目为N A个。
解答电化学题目时,首先应正确书写出电极方程式,利用电子守恒、质量守恒、电荷守恒进行判断。对氯碱工业、电解精炼铜等工业题应熟悉工业流程。
陷阱之六:物质结构的复杂性。
例6. 设N A为阿伏加德罗常数,数值约为6.02 × 10 23,下列说法不正确的是(C)
A.32 g S8单质中含有的S—S键个数为6.02×1023 (2006。江苏。6)
B.12.4g白磷中含有磷原子数为0.4NA(2004北京理综)
C.常温常压下,1 mol氦气含有的核外电子数为4 NA。(1996全国)
D.0.1molOH-含NA个电子。(2003上海)
常考查稀有气体He、Ne等单原子分子,Cl2、O2、N2等双原子分子及O3、P4等多原子分子;氢氧根、甲基、羟基等中的电子数;在判断中子数时,要清楚不同核素(如氕、D、T、等)的中子数及质子数、中子数、质量数的关系。
陷阱之七:电离与水解概念的混淆性和数据的缺失性。
例:设NA代表阿佛加德罗常数(NA=6.02 × 10 23mol-1),下列说法一定正确的是( C )
A.1L 1mol/L醋酸溶液中离子总数为2NA(2004上海)
B.0.1 mol·L-1稀硫酸100mL中含有硫酸根个数为0.1NA。(2004北京理综)
C.一定温度下,1L0.50mol/L NH4Cl溶液与2L0.25mol/L NH4Cl 溶液含NH4+物质的量不同。
D. 1L浓度为lmol·L-1的Na2CO3溶液中含NA个CO32-。(2008。江苏。3)
对于弱酸根或弱碱阳离子存在的晶体中,固态时是不电离和水解的,只有在水溶液中,才电离或水解,所以要注意溶液体系中成分的复杂性。但对于离子化合物无论是在溶液中还是晶体,都有离子,其区别只不过在于能否自由移动而已。因为电离的动力来自于两个方面,一是在溶液中受水分子的作用;二是熔融时受热能的作用,所以要注意有些物质在水溶液中、熔融状态下的电离是有区别的,如NaHSO4。
陷阱之八:化学键数目的难计算性。
例1:设NA代表阿佛加德罗常数,数值约为6.02 × 10 23,下列说法正确的是 ( A 、B )
A. 1mol C10H22分子中共价键总数为31NA。(2004。天津理综。7)
B.4.5 g SiO2 晶体中含有的硅氧键数目为为0.3 × 6.02 × 10 23。(2007。江苏。8)
C.室温下,8 g甲烷含有共价键数为2NA。(2008。上海。9)
D.1mol乙烷分子中含有8 NA个共价键。(2009。浙江。8)
无机物中常涉及SiO2、Si、P4、CO2等较为复杂的物质。有机物常涉及烷烃、烯烃、炔烃等。如烷烃(CnH2n+2)中:C―H键为:2n+2(与H原子数相同),C―C为:n―1(比C原子数少1),总键数为:3n+1;烯烃或环烷烃(CnH2n)中:C―H键为:2n,C―C(视双键为两条单键)为:n,总键数为:3n;炔烃(CnH2n―2)总键数为:3n―1。
阿伏加德罗常数练习
1、下列叙述中指定粒子的数目等于阿伏加德罗常数的是 ( )
A.KMnO4分解生成1molO2转移的电子数
B.0.1molF-中含有质子数
C.46gNO2中的氧原子数(相对原子质量:N 14 O 16)
D.1 L 0.5mol·L-1Na2SO4溶液中的Na+离子数
2、设NA为阿伏加德罗常数,已知某Ba(NO3)2溶液中含有Ba (NO3)2
0.20mo1,溶液体积为1.0 L,则下列说法正确的是 ( )
A.该溶液中所含阳离子总数是0.20NA
B.该溶液中所含阴离子总数为0.20 NA
C.该溶液中所含阴、阳离子总数为0.40 NA
D.该溶液中离子和分子总数为0.30 NA
3、用NA表示阿伏加德罗常数的值,下列叙述正确的是 ( )
A、含有NA个氦原子的氦气在标准状况下的体积约为11.2L
B、25℃,1.01×105Pa,64gSO2中含有的原子数为3NA
C、在常温常压下,11.2L Cl2含有的分子数为0.5NA
D、标准状况下,11.2LH2O含有的分子数为0.5NA
4、以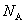 表示阿伏加德罗常数,下列说法中正确的是 ( )
表示阿伏加德罗常数,下列说法中正确的是 ( )
A.106g碳酸钠中所含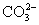 离子的个数为2
离子的个数为2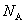 个
个
B.0.1molNH4+含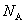 个电子
个电子
C.1.8g水中含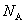 个中子
个中子
D.标准状况下11.2LSO3中含1.5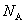 个氧原子
个氧原子
5、下列说法中正确的是(NA表示阿伏加德罗常数的值) ( )
A.53g碳酸钠中含NA个CO32- B.0.1molOH-含NA个电子
C.1.8g重水(D2O)中含NA个中子 D.标准状况下11.2L臭氧中含NA个氧原子
6、下列叙述中,正确的是 ( )
A.二氧化硫的摩尔质量是64 g B.镁的原子质量就是镁的相对原子质量
C.水的相对分子质量等于18 g D.一个氧原子的实际质量约等于16/6.02×1023 g
7、设NA 为阿伏伽德罗常数, 下列说法正确的是 ( )
A. 常温常压下, 0.1NA个H2S分子的质量为3.4g
B. 标况下, 22.4L 氖气含有2NA 个原子
C. 7.1g Cl2 变为氯离子时, 得到的电子数为0.1 NA
D. 1L 0.2mol/L 硫酸铁溶液中含有的SO42- 离子数目为0.2 NA
8、对于下列指定的微粒,数目从大到小顺序排列正确的一组是 ( )
①l mol甲烷分子中所含原子数
②6.02Ⅹ1023个 H2O 所含电子数
③标准状况下,2.24 L氧气中所含氧分子数
④12g12C里所含中子数
A.①>②>③>④ B.④>③>②>①
C.③>①>④>② D.②>④>①>③
9、用NA表示阿伏加德罗常数,下列叙述正确的是 ( )
A.18g水中含有的电子数为NA
B.a L HCl气体的分子数为
C.0.1 mol/L的Na2SO4 1 L溶液中,含有Na+的个数为0.2NA
D.23g金属钠与水反应时失去的电子数为10NA
10、设NA表示阿佛加德罗常数的值,下列说法不正确的是 ( )
A.1mol醋酸的质量与NA个醋酸分子的质量相等
B.NA个氧分子和NA个氢分子的质量比为16︰1
C.28g氮气所含原子数目为NA
D.在标准状况下,0.5NA个氯气分子所占的体积约是11.2L
11、NA为阿伏加德罗常数,下列对0.3mol/L硫酸钾溶液的说法中,正确的是( )
A.1L溶液中含0.3NA个K+ B.1L溶液中含0.9NA个离子
C.2L溶液中K+浓度是1.2mol/L D.2L溶液中含0.6NA个离子
12、设NA为阿伏加德罗常数,那么关于0.1mol/L BaCl2溶液的判断正确的是 ( )
A. 1升溶液里Ba2+ 和Cl—总数为0.3NA B. 1升溶液中含有0.1NA 个Cl—离子
C. 500毫升溶液中Ba2+的浓度是0.05mol/L
D. 500毫升溶液含有0.1NA个Ba2+离子
13、设NA表示阿伏加德罗常数的值,下列叙述正确的是 ( )
A.标准状况下,11.2L氦气所含的原子数为NA B.1.6gNH2-中所含的电子数为NA
C.常温常压下,44 g二氧化碳分子中所形成的共用电子对数为2NA
D.NA个氮气分子和NA个氢气分子的体积比一定是1∶1
14、设NA表示阿伏加德罗常数的值,下列叙述中正确的是 ( )
A.常温常压下,48gO3含有的氧原子数为3NA
B.1.8g的NH4+中含有的电子数为0.1NA
C.常温常压下,11.2 L氧气所含的原子数为NA
D.7.1 gCl2与足量Fe反应时得到的电子数为0.1NA
15、关于等质量的O2与O3,下列说法中正确的是 ( )
A.物质的量比为1∶1 B.同温同压下体积比为1∶1
C.氧原于个数比为1∶l D.密度比为1∶1
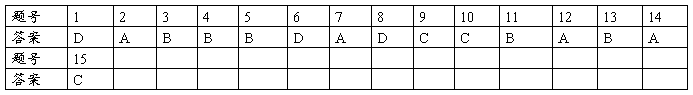
答案